菌酶联合反应制备兔血抗氧化低聚肽
周媛媛,肖 岚,鲜丹丹,周李鑫,杜双巧,杨 瑶
(四川旅游学院食品学院,四川 成都 610100)
目前,利用动物血液蛋白制备抗氧化低聚肽的研究报道较多,姜红[1]探讨了马鹿茸血酶解肽免疫活性及抗氧化活性;徐月敏[2]进行了鱼皮低聚肽和鹿血低聚肽抗氧化活性研究;肖岚等[3]对牦牛血抗氧化低聚肽的制备工艺进行了优化;安攀宇等[4]研究了菌酶联合制备猪血抗氧化低聚肽。然而,利用兔血蛋白制备抗氧化低聚肽的研究报道较为鲜见,兔血的研究报道主要集中在兔血中生物活性物质的提取及应用,韦莹珏等[5]使用硫酸铵分级沉淀、凝胶过滤层析、DEAE 离子交换层析、亲和层析、醋酸纤维薄膜电泳、凝胶电泳(SDS-PAGE)、高效液相色谱(HPLC)等方法制备了兔血清白蛋白和γ-球蛋白(IgG),并测定其相对分子量,鉴定其均一性;曾丽[6]采用新鲜兔血为原料提取超氧化物歧化酶(SOD),并以牛乳为载体,SOD 作为功能因子,研制富含SOD 的酸奶,在此过程中主要研究了超声波制备溶血液和热变性法除杂蛋白的最佳工艺条件,SOD 的纯化及其部分性质,SOD 酸奶对人工胃肠道消化液的稳定性和储藏稳定性;雷燕[7]采用利凡诺沉淀法纯化兔血清白蛋白(RSA),以RSA 为载体,以戊二醛为交联剂,采用两步交联法制备STa 与RSA 的共价偶联物,再经SDS-PAGE 鉴定偶联效果,并测定了偶联物分子量及偶联比。
我国是世界排名第一的兔产品出口大国[8],兔血资源极为丰富。然而,由于兔血血腥味较重、口感差、不利于人体消化等原因,导致大量兔血被丢弃,并未得到充分利用[9]。这不仅造成蛋白质资源的浪费,而且对环境造成严重污染。本试验拟将枯草芽孢杆菌发酵与碱性蛋白酶酶解结合建立菌酶联合的方法制备兔血抗氧化低聚肽,通过单因素试验并结合响应面试验优化兔血抗氧化低聚肽的制备工艺,以ABTS+·清除率和多肽含量作为体外抗氧化活性评价指标,确定菌酶联合法制备兔血抗氧化低聚肽的最佳工艺参数,为其工业化生产以及在食品添加剂、医疗、保健用品等领域的开发利用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
兔血:家云鲜兔火锅店购买(成都市龙泉驿区);枯草芽孢杆菌(SICC.197.菌种):四川省微生物资源平台菌种保藏中心;Lowry 法蛋白浓度测定试剂盒:北京索莱宝科技有限公司;碱性蛋白酶(酶活力85.61 U/mg):上海 Kayon 公司;牛肉膏、琼脂、葡萄糖、蛋白胨、氯化钠、ABTS、K2S2O8、三氯乙酸(TCA)、磷酸氢二钠、磷酸二氢钠等,成都科龙试剂有限公司。
1.1.2 仪器与设备
XW-80A 型漩涡混合器:上海驰塘电子有限公司;GZ-150-S 型生化培养箱:韶关市广智科技有限公司;各规格移液枪:德国Brand 公司;超滤管(<5 kDa):德国 Sartorius 公司;FALL04N 型电子天平:常州市衡正电子仪器有限公司;UV Power紫外可见分光光度计:北京莱伯泰科有限公司;XHF-D 型高速分散器:宁波新芝生物科技有限公司;GM-0.33 型隔膜真空泵:天津市津腾实验设备有限公司;WP-UP-UV-20 超纯水机:四川沃特尔科技有限公司;JJ-CJ-2FD 型洁净工作台:苏州市金净净化设备科技发展有限公司;HHS-8S 型电子恒温不锈钢水浴锅:上海光地仪器有限公司;H2050R台式高速冷冻离心机:长沙湘仪离心机有限公司;QYC-2102C 恒温振荡培养箱:上海福玛实验设备有限公司;STARTER 3100 pH 计:上海奥豪斯设备有限公司。
1.2 方法
1.2.1 枯草芽孢杆菌发酵兔血工艺的优化
挑取活化后的枯草芽孢杆菌,接入装有50.00 mL液体培养基的锥形瓶中[10],放在恒温振荡培养箱中培养,温度为 35 ℃,转速 135 r/min,培养 12 h,得到种子培养液(1×109CFU/mL)。以多肽含量作为评价指标,选取底物浓度、接菌量、发酵时间(发酵温度35 ℃、pH 9.8)3 个因素进行单因素试验[11]。
(1)接菌量:在250 mL 锥形瓶中配制浓度为10 g/mL 的兔血匀浆 100 mL,121 ℃(0.2 MPa)下灭菌20 min。分别接入 2.5、3.5、4.5、5.5、6.5 mL 种子液,35 ℃、135 r/min 振荡培养箱中培养 3.0 d。
(2)底物浓度:在250 mL 锥形瓶中配制浓度分别为 6、8、10、12、14 g/mL 的兔血匀浆 100 mL,在 121 ℃(0.2 MPa)下灭菌 20 min,接入 4.5 mL 种子液,35 ℃、135 r/min 振荡培养箱中培养3.0 d。
(3)发酵时间:在250 mL 的锥形瓶中配制浓度为 10 g/mL 的兔血匀浆 100 mL,121 ℃(0.2 MPa)下灭菌 20 min,接入 4.5 mL 的种子液,35 ℃,135 r/min 振荡培养箱中分别培养 2.0、2.5、3.0、3.5、4.0 d。
在单因素试验结果的基础上,以ABTS·+清除率作为响应值(Y1),对兔血发酵底物浓度、发酵时间、枯草芽孢杆菌接种量因素进行Box-Behnken Design(BBD)响应面优化试验,得出制备兔血抗氧化低聚肽的最佳发酵工艺。响应面试验设计见表1。

表1 发酵工艺响应面试验因素及水平Table 1 Factors and levels of response surface experiments to optimize fermentation process
1.2.2 酶解兔血的工艺优化
将最优条件制备的兔血发酵解液于6 000 r·min-1离心15 min 得上清液,研究酶底比、pH、酶解温度、酶解时间对上清液中ABTS+·清除率的影响。
(1)酶底比:100 mL 兔血发酵上清液在 60 ℃,pH为 9.8,酶底比分别为 100、200、300、400、500 U/g 条件下酶解3.0 h。
(2)pH:100 mL 兔血发酵上清液在 60 ℃,酶底比300 U/g,pH 分别为 8.6、9.2、9.8、10.4、11.0 条件下酶解3.0 h。
(3)酶解温度:100 mL 兔血发酵上清液分别在温度50、55、60、65、70 ℃,pH 为 9.8,酶底比 300 U/g 条件下发酵3.0 h。
(4)酶解时间:100 mL 兔血发酵上清液在60 ℃,pH为 9.8,酶底比 300 U/g 条件下分别发酵 2.0、2.5、3.0、3.5、4.0 h。
多肽含量对低聚肽的生物活性也会产生影响。因此,本试验根据单因素试验结果,以兔血低聚肽多肽含量为响应值(Y2),以酶底比、pH、酶解温度、酶解时间为特征值,通过Box-Behnken Design 响应面试验优化兔血抗氧化低聚肽的酶解工艺。响应面试验因素及水平见表2。

表2 酶解工艺响应面试验因素及水平Table 2 Factors and levels of response surface experiments to optimize enzymatic process
1.2.3 兔血抗氧化低聚肽超滤处理
对菌酶联合法制备的兔血抗氧化低聚肽采用截留分子量为0~5 kD 的超滤膜进行离心分离(4 ℃,4 000 r/min,10 min),获得分子量<5 kD 的兔血抗氧化低聚肽[4]。
1.2.4 测定项目与方法
1.2.4.1 多肽含量
参照陈昌琳等[12]的方法,取4 mL 15%(m/V)的三氯乙酸水溶液,再加入同等体积的多肽样品于涡旋混合器上均匀混合,静置使大分子蛋白沉淀,在高速离心机6 000 r/min 转速下离心15 min,再用Lowry 法测定上清液中的多肽含量。
1.2.4.2 ABTS+·清除率
将浓度为7.00mmol/L 的ABTS 溶液与2.45 mmol/L的K2S2O8溶液等体积混合均匀,混合液置于室温避光条件下静置12~16 h,以磷酸盐缓冲液(0.20 mol/L,pH 7.4)稀释混合液,使其在734 nm 时吸光度达到0.70±0.02,形成墨绿色 ABTS+·测定液。
取4.00 mL 的ABTS+·测定液,加入待测溶液100 μL,振荡 30 s,测定溶液在 734 nm 处的吸光值。空白管用磷酸盐缓冲液代替样品,对照管用磷酸盐缓冲液代替ABTS+·测定液。
ABTS+·清除率计算公式如下:
ABTS+·清除率(%)=[A0-(A1-A2)]/A0×100
式中:A0为空白管的吸光度;A1为测定样品的吸光度;A2为对照管的吸光度。
1.2.5 数据处理
2 结果与分析
2.1 兔血枯草芽孢杆菌发酵工艺优化结果
2.1.1 枯草芽孢杆菌发酵兔血单因素试验结果

图1 接菌量对多肽含量的影响Fig.1 Effects of inoculum amount on polypeptide content
如图1 所示,枯草芽孢杆菌发酵上清液中的多肽含量呈先升高后下降的变化趋势,这与适当的枯草芽孢杆菌接种量有关,当接菌量为4.5 mL 时,多肽含量达到最高值2.19 mg/mL,与多肽含量最低值(1.15 mg/mL)差异显著(P<0.05)。
如图2 所示,发酵上清液中的多肽含量随底物浓度的增加显著升高,当底物浓度为10 g/mL 时,达到最高值2.75 mg/mL,之后随着底物浓度增加,多肽含量反而下降。

图2 底物浓度对多肽含量的影响Fig.2 Effects of substrate concentration on polypeptide content
如图3 所示,发酵时间对发酵上清液多肽含量的影响显著,随发酵时间的延长,发酵上清液中多肽含量上升,当发酵时间为3.5 d 时达到最高值2.54 mg/mL,随后(4 d)降为1.56 mg/mL,这可能与枯草芽孢杆菌的过度发酵降解了多肽有关。

图3 发酵时间对多肽含量的影响Fig.3 Effects of fermentation time on polypeptide content
2.1.2 枯草芽孢杆菌发酵兔血响应面试验
利用Design Expert 软件对响应面试验数据进行多元回归拟合分析,结果见表3。对该模型进行方差分析,结果见表4。
由表4 所示,此模型的P<0.000 1,即响应面回归模型极显著,失拟项(P=0.129 8>0.05)不显著,说明非试验因素对试验结果的影响不大。
决定系数R2为0.997 5,校正后的决定系数为0.994 2,与R2接近,表明该模型与实际试验拟合较好,该模型能够解释ABTS+·清除率有99.42%的变化来源于所选变量,因此该模型方程在试验范围内,能够适用于预测发酵条件对兔血低聚肽ABTS+·清除率影响的分析。从表4 还可以看出对 ABTS+·清除率影响极显著(P<0.01),X3的影响显著(P<0.05),即接菌量、底物浓度、发酵时间以及接菌量与发酵时间的交互作用对兔血低聚肽的ABTS+·清除率有显著影响,且各因素对ABTS+·清除率影响程度由大到小为:底物浓度>接菌量>发酵时间。

表4 回归模型方差分析表Table 4 Analysis of variance for regression model
对表3 中的数据进行回归拟合分析,以发酵上清液ABTS+·清除率为响应值(Y1),得到各因素对响应值的二次多项回归方程为:

由方程预测的枯草芽孢杆菌发酵兔血最佳工艺为:接菌量5.58 CFU/mL,底物浓度10.74 g/mL,发酵时间3.55 d,此时ABTS+·清除率为84.64%。为了方便实际操作,将优化条件调整为:接菌量5.5 CFU/mL,底物浓度10 g/mL,发酵时间3.5 d,该条件下测得的ABTS+·清除率为84.42%,接近于理论值,多肽含量为2.84 mg/mL。
通过回归方程所作出响应面曲面图及等高线见图4,可直观反映接菌量与发酵时间交互作用对发酵上清液ABTS+·清除率的影响。由图4 可见,响应面曲面坡度较陡,说明交互作用对响应值影响显著,这与表4 中方差分析一致。

图4 接菌量与发酵时间的交互作用对发酵上清液ABTS+·清除率的影响Fig.4 Influence of interaction between inoculation amount and fermentation time on ABTS+·clearance rate of fermentation supernatant
2.2 酶解工艺优化结果
2.2.1 酶解单因素试验结果
为了进一步提升兔血低聚肽的抗氧化活性,通过单因素试验初步筛选碱性蛋白酶酶解兔血发酵上清液的工艺参数。由图5 可知,ABTS+·清除率随酶底比的增高呈先上升后下降趋势,当酶底比为200 U/g时,ABTS+·清除率最高,为 87.58%,此时的 ABTS+·清除率显著高于其他酶底比处理(P<0.05)。此外,关于酶底比进一步增加而ABTS+·清除率下降,可能与过量碱性蛋白酶有关,导致某些具有抗氧化活性的多肽、寡肽过度酶解。

图5 酶底比对ABTS+·清除率的影响Fig.5 Effects of enzyme-substrate ratio on ABTS+·clearance rate
如图6 所示,pH 对ABTS+·清除率的影响显著,ABTS+·清除率随pH 的增加而增加,当pH 为10.4 时,ABTS+·清除率达到最高值82.79%;然而pH 进一步增加ABTS+·清除率降低,这可能与碱性蛋白酶的最适pH 有关,从而影响其对兔血低聚肽的酶解程度,特别是具有抗氧化活性的兔血低聚肽的产生。

图6 pH 对ABTS+·清除率的影响Fig.6 Effects of pH on ABTS+·clearance rate
由图7 可知,随着酶解温度的升高,ABTS+·清除率增加,酶解温度65 ℃时,ABTS+·清除率最高,为83.56%,酶解温度进一步升高,ABTS+·清除率降低,这与碱性蛋白酶的最适酶解温度有关。

图7 酶解温度对ABTS+·清除率的影响Fig.7 Effects of enzymolysis temperature on ABTS+·clearance rate
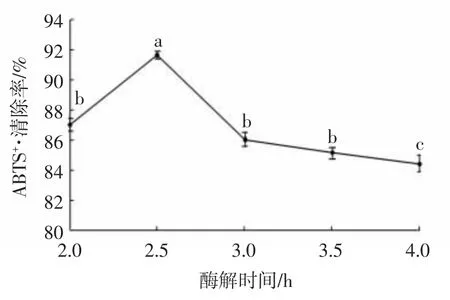
图8 酶解时间对ABTS+·清除率的影响Fig.8 Effects of enzymolysis time on ABTS+·clearance rate
由图8 可知,酶解时间对ABTS+·清除率的影响显著,随着酶解时间的延长,ABTS+·清除率呈先上升后下降趋势。碱性蛋白酶对兔血发酵上清液的酶解时间将直接影响兔血低聚肽的肽段组成,特别是具有抗氧化活性的肽段的数量。当酶解时间为2.5 h 时,ABTS+·清除率最高,达到91.63%。
2.2.2 酶解响应面试验
在单因素试验的基础上,对兔血低聚肽多肽含量进行响应面优化试验,试验结果见表5。对回归模型的方差分析见表6。
运用Design-Expert 6.0 软件对表5 中的试验数据进行二次多元回归拟合,得到二次多元回归方程:
Y2=3.85+0.095A+0.098B-0.17C+0.25D-0.021AB+0.14AC+0.053AD+0.090BC+0.14BD+0.024CD-0.30A2-0.27B2-0.58C2-0.51D2
由表6 可知,模型的P<0.000 1,即响应面回归模型极显著,失拟项(P=0.109 3>0.05)不显著,说明非试验因素对试验结果的影响不大;各因素对兔血低聚肽多肽含量的影响程度由大到小为:D>C>B>A,即酶解温度的影响最大,其次是pH 和酶解时间,酶底比的影响最小。交互项中,AC(酶底比和pH)和BD(酶解时间和酶解温度)对多肽含量的影响显著(P<0.05),二次项中 A2、B2、C2和 D2对多肽含量的影响极显著(P<0.01)。

表5 酶解工艺响应面试验设计方案及结果Table 5 Experimental design and results for response surface analysis to optimize enzymatic process

表6 回归模型方差分析Table 6 Analysis of variance for regression model

续表6 回归模型方差分析Continue table 6 Analysis of variance for regression model
图9 和图10 分别表示酶底比与pH、酶解时间与酶解温度的交互作用对兔血低聚肽多肽含量影响的响应曲面图,坡度均较明显,与表6 结果相符。

图9 酶底比与pH 的交互作用对多肽含量影响的响应曲面图和等高线图Fig.9 Response surface and contour diagrams of the effect of interaction between enzyme-substrate ratio and pH on polypeptide content

图10 酶解时间与酶解温度的交互作用对多肽含量影响的响应曲面图和等高线图Fig.10 Response surface and contour diagrams of the effect of interaction between the enzymolysis time and temperature on polypeptide content
通过Design-Expert 6.0 软件对试验结果进行响应面优化,得到最佳酶解兔血条件为:酶底比214.83 U/g,酶解时间2.62 h,pH 10.34,酶解温度61.40 ℃,此时多肽含量为3.91 mg/mL。为了验证预测值与理论值之间的拟合,检查其可靠性,根据实际可行性,为便于工业化生产,对上述酶解条件进行修正,最终优化的条件为:酶底比 200 U/g,酶解时间 2.5 h,pH 10.4,酶解温度60 ℃,经过3 次平行试验,ABTS+·清除率为87.22%,多肽含量为(3.81±0.42) mg/mL,与理论预测值较接近,说明该模型能较好地预测实际多肽含量。
3 结论
本试验采用菌酶联合法制备兔血抗氧化低聚肽,并通过单因素试验和响应面法优化得到其最优制备工艺,枯草芽孢杆菌发酵兔血最佳工艺为:接菌量5.5 CFU/mL,底物浓度10 g/mL,发酵时间3.5 d,此时ABTS·+清除率为84.42%,多肽含量为2.84 mg/mL;酶解最优工艺为:酶底比200 U/g,酶解时间2.5 h,pH 10.4,酶解温度60 ℃,此时多肽含量为3.81 mg/mL,ABTS+·清除率为87.22%。
综上,本试验采用菌酶联合法制备兔血抗氧化低聚肽,较传统的微生物发酵法[13]或酶解法可提高兔血低聚肽的抗氧化活性以及多肽的含量,降低商业酶的使用量。

