基于代谢组学分析Slr0643蛋白在调控集胞藻PCC6803葡萄糖混养适应中的重要性
许白雪,陈谷,刘秤利,周健
(华南理工大学食品科学与工程学院,广东广州 510640)
蓝藻是地球上最主要的光合生物之一,它们可以利用光作为能源,吸收二氧化碳并产生氧气,对当今地球的生存环境起着至关重要的作用[1]。虽然蓝藻主要是在光自养条件下生长,但有些种类在有机碳源存在的情况下也能进行光混养或异养。集胞藻PCC6803(Synechocystissp.PCC6803)作为一种模式蓝藻,可以在光混养和异养条件下,通过糖酵解、不完全的TCA循环以及氧化磷酸戊糖(OPP)途径来代谢葡萄糖,生成ATP、NADPH和碳骨架,同时葡萄糖代谢水平和呼吸作用增强[2,3]。
在过去的几十年里,已经发现了许多对集胞藻在光混养条件下生长至关重要的基因。一些是起调控作用的基因,例如:三个组氨酸激酶:Hik31(sll0790)、Hik8(sll0750)和Hik33(sll0698),它们在葡萄糖代谢中扮演主要的角色。Δhik31突变体会失去葡糖激酶活性,变得对葡萄糖更加敏感[4],hik8的缺失将会阻止基因gap1(编码GAPDH)的转录,导致细胞不能在葡萄糖存在时生长[5]。相比之下,hik33敲除突变体的在光自养条件下生长受到严重抑制,而在加入葡萄糖之后这种抑制出现了缓解,主要是因为在此条件下突变体中OPP途径中的酶的表达明显上调,而在野生型中并没有这种现象[6]。编码假想调控蛋白的基因pmgA(sll1968)以及水通道蛋白AqpZ(slr2057),都受到基因sll1961的正向调控,它们在葡萄糖代谢中至关重要,它们的缺失突变体会变得对葡萄糖更加敏感[7]。pmgA(sll1968)的缺失破坏了OPP途径和卡尔文循环之间的碳流平衡,阻止了突变体在光异养条件下的持续生长[3]。转录调节因子 CyabrB2(sll0822)对当细胞从自养转移至光异养条件下时细胞代谢的激活至关重要,sll0822的敲除突变体可能使碳代谢失调,从而丧失生存能力[8]。SigE是RNA聚合酶中的一种sigma因子,其突变会使OPP通路的关键酶出现下调,同时葡萄糖摄取率下降[9]。此外,一些特定的蛋白质也参与了集胞藻对葡萄糖混养的适应,它们的突变体均表现出对葡萄糖敏感的表型。Sml0013是NAD(P)H脱氢酶(NDH)亚基,它的突变体使通过呼吸或光合电子流能力下降,从而变得对葡萄糖更加敏感[10]。sll1028(编码二氧化碳浓缩机制蛋白CcmK2)、slr1916(编码酯酶)、slr1860(icfG)和sml0005(编码PSII的跨膜成分)的突变体也显示出了葡萄糖敏感性[11]。最近的一项研究表明,非编码RNA Ncr0700通过调节糖原积累参与葡萄糖的适应,并在PmgA下游发挥作用[12]。
代谢组学技术可以鉴别出细胞内大量的小分子及其丰度的差异,因此被广泛用于分析微生物面对环境胁迫时出现的变化。非靶向气相色谱-质谱(GC-MS)代谢组学相对于靶向液相色谱-质谱(LC-MS)而言,可以检测到更多的代谢物,其中包括一些稳定的小分子,如氨基酸,糖类以及有机酸等[1]。S2P蛋白酶最早在人体内被发现,在人体内甾醇和脂肪酸的合成中起调节作用[13]。集胞藻 PCC6803中共存在4个S2P蛋白酶,分别为Slr0862、Slr0643、Sll0528和Slr1821。我们以前的研究已经表明Sll0528参与各种环境胁迫,包括盐、寒冷、高渗和铵盐等,Δsll0528突变体在这些环境中比野生型更敏感[14,15]。Slr0862参与调控着热胁迫和氧化胁迫[16],Slr1821在热胁迫适应中发挥着重要作用[17],Slr0643在适应酸胁迫中起关键作用[18]。本文通过GC-MS技术对葡萄糖混养下的野生型和Δslr0643突变体中的代谢物进行研究,结合差异代谢物及代谢通路分析,从代谢组学的角度上揭示了 Slr0643在集胞藻适应葡萄糖混养中的重要作用。
1 材料与方法
1.1 实验材料与仪器
主要材料:甲醇(CNW)、氯仿(Adamas)、吡啶(Adamas)、甲氧铵盐(TCI)、L-2-氯苯丙氨酸,上海恒柏生物科技;BSTFA(REGIS)、饱和脂肪酸甲酯(REGIS)、ddH2O(纯水仪)、葡萄糖,北京普博欣生物;BG11培养基,实验室自配;集胞藻PCC6803野生型,购自ATCC菌种库;集胞藻PCC6803Δslr0643突变体,实验室构建。
主要仪器:气相色谱(Agilent,7890B)、质谱仪(LECO,PEGASUS HT)、色谱柱(Agilent,DB-5MS)、离心机(Thermo Fisher Scientific,Heraeus Fresco17)、超低温冰箱(Thermo Fisher Scientific,Forma 900 series)、分析天平(Sartorius,BSA124S-CW)、研磨仪(JXFSTPRP-24),上海净信科技有限公司;纯水仪(Merck Millipore,明澈 D24 UV)、超声仪(YM-080S),深圳市方奥微电子有限公司;烘箱(DHG-9023A),上海一恒科学仪器有限公司;真空干燥仪(LNG-T98),太仓市华美生化仪器厂;紫外可见分光光度计(UV-2300Ⅱ),上海天美科学仪器有限公司;葡萄糖分析仪(SBA-40C),北京金洋万达科技公司。
1.2 实验方法
1.2.1 菌株的培养
所有菌株培养于20 mM HEPES-NaOH(pH 7.5)的 BG-11 培养基中,培养条件为 28 ℃,30 μE/(m2·s),120 r/min。葡萄糖混养需要在BG11培养基中加入2.5 mM葡萄糖,所有溶液和培养基均进行高温高压灭菌。
1.2.2 生理参数的测定方法
1.2.2.1 生长曲线的测定
在需要测定的时间点对藻液进行取样,将紫外分光光度计设置为单点测量模式,用培养基调零之后,测其730 nm下的吸光度,每组样品做三个平行,最后根据时间与吸光度值绘制生长曲线。
1.2.2.2 培养基上清中葡萄糖含量的测定
向BG11培养基中加入2.5 mM葡萄糖,然后放入光照培养箱中进行混养培养,每隔两小时进行一次取样,每组样品设置三个平行,在离心机中经 10000 r/min离心2 min后,吸取上清至2 mL离心管中,用葡萄糖分析仪进行葡萄糖含量的测定,具体步骤为:开机之后,先吸取20 μL葡萄糖标准溶液(0~1 g/L)进行定标,反复操作至仪器显示定标成功,再依次打入待测样品,每个样品测完需清洗仪器再进行下一次的测定。
1.2.3 样本制备及代谢物提取
当野生藻株和Δslr0643藻株在光自养条件下生长至对数生长期时(OD=0.8),向培养基中加入2.5 mM葡萄糖,继续培养0 h、4 h、10 h、16 h、24 h后,收集藻泥(0 h样品在加入葡萄糖前收集),液氮速冻存于-80 ℃保存,每组四个平行。
藻泥样本中加入5000 μL预冷提取液(甲醇:氯仿=3:1,V/V),再加入5 μL 2-氯苯丙氨酸,涡旋30 s;加入瓷珠,35 Hz研磨仪处理4 min,超声5 min(冰水浴);样品4 ℃离心,10000 r/min离心10 min;取400 μL上清于1.5 mL离心管中,每个样本各取60 μL混合成QC样本;在真空浓缩器中干燥提取物;向干燥后的代谢物加入40 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶20 mg/mL),轻轻混匀后,放入烘箱中80 ℃孵育30 min;向每个样品中加入60 μL BSTFA(含有1% TMCS,V/V),将混合物70 ℃孵育1.5 h;冷却至室温,向混合的样本中加入5 μL FAMEs(溶于氯仿);随机顺序上机检测。
1.2.4 代谢物检测
Agilent 7890气相色谱-飞行时间质谱联用仪配有Agilent DB-5MS 毛细管柱(30 m×250 μm×0.25 μm),GC-TOF-MS具体分析条件如表1所示。

表1 GC-MS仪器参数Table 1 Instrument parameters of GC-MS
1.2.5 数据分析
使用ChromaTOF软件(V 4.3x,LECO)对质谱数据进行了峰提取、基线矫正、解卷积、峰积分、峰对齐等预处理。对物质定性工作中,使用了LECO-Fiehn Rtx5数据库,包括质谱匹配及保留时间指数匹配。最后,将 QC样本中检出率 50%以下或RSD>30%的峰去除。利用软件SIMCA-P 14.0及在线网 络 软 件 Metabo Analyst 4.0(http://www.metaboanalyst.ca/Metabo Analyst)对数据归一化和中心标准化后,进行热图和偏最小二乘判别分析(partical least-sequares dis-criminant analysis,PLS-DA)分析,根据变量对分组贡献值(variableimportance in the projection,VIP)大于1和变化显著性p<0.05对差异代谢产物进行筛选,然后利用Metabo Analyst 4.0进行代谢通路的分析。
2 结果与讨论
2.1 葡萄糖混养条件下的生理表征

图1 葡萄糖混养下的生理表征Fig.1 Physiological characteristics in glucose mixotrophic acclimation
为了探究slr0643基因在混养条件下的表型变化,将基因slr0643的敲除突变体(Δslr0643)藻株和野生型(WT)藻株分别在自养和2.5 mM葡萄糖混养的条件下培养来测定其生长曲线,结果见图1a。自养条件下,Δslr0643藻株的生长速率和WT藻株无显著差异。葡萄糖混养时,WT藻株因为吸收了额外的有机碳源而生长速率明显快于自养条件,在混养第4 d时,其OD730增长到了到了0.91。Δslr0643藻株的生长受到了混养的抑制,其混养第4 d时的OD730仅为0.43,仅为野生型藻株的47.25%。图1b检测了混养后24 h内,两种藻株培养液上清中葡萄糖含量的变化。结果表明,野生型藻株培养液内葡萄糖的消耗速率显著高于Δslr0643藻株,且在混养22 h后已将培养液中葡萄糖完全消耗,而Δslr0643藻株混养24 h后的培养液中仍然剩余0.18 mM葡萄糖未被消耗。上述结果表明,在自养条件下,slr0643的缺失并不影响细胞生长,而在葡萄糖混养时,它的缺失会显著抑制细胞的生长、造成细胞无法正常利用葡萄糖。前期研究表明,编码假想调控蛋白的基因sll1968以及编码水通道蛋白AqpZ的基因slr2057在集胞藻PCC6803葡萄糖代谢中至关重要,它们的缺失突变体也会变得对葡萄糖更加敏感,且它们通过参与糖酵解、戊糖磷酸途径等代谢途径来影响细胞对葡萄糖的利用[7]。基于本研究生理实验的结果,我们推测 Slr0643蛋白可能参与了集胞藻 PCC6803葡萄糖混养适应的调控。然而,Slr0643调控集胞藻PCC6803葡萄糖混养适应的代谢机制目前尚不明确,需利用代谢组学进行进一步分析。
2.2 代谢组学差异分析
2.2.1 整体差异代谢物分析

图2 整体差异代谢物的PLS-DA得分图Fig.2 PLS-DA scores plot of global differential metabolites
采用热图以及PLS-DA模型对葡萄糖混养不同时间后野生型藻株(W0:0 h,W4:4 h,W10:10 h,W16:16 h,W24:24 h)及Δslr0643藻株(M0:0 h,M4:4 h,M10:10 h,M16:16 h,M24:24 h)整体代谢物的差异进行了直观比较。图3为整体代谢物及样品的双向聚类,从图中我们可以看到,同一组样本的四个平行之间代谢物上下调一致,表明了样本之间的平行性及稳定性良好。图2为PLS-DA得分图,同一组样本的四个平行聚集在一起,不同组样本分开,表明此模型可以很好的帮助我们了解组间差异。图中可以看到,野生型藻株在不同混养时间下的分离比Δslr0643藻株更加明显,表明在混养条件下,野生型藻株比Δslr0643藻株代谢更加活跃,代谢物质差异更加明显,这个结果与生理实验中野生型藻株的生长和葡萄糖利用速率比Δslr0643藻株更快的结果一致。另外,在16 h和24 h时,野生型和突变体出现重叠,表明此时两者的差异相对于之前减小。

图3 整体差异代谢物的热图Fig.3 The heat map of global differential metabolite
2.2.2 野生型与Δslr0643突变体间差异代谢物的鉴定

表2 野生型藻株不同混养时间代谢标志物的变化Table 2 Fold changes of identified biomarkers in WT with different mixed culture times
为了进一步明确葡萄糖混养过程中,Δslr0643藻株和野生型藻株在代谢产物方面的差异,我们分别对不同混养时间野生型藻株和Δslr0643藻株中的差异代谢物的动态变化进行了比较,得到了两种藻株差异代谢物动态变化的PLS-DA荷载图(图4a,4b),结合VIP>1及p<0.05共同筛选来寻找贡献大的代谢物。表2和表3分别列出了野生型藻株和Δslr0643藻株在不同混养阶段的差异标志代谢物以及它们相对于自养时的变化量。

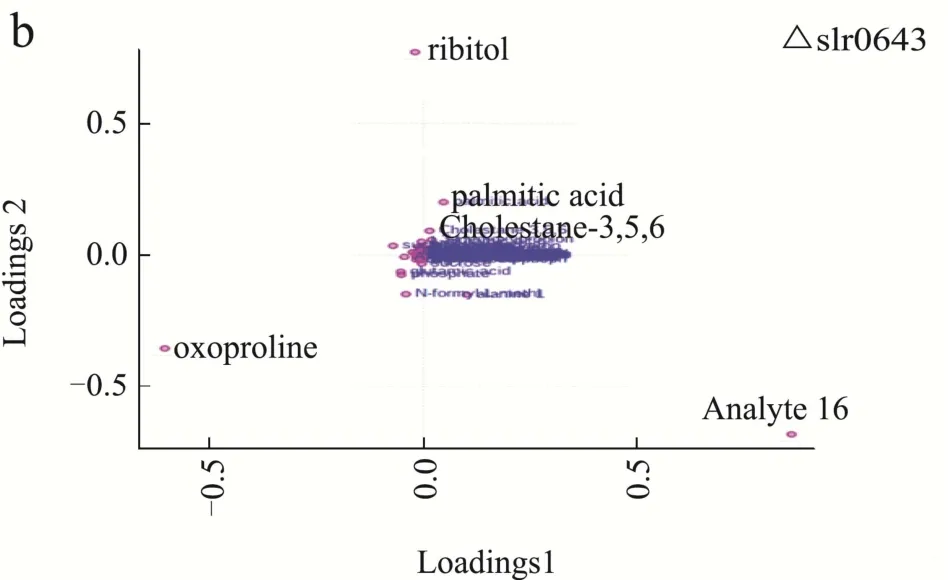
图4 不同培养时间下差异代谢物的PLS-DA荷载图Fig.4 PLS-DA loadings plots of differential metabolites with different culture times

表3 Δslr0643藻株间不同时间代谢标志物的变化Table 3 Fold changes of identified biomarkers in Δslr0643 with different mixed culture times
从表中可以看出,这些差异标志物主要为糖类,氨基酸,有机酸,脂肪酸等。代谢标志物大部分相同,但表达量却差异很大。其中,野生型藻株中有关糖代谢的标志物如蔗糖,琥珀酸,苹果酸,乳酸,3-羟基丙酸,核糖醇等在葡萄糖加入后均大幅上升,表明其混养时利用葡萄糖的速度加快,而Δslr0643藻株突变体中糖代谢标志物的数量下降,其中,蔗糖及3-羟基丙酸的表达量均低于野生型藻株,唯一参与三羧酸循环的标志物琥珀酸表达量在加入葡萄糖后始终呈现下调状态。研究显示,高产3-羟基丙酸的集胞藻菌株相对于野生型藻株,其中心碳代谢的水平会明显提高[19],因此,结合我们的数据可以推测,野生型藻株混养时的中心碳代谢途径得到加强,使得细胞生长加快,而slr0643的缺失,导致了细胞内葡萄糖代谢的效率下降,从而利用葡萄糖的速度下降。从表2和表3中还可以发现,混养24 h后,野生型藻株中蔗糖的含量低于Δslr0643藻株。事实上,根据上清中葡萄糖含量的变化曲线(图1b)可以发现,混养24 h后,野生型藻株培养基中葡萄糖已经消耗完毕,而Δslr0643藻株培养基中葡萄糖还没有被完全消耗,故此时Δslr0643藻株转化生成蔗糖的量高于野生型藻株。另外,从表2和表3中发现,野生型藻株中氨基酸的表含量高于Δslr0643藻株。当微藻处于缺氮和缺碳环境时,氨基酸的含量会减少,故slr0643的缺失似乎影响了细胞对碳、氮等营养物质的吸收,从而导致了藻株生长速率变慢。棕榈酸的含量在两种藻株中没有明显差别,且在混养过程中变化不大。固醇类物质 3β,5α,6β-三羟基胆甾烷只在Δslr0643藻株标志物中出现,在混养后期表达量均未下降,故可推测slr0643的突变影响了部分脂质的合成。
2.2.3 差异代谢物代谢通路分析

图5 混养过程中Δslr0643藻株相对于野生型藻株代谢标志物的通路富集分析Fig.5 Pathway enrichment analysis of biomarkers in Δslr0643 compared to WT with different mixed culture times
为了进一步了解差异代谢物所处的代谢通路,按照VIP>1及p<0.05的筛选标准,分别对比各个时间点下Δslr0643藻株相对于野生型藻株的变化情况,筛选出差异标志物,然后将这些差异标志物输入Metabo Analyst 4.0中的代谢通路富集分析模块进行代谢物的通路分析[20],结果如图5所示。这些差异标志物主要涉及到8条代谢途径。其中,三羧酸循环,丙酮酸代谢等糖代谢途径以及谷氨酸,缬氨酸等氨基酸代谢途径的显著富集,Δslr0643藻株和野生型藻株的代谢在这些通路上出现了明显的差异,结合之前对代谢标志物的分析可以看出,Δslr0643藻株无法正常利用葡萄糖,从而影响了糖代谢,进而导致了氮源吸收的减少、氨基酸合成变慢。烟酰胺是NAD和NADH的主要成分,而NAD和NADH作为递氢的辅酶,在细胞的各种代谢途径中均起着重要的作用,因此,烟酰胺代谢的差异可能是导致糖代谢差异的重要原因之一。
磷酸肌醇是重要的信号分子,与植物体的抗胁迫过程密切相关。有研究指出,苜蓿的单磷酸肌醇合成酶(MIPS)转基因株对盐、冷等非生物胁迫的适应性增加[21],拟南芥中MIPS转基因株对盐的耐受程度同样提高了[22]。因此,本研究中磷酸肌醇代谢通路的差异可能导致了野生型藻株和Δslr0643藻株适应葡萄糖混养适应能力的差异。值得注意的是,丁酸甲酯代谢通路差异较为明显,丁酸甲酯可以合成乙酰辅酶A,而后者是生物体内各个能量代谢必不可少的物质。此前一些研究指出,参与集胞藻葡萄糖混养适应的蛋白有Slr0280(一种周质蛋白)、Sml0013(NAD(P)H脱氢酶亚基)、CcmK2(二氧化碳浓缩机制蛋白,由sll1028编码)以及非编码RNA Ncr0700等,主要是通过调节糖酵解、三羧酸循环、糖原分解代谢、戊糖磷酸通路和卡尔文循环等途径中的代谢物或者酶的活性,从而参与调节细胞对葡萄糖的适应[2,10,12],它们可能与Slr0643调控集胞藻葡萄糖混养适应机制存在着密切的联系。综上可以看出,Slr0643的缺失导致了集胞藻细胞内葡萄糖混养适应混养时的糖代谢、氨基酸代谢、磷酸肌醇代谢和乙酸甲酯代谢等途径的代谢物出现较大差异,由此推测,Slr0643通过直接或间接地参与这些代谢途径来调节集胞藻葡萄糖混养适应。另外,之前通过对Slr0643在酸胁迫中的转录组学研究分析,发现 Slr0643在酸胁迫中起着重要的作用,并且可能是通过 Slr0643/Sll0857/SigH调控机制进行调控[18],这个结果为我们进一步探索Slr0643在混养胁迫中的具体调控机制提供了思路。
3 结论
本文采用集胞藻PCC6803野生型藻株和Slr0643敲除突变体(Δslr0643)藻株,通过生理实验和基于气相色谱-质谱联用(GC-MS)技术的植物代谢组学分析,对Slr0643蛋白调控集胞藻PCC6803葡萄糖混养适应的机制进行研究。生理结果发现虽然Δslr0643藻株在自养条件下与野生型无明显差异,但在2.5 mM葡萄糖混养条件下,野生型藻株的生长速率较光自养条件明显加快,而Δslr0643藻株的生长速率较光自养条件显著下降,在添加葡萄糖其混养培养 4 d后的OD730值仅为野生型藻株的 47.25%,且其利用葡萄糖的速率也始终低于野生型藻株。在对培养液中24 h葡萄糖的消耗实验中,Δslr0643藻株在24 h内消耗葡萄糖的速率始终慢于野生型,野生型培养液中的葡萄糖在22 h时已全部消耗完毕,而Δslr0643藻株在24 h时培养液中仍然剩余0.18 mM葡萄糖。通过代谢组学分别对野生型和Δslr0643藻株在不同培养时间下的显著差异代谢物进行鉴定,发现它们的显著差异代谢物各有11种,均主要分属于糖类、有机酸类、氨基酸类及脂类,其中有9种相同,但其表达量的变化却截然不同,由此可看出slr0643基因的敲除影响了这些物质的正常代谢。进一步对各个时间点下Δslr0643突变体相对于野生型的差异代谢物进行筛选鉴定,并将这些显著差异代谢物的代谢通路进行富集分析,发现差异物质主要富集在三羧酸循环,丙酮酸代谢,丁酸甲酯代谢,谷氨酸代谢,缬氨酸、亮氨酸和异亮氨酸生物合成,淀粉和蔗糖代谢,烟酰胺代谢,磷酸肌醇代谢这8个代谢途径,提示Slr0643主要是通过调控8个代谢通路来使细胞适应葡萄糖的混养。本研究揭示了Slr0643在葡萄糖利用中的重要作用,为进一步阐述Slr0643在集胞藻中的调控方式及蓝藻对葡萄糖的利用机制奠定了基础。

