红阳猕猴桃酵素发酵工艺优化及其体外抗氧化活性
陈林,苏珊,吴应梅,徐凤莲,程扬清
(重庆三峡学院生物与食品工程学院,重庆市渝东北特色生物资源开发利用工程技术研究中心,重庆 404000)
猕猴桃(Actinidia chinensisPlanch.)原产于中国,既是一种观赏性和食用性兼具的特殊经济作物,也是药食同源水果[1]。猕猴桃含有丰富的糖分和碳水化合物,维生素C含量高(161.3 mg/g),并且含有钾、磷、钙、镁等微量元素[2]。相关研究认为摄入一定量猕猴桃能促进消化、增强免疫力和提高代谢[3,4]。猕猴桃在中国主要有中华猕猴桃和美味猕猴桃两种系列,其中红阳、Hort16A、金艳、软枣是中华猕猴桃系列的优质品种[5-7]。红阳猕猴桃又称红心猕猴桃、红心奇异果,是由中国四川自然资源研究所对野生猕猴桃单株选育而成的一种稀有优良品种。目前红阳猕猴桃品种仅四川、重庆、贵州、陕西及浙江部分地区种植。与绿肉猕猴桃相比,红阳猕猴桃果肉香气浓郁、口感香甜,其后代具有稳定的遗传特征,抗逆性强、果实大、耐贮藏性好[8]。
发酵是一个复杂的过程,微生物将植物中的糖分转化为乙醇、二氧化碳和其他副产物并发挥了积极作用[9]。发酵不仅能够提高食品的风味和延长货架期,而且能提高生物功能性,如促进新陈代谢、调节酸碱平衡、调节肠胃功能、提高免疫力和营养成分利用率等[10,11]。发酵一方面通过增加植物性食品中酚类化合物和黄酮类化合物含量来提高其抗氧化活性[12],另一方面发酵导致植物细胞壁被破坏,释放抗氧化物质[13,14]。目前关于猕猴桃发酵相关研究主要集中在纯猕猴桃汁或猕猴桃酒[15,16],对于猕猴桃果渣发酵工艺及抗氧化活性和感官分析研究较少。植物性发酵食品在国际市场有广泛的发展空间,相应的产品也逐渐商业化[17],随着发酵产品的快速发展,发酵产品逐步从饲料扩展到化妆品、药品和食品等行业[18]。重庆万州地理条件及气候环境适合红阳猕猴桃生长,本地种植面积和产量处于逐年增长趋势。由于猕猴桃鲜果保质期限短且不耐储藏,本地需要提高猕猴桃深加工产品开发以期提升猕猴桃经济价值和品牌效应。虽然已有不少关于猕猴桃发酵工艺研究报道,但是不同猕猴桃品种和地域对于发酵有很大影响,且双正交方法深入探索红阳猕猴桃全果发酵优化工艺尚未有系统报道。因此本研究以新鲜红阳猕猴桃为原料,以酵母和乳酸菌为复合发酵菌种制备猕猴桃酵素。试验通过双正交方法对其发酵工艺参数进行优化,并在最优发酵工艺条件下研究酵素产品抗氧化能力和感官评价,目的获得具有高品质的红阳猕猴酵素产品并推动当地特色农产品深加工产品开发。
1 材料与方法
1.1 材料与仪器
红阳猕猴桃采自重庆市万州区走马镇,经重庆市渝东北特色生物资源开发利用工程技术研究中心鉴定为红阳猕猴桃。鲜果自采摘后1 h内被运送到实验室,常温冷却2 h后气调贮藏(3%~5% O2+3%~4% CO2)。酵母(Saccharomyces cerevisiae),法国 Sofralab the Oenological公司;果胶酶,南宁庞博生物工程有限公司;纤维素酶,宁夏和氏璧生物技术公司;乳酸菌(Lactobacillusbulgaricus&Streptococcus thermophilus),北京川秀技术公司;食品级柠檬酸,河南万邦实业有限公司;去离子水,东莞市仟净环保设备有限公司;DPPH、ABTS等购自北京Solarbio科技公司;K3[Fe(CN)6],氨基水杨酸,无水乙醇等试剂(分析纯)购自重庆川东化工集团有限公司。
LRH-300生化培养箱,上海百典仪器设备有限公司;A5176024立式自动压力蒸汽灭菌器,致微厦门有限公司;FA2004电子天平,上海精平科学仪器有限公司;SP-756紫外可见光分光光度计,上海雅程仪器设备有限公司;PAL-BX手持糖度仪,日本Atago公司;PH-100A笔试酸度计,邦西仪器科技(上海)有限公司。
1.2 实验方法
参考相关文献[19,20]设计单因素试验,确定酵母、乳酸菌、果胶酶和纤维素酶水平范围并进行第一次正交试验,在其基础上根据相关文献[21,22]设计初始糖添加量、发酵温度、时间和料液比单因素试验,接着进行第二次正交试验。根据两次正交试验结果确定红阳猕猴桃酵素发酵工艺优化条件。
1.2.1 酵母添加量
猕猴桃清洗干净后晾干,连皮混合打碎后分成 5份,每份75 g。猕猴桃果泥分别放入5个灭菌的250 mL碘量瓶中后每瓶加入85 mL蒸馏水。接着每组分别加入0.5%、1.0%、1.5%、2.0%和2.5%的酵母。然后每组加入1.5%乳酸菌,0.5%果胶酶和1.0%纤维素酶。所有样品在 36 ℃发酵 21 d,按照“1.2.11”“1.2.12”和“1.2.13”方法测定和计算(综合指标:羟基自由基清除率50%+感官评价50%),每组实验重复3次。
1.2.2 乳酸菌添加量
样品按照 1.2.1处理后,每组分别加入 0.5%、1.0%、1.5%、2.0%和 2.5%的乳酸菌。然后每组加入1.5%酵母,0.5%果胶酶和 1.0%纤维素酶。所有样品在36 ℃发酵21 d,按照“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.3 果胶酶添加量
样品按照 1.2.1处理后,每组分别加入 0.3%、0.4%、0.5%、0.6%和 0.7%的果胶酶。然后每组加入1.5%酵母,1.5%乳酸菌和 1.0%纤维素酶。所有样品在36 ℃发酵21 d,按照“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.4 纤维素酶添加量
样品按照 1.2.1处理后,每组分别加入 0.3%、0.5%、1.0%、1.5%和 2.0%的纤维素酶。然后每组加入1.5%酵母,1.5%乳酸菌和0.5%果胶酶。所有样品在36 ℃发酵21 d,按照“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.5 初始糖添加量
猕猴桃清洗干净后晾干,连皮混合打碎后分成 5份,每份75 g。猕猴桃果泥分别放入5个灭菌的250 mL碘量瓶中每组加入 2.0%酵母,2.0%乳酸菌、0.5%果胶酶、2.0%纤维素酶后,每瓶加入150 g蒸馏水。分别按照10%、15%、20%、25%、30%浓度添加蔗糖,所有样品 36 ℃发酵 21 d,按照“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.6 发酵温度
猕猴桃按照1.2.5处理后,调节初始20%糖度。接着分别在0、12、24、36、48 ℃下进行21 d发酵,按照“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.7 发酵时间
猕猴桃按照1.2.5处理后,调节初始20%糖度。接着分别在 36 ℃下发酵 7、14、21、28、35 d,“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.8 料液比
猕猴桃洗净、晾干、打碎后,分别称取45、60、75、90、105 g按照1.2.5处理后,调节初始20%糖度,分别按照料液比1:4.5、1:3.1、1:2.3、1:1.7、1:1.3 g/mL添加蒸馏水。接着 36 ℃下进行 21d发酵,“1.2.11”“1.2.12”和“1.2.13”方法测定和计算,每组实验重复3次。
1.2.9 发酵菌种和酶添加量正交试验
采用L9(34)正交试验[23],在单因素试验基础上,以羟基自由基清除率(50%)和感官评价(50%)为综合指标,确定最佳发酵菌种和酶添加量(表1)。
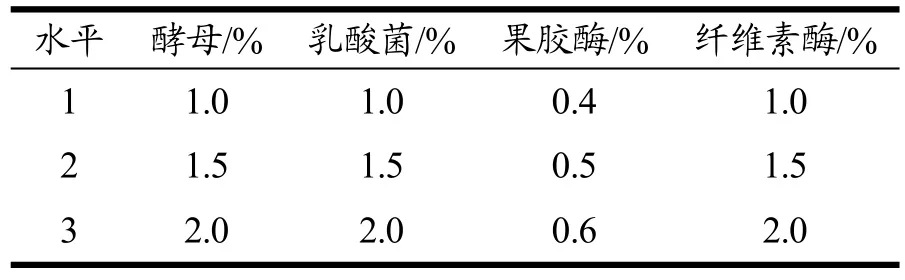
表1 酵母、乳酸菌、果胶酶和纤维素酶添加量因素水平表L9(34)Table 1 Factors and levels of L9 (34) orthogonal test of the addition of yeast, Lactobacillus, pectinase and cellulase
1.2.10 发酵条件正交试验
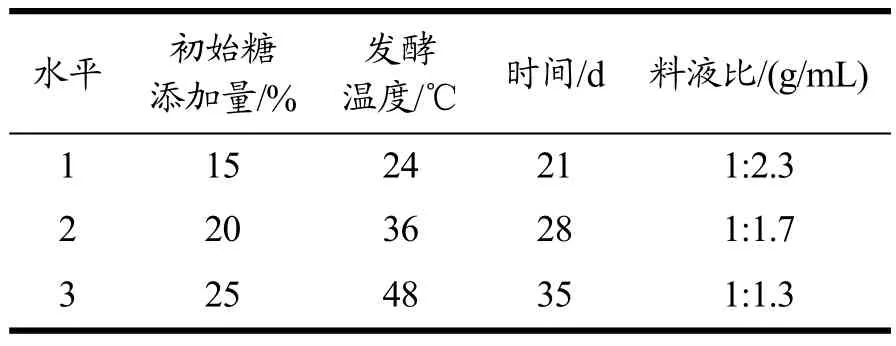
表2 初始糖添加量、发酵温度、时间和料液比的因素水平表L9(34)Table 2 Factors and levels of L9 (34) orthogonal test of initial sugar addition, fermentation temperature, time and solid-liquid ratio

表3 猕猴桃酵素液感官评定标准Table 3 Criteria of sensory evaluation of fermented kiwifruit jiaosu
采用L9 (34)正交试验,在单因素试验基础上,以羟基自由基清除率(50%)和感官评价(50%)为综合指标,确定最佳发酵工艺条件(表2)。
1.2.11 猕猴桃酵素感官评价方法
猕猴桃发酵后通过120目纱网过滤后获得猕猴桃酵素液并于4 ℃保存,用于感官评价[21]。感官评定由20名(男女各半)经过专业培训的成员组成,对猕猴桃发酵液色泽、形态、香气、口感进行评分(表3)。
1.2.12 猕猴桃酵素提取方法
称取30 g猕猴桃酵素,用甲醇-水(80:20,V/V)稀释,接着在20 ℃,150 r/min摇匀过夜。最后样品在4 ℃条件下,3000 r/min离心20 min,吸取上清液,获得猕猴桃酵素(后称提取液)用于抗氧化分析,选取0.1 mg/mL Vc溶液做阳性对照。
1.2.13 羟基自由基清除率测定
羟基自由基测定按照修改过的水杨酸测定方法[24,25]。取1 mL提取液与1 mL 9 mmol/L FeSO4和1 mL 8.8 mmol/L H2O2均匀混合,放置10 min后加入1 mL 9 mmol/L水杨酸溶液,于37 ℃赋予30 min,测510 nm吸光度(A1)。方法同前,用蒸馏水替代 1 mL 8.8 mmol/L H2O2测定溶液吸光度A2。蒸馏水代替提取液,测定吸光度A3。提取液羟基自由基清除率计算方法公式:
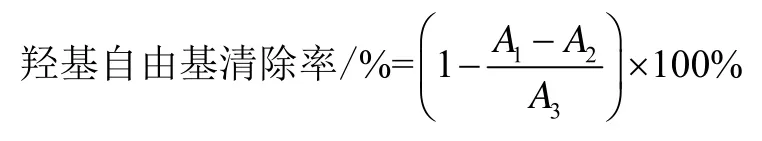
1.2.14 DPPH自由基清除率测定
DPPH自由基清除率测定方法采用Kim方法并稍加修改[14]。准备三支洁净刻度试管编号,1号试管加入1.6 mL去离子水,2号和3号试管均加入0.5 mL提取液和1.1 mL去离子水。接着1号和2号试管分别添加2.1 mL 0.1 mol/L DPPH·乙醇溶液,3号试管用2.1 mL无水乙醇代替。三支试管在室温避光反应60 min后,517 nm处测定吸光度,试管编号对应吸光度。DPPH自由基清除率计算公式如下:
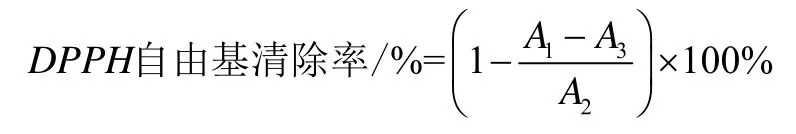
1.2.15 ABTS+·自由基清除率测定
ABTS+·自由基清除率测定方法采用Re方法并稍加修改[22]。首先将5 mL 7.0 mmol/L ABTS溶液与88 μL 2.6 mmol/L K2S2O8混合,避光反应12~16 h制备成ABTS工作液。然后用5 mM磷酸缓冲溶液稀释成在734 nm处吸光度为0.70±0.02。取0.2 mL ABTS+·稀释液与10 μL提取液混合,避光反应6 min,在734 nm处测定吸光度A1,不含样品测定ABTS+·稀释液吸光度A2。ABTS+·自由基清除率公式如下:
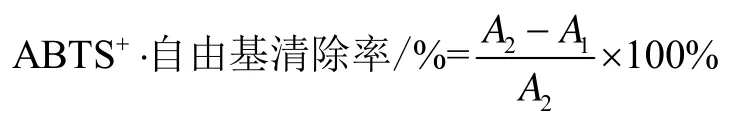
1.2.16 数据分析
数据首先采用Microsoft Excel软件进行统计,方差分析和显著性分析采用SPSS version 16.0统计。每项实验至少进行3次,结果以平均值±标准差表示。
2 结果与讨论
2.1 发酵菌种和酶的添加量单因素试验结果
羟基自由基是最具有活性的自由基,对邻近生物分子具有诱导作用并造成重要损害[26]。感官评价能对发酵产品所表现出的感官元素做出直观评价。因此猕猴桃酵素的综合指标由羟基自由基清除率(50%)和感官评价(50%)两个方面组成。
合适的菌种和酶能够有效促进猕猴桃发酵,张晶等[27]发现复合菌发酵能提高野生猕猴酒风味,增加醇类、酯类化合物。彭宁等[22]在猕猴桃酵素工艺条件研究中发现菌种接种量对猕猴桃发酵质量影响最大,因此本实验首先确定发酵菌种和酶添加量,通过单因素实验酵母、乳酸菌、果胶酶和纤维素酶对猕猴桃综合指标的影响。本实验在添加酿酒酵母同时添加乳酸菌共同发酵,一方面酵母为乳酸菌提高可溶性氮化合物,另一方面乳酸菌为酵母生长提供适宜的酸环境。纤维素酶和果胶酶能提高植物中大分子物质的分解,提高发酵效率。已有研究证实猕猴桃的膳食纤维,尤其是非淀粉多糖几乎全部来自植物细胞壁。同样,果胶广泛存在于水果细胞壁,分子量大且不容易水影响发酵效率。通过果胶酶和纤维素酶处理的猕猴桃比非酶处理一方面提高大分子物质释放和分解,另一方面能促进发酵微生物生长活力。图1反映了酵母、乳酸菌、果胶酶和纤维素酶不同添加量对提取液综合指标的影响。发酵初期,随着菌种和酶添加增加,综合指标均出现上升趋势,当酵母添加量为1.5%,乳酸菌添加量1.5%,果胶酶添加量0.5%和纤维素酶添加量1.5%时,综合指标达到最高。
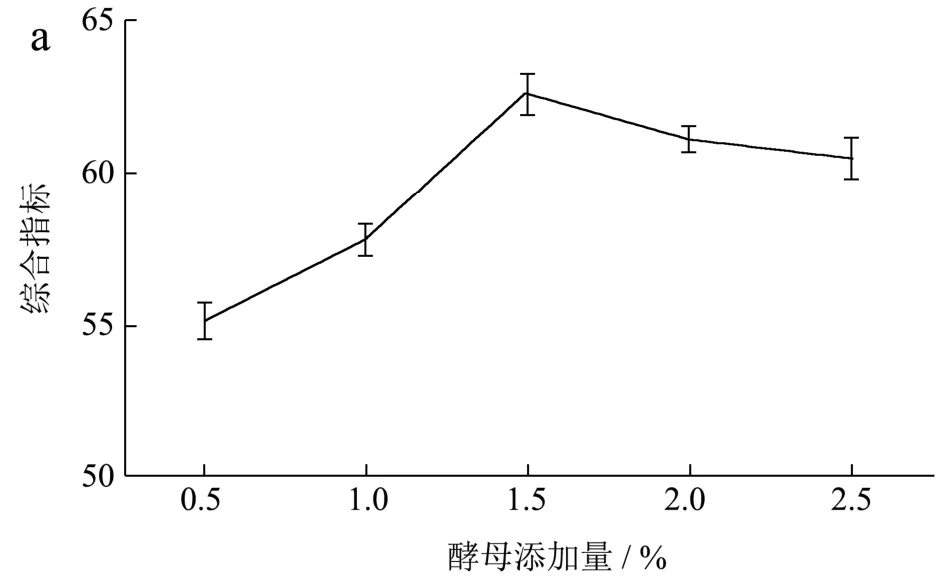
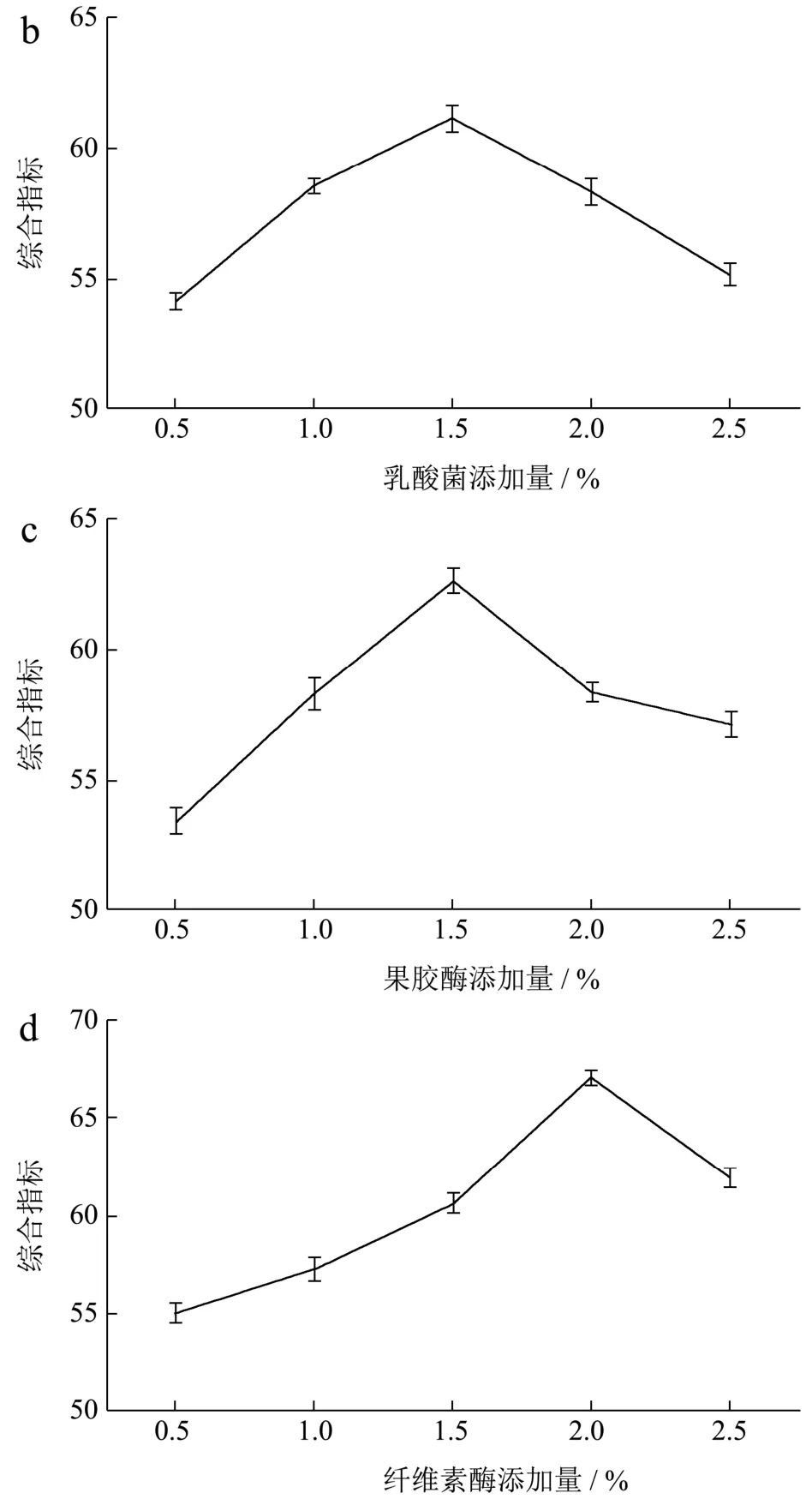
图1 不同发酵菌种和酶添加量下对发酵提取液综合指标的影响Fig.1 Effect of different fermentation strains and enzyme additions on the aggregative indicator of fermented
2.2 发酵条件单因素试验结果
初始糖添加量为猕猴桃发酵提供必要的碳源,从图2a看到,随着初始糖添加量的增加,评价指标逐渐升高,当初始糖度添加量超过20%,菌种生长活性受到限制,综合指标开始下降。同样,在发酵环境中,适宜的温度能促进微生物生长以及各种酶类酶解活性,有效的释放和合成活性物质,如黄酮、多酚等。从图2b看到,发酵温度超过36 ℃,酶活性和微生物生长受到影响。发酵时间是觉得发酵物质量的重要因素,从图2c看到猕猴桃发酵液综合指标随着发酵时间的变化关系,发酵第28 d指标最高,因此发酵时间选择范围为 21~35 d。料液比是影响发酵的关键因素之一,料液比过低抗氧化活性弱,反之发酵成本增高。从图2d看到,料液比达到1:1.7发酵液综合指标达到最高。
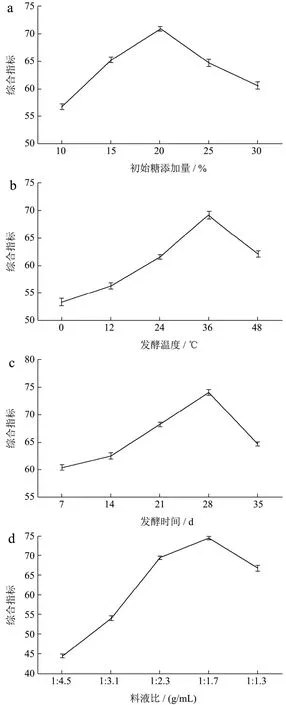
图2 不同发酵条件下发酵提取液的综合指标Fig.2 Effect of different fermentation condition on the aggregative indicator of fermented
2.3 发酵菌种和酶添加量正交试验结果
根据酵母、乳酸菌、果胶酶和纤维素酶添加量因素水平表L9(34)(表1),以综合指标为评价标准,进行发酵菌种和酶添加量进行正交试验并对结果进行方方差分析,确定最佳添加量(表4、5)。由表4可知,影响羟基自由基清除率的因素,从主到次为酵母>乳酸菌>果胶酶>纤维素酶;感官方面影响因素为酵母>果胶酶>纤维素酶>乳酸菌。分别以极值最小的因素为误差项进行方差分析(表5),影响羟基自由基清除率因素,酵母与乳酸菌添加量有显著影响;影响感官评价因素,酵母有显著影响。对于综合指标,影响因素为酵母>乳酸菌>纤维素酶>果胶酶,以极值最小果胶酶为误差项,酵母和乳酸菌有显著影响,故确定优化添加量为:酵母、乳酸菌和纤维素酶各2.0%,果胶酶0.5%。
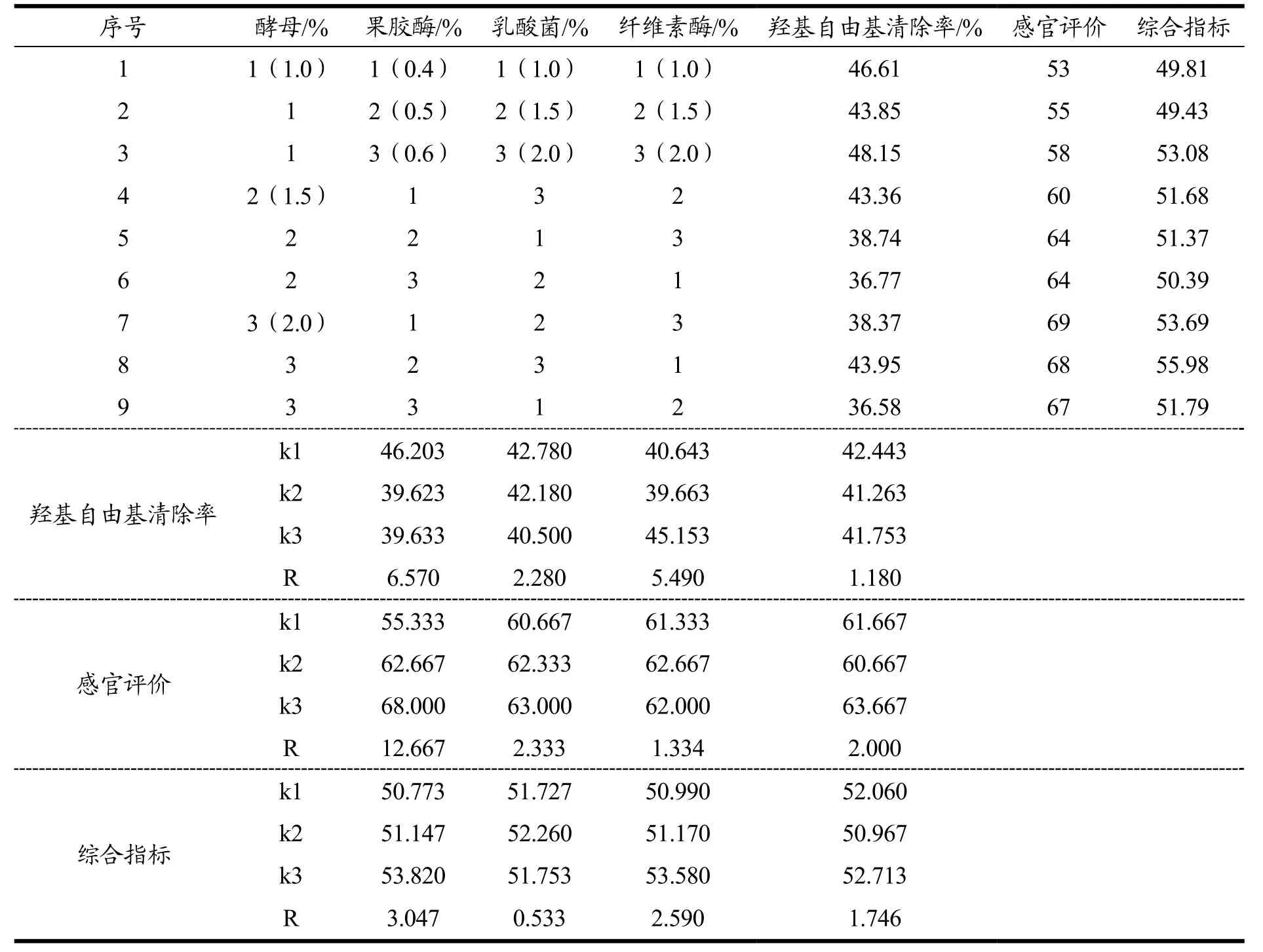
表4 猕猴桃酵素发酵菌种和酶添加量正交试验结果Table 4 Results of L9 (34) orthogonal test of addition of strains and enzyme of fermented kiwi fruit
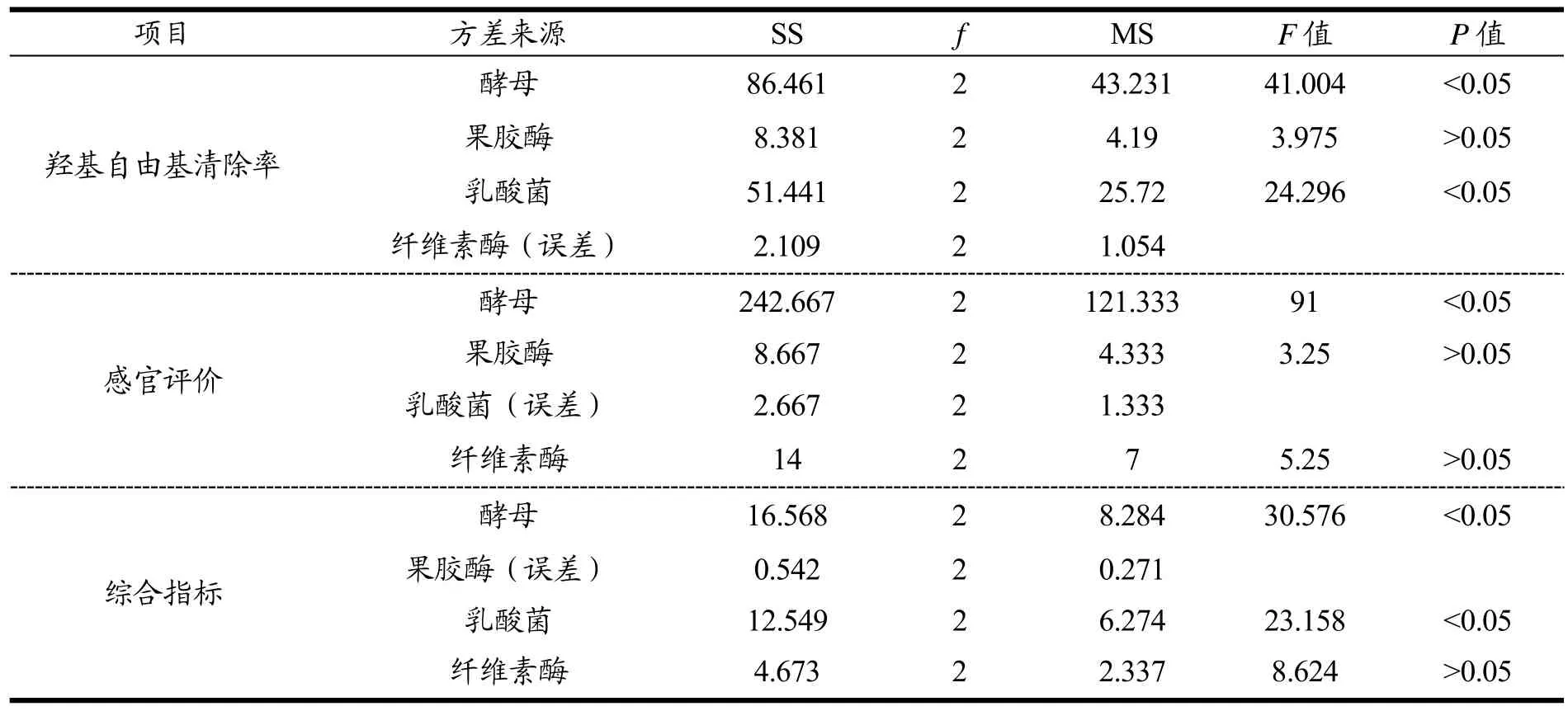
表5 猕猴桃酵素发酵菌种和酶添加量正交试验结果方差分析Table 5 Variance analysis and parameter estimation of addition of strains and enzyme of fermented kiwi fruit
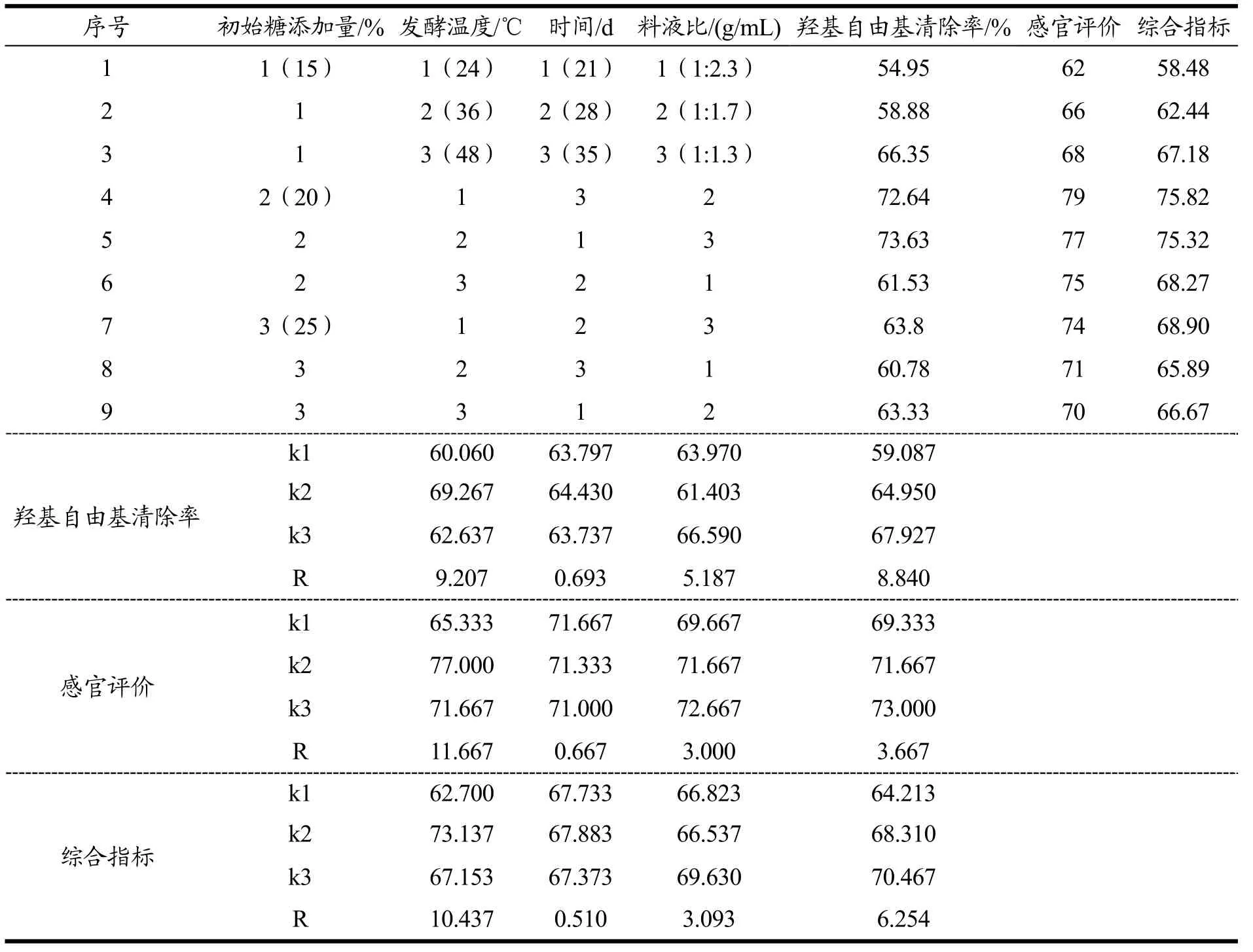
表6 猕猴桃酵素发酵条件正交试验结果Table 6 Results of L9 (34) orthogonal test of fermentation condition of fermented kiwi fruit

表7 猕猴桃酵素发酵条件正交试验结果方差分析Table 7 Variance analysis and parameter estimation of fermentation condition of fermented kiwi fruit
2.4 发酵条件正交试验结果
在菌种和酶添加量实验结果基础上,根据发酵条件单因素试验结果,选取猕猴桃酵素对羟基自由基清除率影响各因素进行正交试验(表2),并对结果进行方差分析,确定最佳发酵条件(表6、7)。由表6可知,影响羟基自由基清除率的因素和感官方面影响因素,从主到次为初始糖度>料液比>发酵时间>发酵温度。分别以极值最小的因素为误差项进行方差分析(表7),影响羟基自由基清除率因素和影响感官评价因素,初始糖添加量、发酵时间和料液比均有显著影响。对于综合指标,影响因素和显著影响结果与各指标一致,即初始糖度>料液比>发酵时间>发酵温度,故确定优化发酵条件为 20%初始糖添加量,料液比为 1:1.3,36 ℃发酵35 d。
2.5 最优发酵工艺验证试验
按照双正交试验结果最佳发酵条件和工艺进行 3次验证实验结果表明(表8),优化后猕猴桃酵素的羟基自由基清除率、感官评价以及综合指标分别为94.33%、76.33和85.33,实验结果均高于正交实验测得的结果,表明正交实验获得的红阳猕猴桃酵素在羟基自由基清除率和感官评价方面均得到优化。
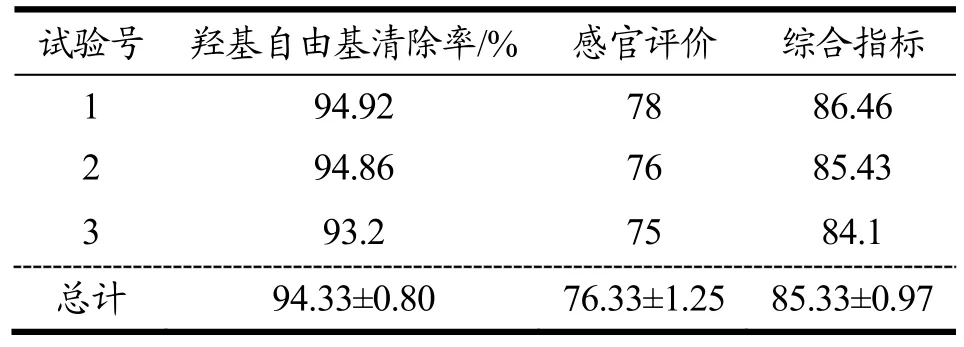
表8 猕猴桃发酵工艺验证试验结果Table 8 Verification test results of fermented Hongyang kiwifruit
2.6 猕猴桃酵素抗氧化效果比较
根据最佳发酵工艺制备猕猴桃发酵工艺优化组,以未添加酵母、乳酸菌、果胶酶和纤维素酶的猕猴桃为对照组。两组猕猴桃均在20%初始糖添加量和料液1:1.3情况下发酵,且工艺优化组发酵温度为36 ℃,对照组为室温发酵。发酵35 d后考察两组羟基自由基清除率、DPPH·和ABTS·+清除自由基情况。
由于猕猴桃皮渣和籽中含有大量色素、多酚及单宁等物质,对于发酵果汁或酒类的感官有影响,因此关于猕猴桃发酵研究大多围绕猕猴桃汁液,全果发酵工艺相对较少。近年来水果皮渣发酵相关研究逐渐成为热点,其原因为带皮发酵可以提高乙酸、总黄酮、总酚等功效成分含量并且赋予发酵物饱满丰富的香味特征[28]。另外,有研究发现尽管带渣发酵中总花色苷含量低于清汁发酵,但带渣发酵能促进皮渣中黄酮等物质溶出,显著提高发酵产品总酚含量和抗氧化活性[29]。从图3看到,经过优化后的猕猴桃酵素羟基自由基清除率、DPPH·和ABTS+·清除率均增强。与对照组相比,优化发酵后羟基自由基清除率、DPPH·和ABTS·+自由基清除率分别增加了 8.69%、11.89%和36.57%,说明酵母、乳酸菌、果胶酶和纤维素酶能够有效的提高猕猴桃发酵效率和活力,且全果发酵能够提高发酵物多酚及单宁含量进而增强抗氧化活性[30]。另外适宜的发酵温度对猕猴桃酵素抗氧化效果起到积极作用。
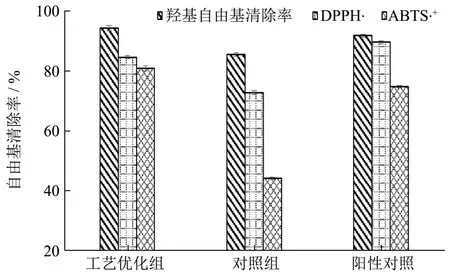
图3 经过工艺优化的猕猴桃酵素抗氧化效果比较Table 3 Comparison of antioxidant effects of fermentation of Kiwifruit after technological optimization
3 结论
3.1 本试验以羟基自由基清除率(50%)和感官评价(50%)为综合指标,采用双正交实验方法进行猕猴桃发酵工艺优化。本实验首先确定发酵菌种和酶添加量,通过单因素实验酵母、乳酸菌、果胶酶和纤维素酶对猕猴桃综合指标的影响。在此基础上进行正交实验,实验结果表明酵母和乳酸菌为最主要因素,且具有显著性。发酵菌种和酶添加量分别为:2%酵母,2%乳酸菌,0.5%果胶酶和 2%纤维素酶。然后在进一步考察发酵最佳条件,通过单因素实验分析初始糖添加量、发酵温度、发酵时间和料液比对猕猴桃综合指标的影响。正交实验结果表明初始糖添加量、发酵时间和料液比为主要因素,且达到显著程度。最佳发酵工艺为20%初始糖添加量,料液比1:1.3(g/mL),36 ℃发酵35 d。优化后猕猴桃酵素的羟基自由基清除率、感官评价以及综合指标分别为94.33%、76.33和85.33,实验结果均高于正交实验测得的结果。优化发酵后测得红阳猕猴桃酵素抗氧化活性发现,羟基自由基清除率、DPPH·和 ABTS+·清除率分别增加了 8.69%、11.89%和36.57%,优于自然发酵猕猴桃。
3.2 本试验以猕猴桃全果进行发酵,通过微生物代谢获得具有营养价值和保健功能的猕猴桃酵素产品,可以进一步提升猕猴桃开发利用价值,对重庆特色水果精深加工和当地猕猴桃产业经济效益具有重要意义。另外,红阳猕猴桃发酵过程中各阶段不同成分和活性变化还需要进一步研究和分析。

