pH和缓冲体系对植物多酚抑制脂氧合酶活性的影响
叶凤凌 贾利蓉 何 强 董 怡
(四川大学轻工科学与工程学院,四川 成都 610065)
脂氧合酶(Lipoxygenase,EC1.13.11.12,LOX)是一种氧化还原酶,可专门催化具有顺,顺-1,4戊二烯结构的多不饱和脂肪酸发生分子内加氧产生脂肪酸氢过氧化物[1],例如,植物源的LOX底物主要是植物油脂中广泛存在的亚油酸和亚麻酸[2-3]。LOX对油脂的劣变具有一定促进作用,可导致油脂和含油食品在贮藏和加工过程中氧化酸败,降低产品营养和食用特性[4-5]。抑制脂氧合酶活性是延长油脂货架期,维持油脂营养价值的重要途径之一。已有研究证明,植物中提取得到的多酚类物质可通过螯合或还原LOX活性部位的亚铁离子,或与脂质自由基发生反应从而中断脂质氧化链式反应[3],达到良好的油脂氧化抑制作用[6-8]。
LOX酶活的常见测定方法有分光光度法、氧电极法、量压法、同位素标记法、显色法、染色法等,其中分光光度法最简便、快速,能做到连续且精准的测定[9]。分光光度法通过测定LOX催化底物反应生成具有共轭二烯结构的氢过氧化合物的吸光度值(A234),计算共轭二烯生成量,推算出酶活大小[1]。该法已被广泛用于作物中LOX酶活性的检测[10-11],且已有较多研究利用该法检测从茶叶[12]、虎杖根[8]、蓝莓叶[6]等植物中提取的多酚类物质对LOX酶活的抑制作用。
植物多酚常具有邻苯三酚或邻苯二酚结构,其酚羟基具有供氢能力和供电子能力[13],使得多酚具有较强的抗氧化性以及清除自由基的能力[14]。常见的植物多酚如槲皮素[15-16](quercetin,QCT)、没食子酸[17-18](gallic acid,GA)、儿茶素[19](catechins,C)和3,4-二羟基苯乙酸[20](3,4-dihydroxyphenylacetic acid,DOPAC)等均具有抗氧化、抗衰老、抗病毒、抗肿瘤等多种活性[21-22]。但多酚所在缓冲体系的溶剂及pH可影响多酚的活性[23]。多酚在酸性环境中较为稳定而在碱性环境不稳定,且碱性越强稳定性越差[24]。多酚在碱性条件下易脱下邻位酚羟基上的H离子(酸碱中和反应)发生自氧化反应生成半醌和醌类物质,从而影响其活性[25]。多酚自氧化反应的中间产物在320 nm左右有特征吸收峰,随着反应程度加剧或反应时间延长,中间产物被氧化转变为终产物,终产物在440 nm左右出现特征吸收峰[26-27]。在已有的利用紫外分光光度法检测多酚对LOX酶活抑制作用的研究中[6,12],检测时所选取的缓冲体系多为硼酸盐体系,所选取的pH一般以LOX的最适pH为准,对该缓冲盐体系及pH条件是否对多酚活性造成影响未有深入探讨。
为优化紫外分光光度法检测多酚抑制LOX酶活方法中的反应体系,试验拟研究不同缓冲体系和pH对LOX酶活力的影响,并选用QCT、GA、C、DOPAC 4种常见多酚,研究在不同缓冲体系和pH条件下4种多酚的自氧化情况,旨在为缓冲体系和pH对多酚自氧化及多酚对LOX酶抑制机理的研究提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
硼酸、十水合四硼酸钠(硼砂)、二甲基亚砜(DMSO):分析纯,成都金山化学试剂有限公司;
磷酸氢二钠、磷酸二氢钠、氢氧化钠:分析纯,成都科龙化工试剂厂;
吐温20、Tris:分析纯,德国BioFroxx公司;
盐酸:分析纯,成都市科隆化学品有限公司;
亚油酸、槲皮素(QCT)、没食子酸(GA)、儿茶素(C)、3,4-二羟基苯乙酸(DOPAC):分析纯,上海源叶生物公司;
脂氧合酶(LOX):活性5万U/mg,上海源叶生物科技有限公司。
1.1.2 主要仪器设备
多功能微孔板检测仪:Synergy H1型,美国BioTek公司;
电子天平:SQP型,奥多利斯科学仪器有限公司;
超声波清洗器:KQ5200D型,东莞科乔超声设备有限公司;
雷磁台式pH计:PHS-3E型,仪电科学仪器股份有限公司。
1.2 方法
1.2.1 试剂的配制
(1) 缓冲液:用0.05 mol/L Na2B4O7溶液和0.2 mol/L H3BO4溶液混合调配得到pH分别为9.0,8.5,8.0,7.5,7.0的0.2 mol/L硼酸盐缓冲液。用0.2 mol/L NaH2PO4溶液和0.2 mol/L Na2HPO4溶液混合调配得到pH分别为8.0,7.5,7.0,6.5,6.0的0.2 mol/L磷酸盐缓冲液。向50 mL 0.4 mol/L Tris溶液中滴加浓盐酸溶液调节至所需pH后用蒸馏水定容至100 mL,得到pH分别为9.0,8.5,8.0,7.5,7.0的0.2 mol/L Tris-HCl 缓冲液。
(2) 多酚溶液:用DMSO溶解多酚,分别配制成0.05,0.10,0.25,0.50,1.00,10.00 mmol/L的QCT溶液、GA溶液、C溶液、DOPAC溶液。
(3) LOX酶液:将100 mg脂氧合酶溶于pH 9.0的0.2 mol/L硼酸盐缓冲液中,制得酶活约为2 500 U/mL的酶液。
(4) 底物溶液:参照吴桂玲等[6]的方法并略作修改。将0.125 mL Tween 20与5 mL pH 9.0的0.2 mol/L硼酸盐缓冲液混合,边摇边加入0.135 mL亚油酸,混匀后边摇边加入1 mol/L NaOH溶液直至澄清,调节混合液pH至7.5,用pH 7.5的0.2 mol/L硼酸盐缓冲液定容至500 mL。
1.2.2 pH、缓冲体系和多酚浓度对LOX酶活力的影响
参照吴桂玲等[12]的方法并略作修改。缓冲体系对LOX酶活力的影响:在96孔紫外酶标板中加入酶液20 μL、不同pH的缓冲液190 μL,放入酶标仪中在25 ℃下振荡1 min(1 096 次/min,1 mm)后加入底物30 μL;多酚浓度对LOX酶活力的影响:在96孔紫外酶标板中加入酶液20 μL、浓度分别为0.00,0.05,0.10,0.25,0.50,1.00 mmol/L 的多酚溶液5 μL,pH 7.5的硼酸盐缓冲液185 μL,放入酶标仪中在25 ℃下振荡1 min(1 096 次/min,1 mm)后加入底物30 μL。加样完成后立即在25 ℃下振板10 s(1 096 次/min,1 mm),并测量在234 nm处的吸光度,每10 s扫描一次,10 min共扫描60次。以溶剂做空白,进行3次平行试验。制作吸光度随时间变化的曲线,在前5 min内线性较好的区域中以234 nm处的吸光度值每分钟增加0.001个单位定义为一个酶活单位。按式(1)计算酶活力。
(1)
式中:
X——酶活力,U;
A1——线性范围内第1次测得的吸光度;
An——线性范围内第n次测得的吸光度;
n——扫描检测吸光度的次数。
1.2.3 缓冲体系和反应时长对多酚自氧化的影响 参照贾红玉等[27]的方法并略作修改。在25 ℃条件下,于96孔紫外酶标板中添加5 μL多酚溶液与235 μL缓冲液,混合均匀后分别在0,60,120 min扫描280~500 nm处光谱(步长为2 nm),以5 μL的DMSO与235 μL缓冲液混合作为空白对照。
1.2.4 数据处理 所有试验均平行3次,结果以平均值±标准差(SD)表示。采用Origin 8.0软件分析并作图。
2 结果与分析
2.1 缓冲条件对LOX酶活的影响
LOX存在多种同工酶,不同来源的LOX最适pH不同[1, 10]。植物来源的LOX所耐受的pH值一般在3~10,最适pH一般为6.0~9.0[28],同工酶LOX-1的最适pH为9.0。通过测定不同缓冲体系、不同pH条件下LOX活性发现:在硼酸盐缓冲体系中[图1(a)],酶活出现双峰结构(pH=7.5,pH≥9.0),pH为9.0时酶活达38 U,在其他pH条件下酶活则在20~30,中性条件下酶活优于其他两组,与刘国夫等[11]的研究一致;在磷酸盐体系中[图1(b)],酶活随pH值升高而显著上升(P<0.05),而酸性条件下酶活低于10 U;在Tris-HCl缓冲体系中[图1(c)],碱性条件下酶活力均大于40 U,中性条件下酶活显著低于碱性条件(P<0.05)。综上可知,pH和缓冲体系对酶活具有一定影响。
酶的化学本质是蛋白质,结构上同时具有氨基和羧基,环境pH的变化可以使其结构变性而活性降低,导致其对环境pH极为敏感,且不同的离子也会对酶活造成一定影响[29],因此在不同环境条件下LOX酶可显示出不同的酶活力。碱性条件下,试验所用的LOX在Tris-HCl体系中酶活最高;中性条件下,则在硼酸盐体系中酶活最高。
2.2 缓冲条件对多酚自氧化的影响
2.2.1 对QCT自氧化的影响 在硼酸盐缓冲体系中(图2),QCT在中性条件下反应120 min内紫外光谱图没有较大变化,在碱性条件下于320 nm有明显吸收峰。缓冲体系的pH越高、反应时间越长,320 nm处峰越高,而382~400 nm及440~500 nm的峰下降,且382~400 nm 峰出现红移。俞梅兰等[30]研究认为,382~400 nm 及440~500 nm为QCT自身的特征吸收峰,320 nm 处为其自氧化产物的特征吸收峰。因此,在碱性条件下QCT会发生自氧化反应,随着自氧化产物不断积累,320 nm处吸收峰升高;而随反应时间延长,QCT不断消耗导致自身特征吸收峰降低,与Zhou等[31]的研究结果相符。在碱性条件下,QCT的B环上的邻二酚羟基对自氧化反应敏感,可氧化形成具有半醌结构的中间产物,并进一步氧化成终产物槲皮素醌[30]。
QCT在磷酸盐体系中(图3)反应0 min时,在370~385 nm处的峰随着pH降低峰高不变但峰位蓝移。碱性条件下,QCT在326 nm处出峰且碱性越强峰越高,反应一段时间后峰下降,但QCT在pH为8.0的条件下320 nm 的峰明显增长,表示在该条件下出现自氧化产物。因此,pH能显著影响QCT稳定性,进而影响QCT的功能特性。荣家闵等[32]研究发现,pH为5~6时QCT对自由基的清除能力约为60%;随着pH增加,其对自由基的清除能力急剧下降,在pH 9.0时清除率仅为10%。
QCT在中性和碱性Tris-HCl缓冲体系中(图4),反应时间越长,360~410 nm处的峰下降越多;反应60 min相较于反应0 min在320 nm处峰值升高,且随着pH越大而峰值升高越明显;而反应120 min后相较于反应60 min,pH 9.0,8.5的曲线在320 nm的峰有所下降,pH 8.0,7.5的曲线在320 nm的峰上升,并在476 nm处出现新的吸收峰。推测该缓冲体系下320 nm处为QCT自氧化中间产物的特征吸收峰,476 nm处为QCT自氧化终产物的特征吸收峰。因此,QCT在碱性Tris-HCl缓冲体系中可发生自氧化,碱性弱的情况下自氧化中间产物堆积速率大于被消解的速率,表现为QCT自身特征吸收峰下降而中间产物特征吸收峰上升;当碱性越强自氧化反应越快,中间产物浓度大到一定程度之后促进第二步氧化的发生,导致中间产物堆积速率小于被消解的速率,终产物累积同时中间产物含量下降,表现为QCT自身特征吸收峰及中间产物特征吸收峰下降,终产物特征吸收峰上升。

不同pH条件下的字母不同表示差异显著(P<0.05)
综上可知,QCT在碱性条件下发生自氧化,且碱性越强自氧化程度越高。在碱性条件下,QCT在磷酸盐缓冲体系中的稳定性最强,硼酸盐缓冲体系次之,Tris-HCl缓冲体系最差。硼酸盐可能与QCT的B环的酚羟基形成络合物,因此硼酸盐对QCT自氧化具有一定抑制作用[33]。
2.2.2 对GA自氧化的影响 在硼酸盐缓冲体系中(图5),GA反应0 min时各pH条件下紫外吸收曲线相似;反应60 min后,pH 8.0~9.0条件下在340~360 nm出现吸收峰,且pH越高峰越高。在pH 9.0和pH 8.5条件,450 nm处亦有出峰。由此推测,340~360,450 nm处分别为GA自氧化中间产物和终产物的特征吸收峰。在碱性较强的硼酸盐缓冲体系中,在60 min内有GA自氧化终产物积累,且中间产物和终产物的累积随反应时间延长和pH升高而增多。在pH 7.5,7.0条件下,340~360 nm处也出现一个小峰,即在各碱性硼酸盐缓冲体系中反应120 min均发生自氧化。GA结构中3个相邻的芳香族羟基易氧化,GA可以被氧化成醌或羟基相关的衍生物[34]。吴雪钗等[35]研究发现,当pH值为7.0~10.0时,GA在50 ℃以上的条件下3 h内可完全降解,可见GA在碱性和中性条件下不稳定,与试验结论相符。
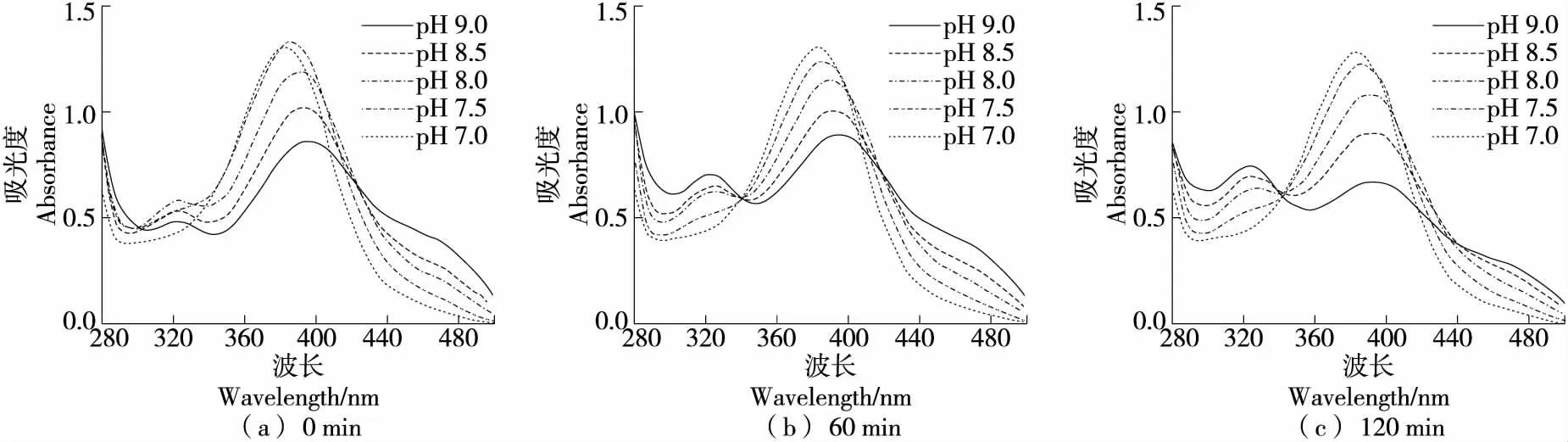
图2 QCT在硼酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱

图3 QCT在磷酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱
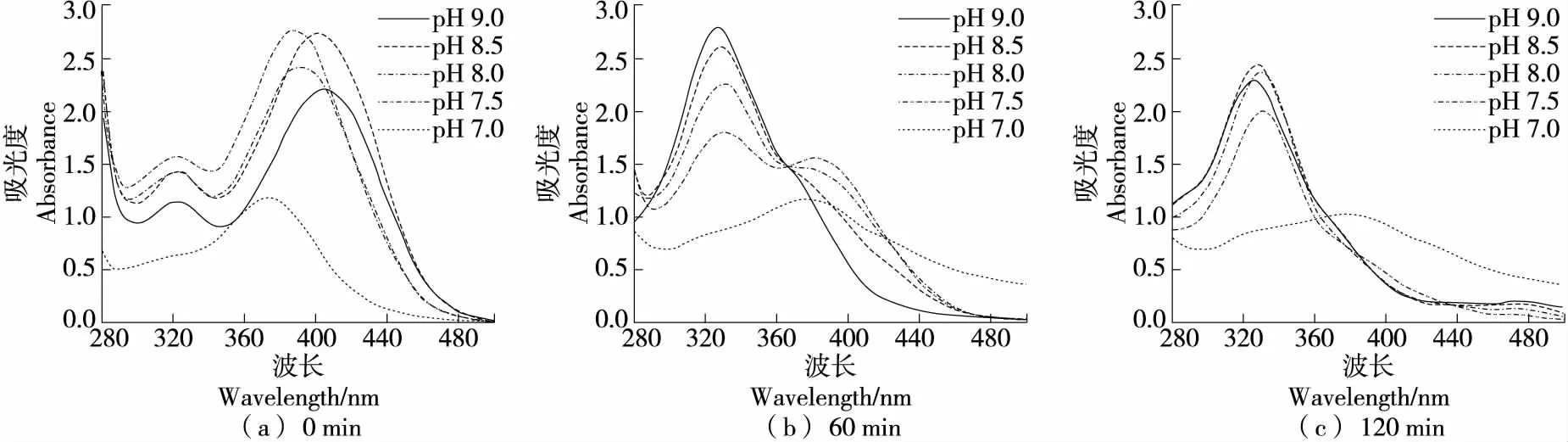
图4 QCT在Tris-HCl缓冲体系中反应不同时间自氧化产物的吸收光谱
在磷酸盐缓冲体系中(图6),GA在碱性条件下反应时间越长,340~360 nm处吸收峰越明显,且在中性条件下反应120 min时也发现吸收峰,而酸性条件下120 min 内该处无吸收峰,说明GA在酸性条件下稳定。碱性条件下反应120 min在446 nm处有明显吸收峰。由此可知,GA在碱性条件下60 min内、中性条件下120 min内,均可发生自氧化并出现自氧化中间产物堆积,而自氧化产生终产物的反应需要较长的时间或需要有较多中间产物累积才能发生。
由图7可知,GA在Tris-HCl缓冲体系中自氧化中间产物特征吸收峰为340 nm,终产物特征吸收峰在446 nm。在碱性条件下,GA反应60 min就已在340,446 nm 处出现吸收峰,且随pH升高、反应时间延长峰值升高。由此可知,GA自氧化反应对反应时间和pH条件敏感,pH越高、反应时间越长产生的中间产物和终产物越多。中性条件下GA在反应60 min内尚未发生自氧化,而反应120 min时已出现自氧化中间产物。
综上可知,GA仅在碱性条件和中性条件(较长反应时间下)发生自氧化反应。在硼酸盐缓冲体系中,60 min仅有轻微自氧化迹象,120 min时才明显出现中间产物,且中性和弱碱性条件下自氧化不明显;在碱性磷酸盐缓冲体系中反应60 min仅产生中间产物;在Tris-HCl缓冲体系中,反应60 min就已出现中间产物和终产物。相比之下,GA在硼酸盐缓冲体系中的稳定性最强,磷酸盐缓冲体系次之,Tris-HCl缓冲体系最差。
2.2.3 对C自氧化的影响 图8显示,除pH 7.0及pH 7.5,C在硼酸盐缓冲体系中反应60 min时在328 nm处产生吸收峰,且峰高随反应时间和pH的增加而增加;反应120 min后,除中性条件外均出现吸收峰且较60 min时有明显升高。反应60 min与120 min均在452 nm处产生非常小的吸收峰但差异不明显。因此,在硼酸盐缓冲体系中,C在碱性条件下容易自氧化产生中间产物,但终产物的生成较为缓慢。

图5 GA在硼酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱
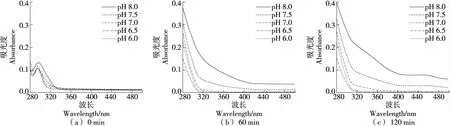
图6 GA在磷酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱
如图9所示,C在碱性磷酸盐缓冲体系中反应60 min 在430 nm处出峰,反应时间越长峰越高,碱性条件下反应60 min和120 min后,在320 nm处吸收峰均不高,说明在碱性磷酸盐缓冲体系中反应60 min后,C已经发生了自氧化,且产生的中间产物被快速反应掉形成了终产物。而在酸性磷酸盐体系中,C未发生自氧化(120 min内)。C在酸性条件下具有较强抗氧化性,在偏碱性或C浓度较高的条件下容易发生自氧化[36],且碱性越强自氧化速率越快[37]。
在Tris-HCl缓冲体系中(图10),C在反应60 min后在320,430 nm处出现吸收峰,说明已经发生自氧化并生成终产物;反应120 min后,在320,430 nm的吸收峰明显增高,说明反应仍在不断进行。C由3个烃环组成,其中B环上的邻二羟基具有强大的氢供应能力,易在碱性条件下释放氢,先反应为半醌自由基中间态然后转变为邻醌结构,C邻醌还能与C发生聚合反应[38]。
综上可知,C在酸性和中性条件下不发生自氧化。在碱性硼酸盐缓冲体系中仅出现中间产物;在磷酸盐缓冲体系中反应120 min出现终产物,中间产物不明显;而在Tris-HCl缓冲体系中反应60 min已有明显自氧化现象。因此,C在硼酸盐和磷酸盐缓冲体系中稳定性优于Tris-HCl体系。

图7 GA在Tris-HCl缓冲体系中反应不同时间自氧化产物的吸收光谱

图8 C在硼酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱

图9 C在磷酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱
2.2.4 对DOPAC自氧化的影响 由图11可知,DOPAC在硼酸盐缓冲体系(pH 7.0~9.0)中具有较强的稳定性,可保持120 min内不发生自氧化。
在磷酸盐缓冲体系中(图12),DOPAC在pH 8.0(60 min)与pH 7.5 (120 min)条件下于345 nm处出现吸收峰,推测此处为自氧化中间产物的特征吸收峰。其中pH 7.5条件下吸收峰非常小,说明该条件下DOPAC发生氧化的程度较小。
DOPAC在Tris-HCl体系(图13)反应60 min时,碱性条件下在346 nm处有吸收峰,且随pH增大峰增高;随着时间的延长,吸收峰持续升高,说明自氧化中间产物持续生成,但均未见自氧化终产物产生。
综上可知,DOPAC在酸性和中性条件下均不发生自氧化,且在硼酸盐缓冲体系中,120 min内碱性条件下也未出现自氧化;在磷酸盐缓冲体系中,在pH 8.0条件下反应60 min已有自氧化迹象,在pH 7.5反应120 min时出现了自氧化中间产物;在Tris-HCl缓冲体系中60 min出现中间产物和终产物,且反应时间越长,两种产物量均增加,说明在该体系中自氧化易发生。因此,DOPAC在硼酸盐缓冲体系中稳定性优于磷酸盐和Tris-HCl体系。

图10 C在Tris-HCl缓冲体系中反应不同时间自氧化产物的吸收光谱
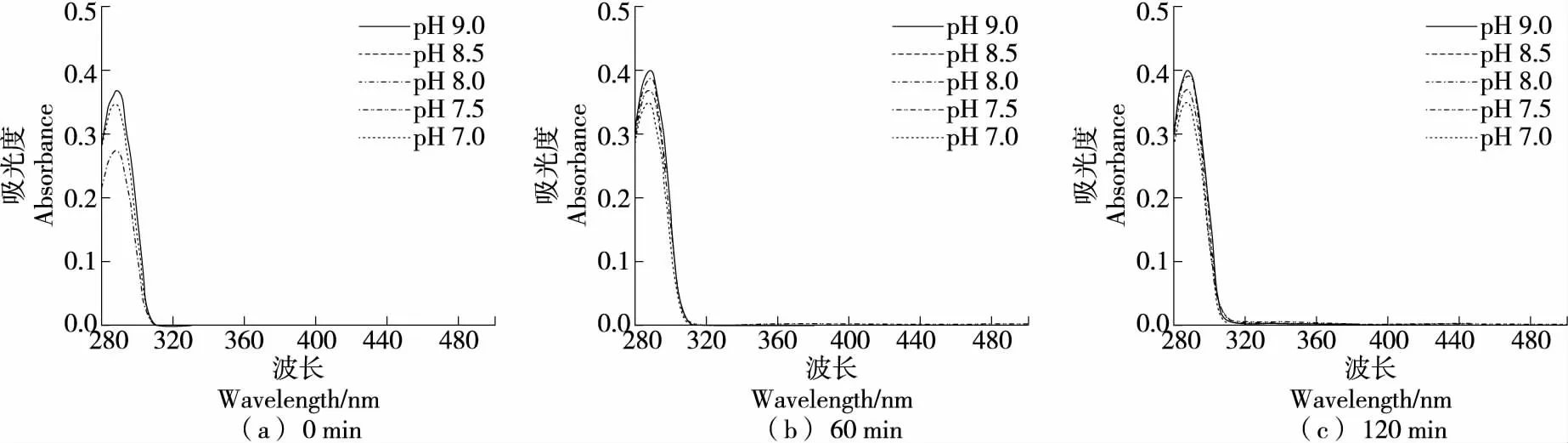
图11 DOPAC在硼酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱

图12 DOPAC在磷酸盐缓冲体系中反应不同时间自氧化产物的吸收光谱
综合以上可知,4种多酚在Tris-HCl缓冲体系中自氧化程度均较其他两种缓冲体系更明显,因此在探究利用紫外分光光度法检测多酚对LOX酶活性的影响试验中,Tris-HCl缓冲体系不适用,而硼酸盐体系稍优于磷酸盐体系。为保证多酚的抗氧化性,应选用弱碱体系、中性或酸性体系,而为保证LOX酶的活性则应选择碱性条件,因此,选取pH 7.5的弱碱体系进行后续研究。
2.3 多酚浓度对LOX酶活的影响
图14显示了不同浓度的4种多酚在pH 7.5的硼酸盐缓冲体系中对LOX酶活性的影响。浓度为0.00~1.00 mmol/L 时,QCT、GA、C的LOX酶活出现先降后增的现象,其中QCT与GA在0.25 mmol/L、C在0.1 mmol/L 时抑制效果最好,且抑制效果为QCT>C>GA。说明多酚在一定浓度范围内对LOX酶活具有抑制作用,与Cao等[39]的研究结果一致。但多酚浓度过高该抑制作用又会减弱,可能是由于多酚在高浓度条件下自氧化速率增加[30]。在0~1 mmol/L范围内DOPAC对LOX酶活性的抑制效果逐步增大,在浓度为1 mmol/L时其酶活抑制效果优于0.10 mmol/L的C,但次于0.10 mmol/L 的QCT。具有邻苯二酚结构的酚类可通过该结构鳌合介导脂质发生过氧化的Cu2+、Fe2+从而发挥抗氧化作用,多酚自身则被氧化成为具有稳定结构的苯醌类产物[40]。Fe2+为LOX的活性中心,被多酚螯合后LOX活性减弱。整体而言,QCT对LOX酶活的抑制效果最强,C次之,再次为GA,DOPAC为最差。

图13 DOPAC在Tris-HCl缓冲体系中反应不同时间自氧化产物的吸收光谱

不同浓度下的字母不同表示差异显著(P<0.05)
3 结论
研究发现,pH和缓冲体系对脂氧合酶活性及4种多酚(槲皮素、没食子酸、儿茶素、3,4-二羟基苯乙酸)自身结构稳定性均有影响。4种多酚在不同缓冲体系的弱碱、中性或酸性条件下自氧化程度小,且pH越小自氧化程度越小,自身结构稳定性越强,能够更好地发挥自身功能特性。综合来看,4种多酚在硼酸盐体系中发生的自氧化程度最小,而Tris-HCl体系中自氧化程度最大。试验选用的脂氧合酶在碱性条件下活性较强,因此检测多酚对脂氧合酶酶活影响时选择弱碱性(pH 7.5)的硼酸盐缓冲体系。因此,在研究多酚对脂氧合酶活性影响的研究中,应对所选用脂氧合酶适用pH范围进行检测,若其最适pH处于酸性范围内则可以选择其最适pH作为缓冲pH条件,无需考虑多酚自氧化特性。
在pH 7.5的硼酸盐缓冲液条件下,利用紫外分光光度法检测多酚浓度对脂氧合酶酶活的影响发现,在一定浓度范围内,多酚浓度越大对脂氧合酶酶活的抑制作用越强,但浓度过高时则可能因多酚自氧化速率加快,导致对脂氧合酶酶活的抑制作用减弱。整体而言,槲皮素对脂氧合酶酶活的抑制效果最强,儿茶素次之,再次为没食子酸,3,4-二羟基苯乙酸为最差。
研究主要对植物多酚的自氧化情况和植物多酚抑制脂氧合酶的效果进行研究探讨,后续研究可以从分子结构和蛋白结构层面对不同结构的多酚对脂氧合酶抑制效果差异的机理原因进行深入研究,也可探究多酚应用于复杂体系(例如植物油、动物肉等)中时对脂氧合酶的抑制效果。

