西格列汀对糖尿病大鼠胰岛β细胞CXCL10及其受体表达的影响
方彦玲 许丽萍 连超炜 张浩


【摘要】 目的:探究西格列汀對糖尿病大鼠胰岛β细胞CXC趋化因子10(chemokine ligand-10,CXCL10)及其受体表达的影响。方法:将90只SD大鼠按照随机数字表法分为干预组30只(高脂高糖饲料喂养+西格列汀灌胃)、模型组30只(高脂高糖饲料喂养+生理盐水灌胃)和空白组30只(普通饲料喂养+生理盐水灌胃)。检测两组大鼠给药前后血糖指标变化,苏木精-伊红(hematoxylin-eosin,HE)染色观察胰岛细胞组织学改变,并比较两组大鼠胰岛β细胞CXCL10及其受体mRNA和蛋白水平。结果:治疗前,干预组及模型组FPG、FINS、HOMAIR均明显高于空白组,ISI均明显低于空白组,差异均有统计学意义(P<0.05);治疗8周后,干预组FPG、FINS、HOMAIR均明显低于模型组,ISI明显高于模型组,差异均有统计学意义(P<0.05)。干预组细胞数少于空白组,但多于模型组,差异均有统计学意义(P<0.05)。干预组CXCL10及CXCL3的mRNA、蛋白表达水平均明显低于模型组,均高于空白组;干预组TLR4的mRNA、蛋白表达水平均显著高于模型组和空白组,差异均有统计学意义(P<0.05)。结论:西格列汀能够明显降低糖尿病大鼠的FPG、FINS水平,并下调糖尿病大鼠胰岛β细胞CXCL10及其受体的表达量。
【关键词】 糖尿病 西格列汀 胰岛β细胞 CXC趋化因子10 CXC趋化因子3
[Abstract] Objective: To investigate the effect of sitagliptin on the expression of CXC chemokine 10 (CXCL10) and its receptor in pancreatic beta cells of diabetic rats. Method: A total of 90 SD rats were divided into 30 intervention group (high-fat high-sugar diet feeding with siglitine gavage), 30 model group (high-fat high-sugar diet feeding with normal saline gavage) and 30 blank group (general feed feeding with normal saline gavage).Hematoxylin-eosin (HE) staining was used to observe the histological changes of islet cells, and the mRNA and protein levels of CXCL10 and its receptor were compared between the two groups. Result: Before treatment, FPG, FINS and HOMAIR in the intervention group and model group were significantly higher than those in the blank group, and ISI were significantly lower than that in the blank group, with statistically significant differences (P<0.05); 8 weeks after treatment, FPG, FINS and HOMAIR in the intervention group were significantly lower than those in the model group, and ISI was significantly higher than that in the model group, with statistically significant differences (P<0.05). The number of cells in the intervention group was less than that in the blank group, but more than that in the model group, the differences were statistically significant (P<0.05). The mRNA, protein expression levels of CXCL10 and CXCL3 in the intervention group were significantly lower than those in the model group, and higher than those in the blank group, and the mRNA, protein expression level of TLR4 in the intervention group were significantly higher than those in the model group and the blank group (P<0.05). Conclusion: Siglitine can significantly reduce the FPG and FINS levels of diabetic rats, and down-regulate the expression of CXCL10 and its receptor in the pancreatic islet of diabetic rats.
[Key words] Diabetes Sitagliptin Islet β cells CXC chemokine ligand-10 CXC chemokine ligand-3
糖尿病是常见的一种代谢疾病,是由环境和遗传因素共同导致的,该病病程长、病情复杂、并发症多[1]。二肽基肽酶4(dipeptidyl peptidase 4 inhibitor,DPP-4)抑制剂是一种新型降糖药,其能够抑制胰岛素降解,增加餐后胰岛素水平[2-3],其中西格列汀是最常用的一种药物。有研究显示,西格列汀通过抑制DPP-4,上调胰高血糖素样肽-1基因表达,增加胰岛细胞增殖分化,进而降低甘油三酯,改善血糖[4]。CXC趋化因子10(chemokine ligand-10,CXCL10)是趋化因子的一个亚族组成部分,其与受体结合,具有趋化炎性反应的作用,与多种疾病发生均相关[5]。文献[6-7]研究显示,CXCL10参与胰岛β细胞凋亡。目前,有关DPP-4抑制剂西格列汀对糖尿病的治疗效果及糖尿病患者血清中CXCL10的表达意义研究较多[8],有关DPP-4抑制剂对胰岛β细胞CXCL10及其受体表达的影响研究较少。本研究旨在探讨DPP-4抑制剂西格列汀对CXCL10及其受体表达的影响。
1 对象与方法
1.1 实验对象 6周龄的无特定病原体(specific pathogen free,SPF)雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠90只,体质量180~220 g,购于XX医学院实验动物中心,在恒温(22±2)℃恒湿(55±15)%无菌屏障中进行饲养,12 h明暗循环,所有的大鼠均在正常饲养条件下分笼饲养,可自由获取食物和水。大鼠经适应性喂养1周,采用随机数字表法分为干预组、模型组和空白组,各30只。本研究经医院伦理委员审核并批准。
1.2 实验试剂 高脂高糖饲料,购自北京博泰宏达生物技术有限公司;普通饲料,购自辽宁长生生物技术股份有限公司;聚合酶链反应(polymerase chain reaction,PCR)分析仪,山东高密彩虹分析仪器有限公司;PCR试剂盒,上海将来实业股份有限公司;磷酸西格列汀片(生产厂家:杭州默沙东制药有限公司,批准文号:国药准字J20140095,规格:50 mg);胰岛素试剂盒,上海科顺生物科技有限公司;血糖仪及配套试纸条,德国罗氏公司。
1.3 建立動物模型 干预组和模型组采用高脂高糖饲料,空白组采用普通饲料,均喂养8周。干预组和模型组给予腹腔注射(0.25%,30 mg/kg)链脲佐菌素(USP级,STZ,生产厂家:Sigma公司,规格:1 g︰5 g),72 h后测尾静脉血糖,血糖>16.7 mmol/L即造模成功。干预组给予西格列汀100 mg/kg治疗,模型组和空白组给予同体积生理盐水,1次/d,灌胃[9],待建模成功后,进行后续实验。
1.4 血糖指标检测 治疗前和治疗8周后,禁食12 h,抽取大鼠尾静脉血3 mL,放置30 min,以3 000 r/min离心15 min,放置至分层,取上清液,置于冰箱(-20 ℃),保存待测。采用血糖分析仪检测空腹血糖(fasting plasma glucose,FPG),采用酶联免疫吸附测定法(enzyme-linked immuno sorbent assay,ELISA)检测空腹胰岛素(fasting serum insulin,FINS),计算胰岛素抵抗指数(homostatic model assessment of insulin resistance,HOMAIR)、胰岛素敏感性指数(insulin sensitivity index,ISI);操作按照试剂盒说明书完成;HOMAIR=FPG×FINS/22.5;ISI=ln[(FPG×FINS)-1]。
1.5 组织病理学苏木精-伊红(hematoxylin-eosin,HE)染色 SD大鼠麻醉成功后,取出胰腺组织,甲醛固定,石蜡包埋,切片,二甲苯脱蜡,乙醇脱水,苏木素染色5 min,冲洗,伊红染色1 min,乙醇脱水,透明,中性树脂封片,用显微镜观察。
1.6 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法检测CXCL10及其受体mRNA水平 总RNA提取和mRNA逆转录为cRNA均按照试剂盒说明书进行。CXCL10 mRNA引物序列:上游:5-CCAAGTGCTGCCGTCATTTTC-3,下游:5-GGCTCGCAGGGATGATTTCAA-3。PCR反应条件:90 ℃ 5 min、80 ℃ 20 s、70 ℃ 30 s,45个循环,70 ℃ 30 s收集信号;解离曲线分析:温度75~90 ℃。由DNA扩增仪计算mRNA表达水平。
1.7 蛋白质印迹法(Western Blot,WB)检测CXCL10及其受体蛋白水平 将胰腺组织裂解,加热,冷却,离心,去除沉淀,分离,进行电泳,温育,洗涤,发光检测,分析CXCL10及其受体蛋白表达水平。
1.8 统计学处理 采用SPSS 25.0软件进行统计学数据处理。符正态分布的计量资料采用(x±s)表示,两组间比较采用t检验,组内比较采用配对t检验,多组间比较采用方差分析,采用Bonferroni法进行组间两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较 干预组,平均体质量(215.00±12.32)g;模型组,平均体质量(213.00±10.68)g;空白组,平均体质量(214.00±11.74)g。三组平均体质量比较,差异无统计学意义(P>0.05),具有可比性。
2.2 三组给药前后大鼠血糖指标比较 治疗前,干预组及模型组FPG、FINS、HOMAIR均明显高于空白组,ISI均明显低于空白组,差异均有统计学意义(P<0.05);治疗8周后,干预组FPG、FINS、HOMAIR均明显低于模型组,ISI均明显高于模型组,差异均有统计学意义(P<0.05)。见表1。
2.3 HE染色光镜下观察胰腺组织 HE染色结果显示,空白组胰腺组织形状规则,分布较均匀,界限清晰,胰岛β细胞形态正常,排列整齐,细胞数目(89.57±8.36)个;模型组胰腺组织形状不规则,分布较散,结构界限模糊,胰岛β细胞胞核皱缩,体积缩小,细胞数目(34.57±20.12)个;干预组胰腺组织形状明显改善,体积有所增加,细胞数量(56.25±19.34)个。见图1。三组细胞数目比较,差异有统计学意义(F=62.144,P<0.05);此外,干预组细胞数少于空白组,但多于模型组,差异均有统计学意义(P<0.05)。
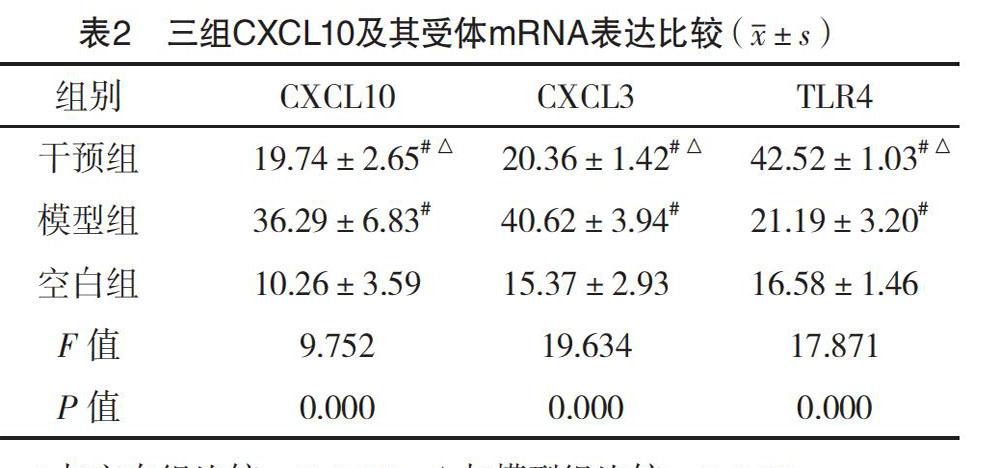
2.4 三组CXCL10及其受体mRNA表达比较 干预组与模型组CXCL10及其受体CXCL3的mRNA表达量均明显高于空白组,差异均有统计学意义(P<0.05);干预TLR4 mRNA表达量均明显高于模型组和空白组,差异均有统计学意义(P<0.05)。见表2。
2.5 三组受体蛋白表达水平比较 CXCL10、CXCL3、TLR4的蛋白表达水平在干预组分别为(1.02±0.16)、(1.06±0.18)、(1.10±0.17),在模型组分别为(2.41±0.25)、(1.97±0.24)、(0.58±0.14),在空白组分别为(0.49±0.08)、(0.65±0.11)、(0.50±0.12)。三组CXCL10、CXCL3、TLR4水平比较差异均有统计学意义(F=8.215、6.376、4.522,P<0.05);干预组CXCL10和CXCL3的蛋白表达水平均显著低于模型组,均高于空白组,TLR4蛋白的表达水平显著高于模型组和空白组,差异均有统计学意义(P<0.05)。见图2。
3 讨论
糖尿病临床表现主要为多食、多尿、多饮、消瘦等,若不能得到有效的控制,可出现各种并发症,遍及患者全身重要器官,严重影响患者的生活质量[10]。糖尿病患者机体内的高血糖、胰岛素抵抗、高血脂等病理状态引起的炎症反应可导致糖尿病性心脏病的发生,有效改善胰島素抵抗及控制血糖水平,降低炎症反应,是预防糖尿病性心脏疾病发病的重要途径[11]。
胰岛β细胞与糖尿病的发生与发展密切相关,其功能减退,是引起糖尿病发病的主要原因,且随着病程延长,胰岛β细胞功能显著降低[12]。DPP-4抑制剂能够抑制β细胞凋亡,促进其重生,增加体内总数量,进而控制血糖[13]。相比较传统降糖药,DPP-4抑制剂的临床治疗效果更好,且安全性高,耐受性好。西格列汀是较为常用的一种DPP-4抑制剂,能提高肠促胰岛素水平,降低胰高血糖素水平,具有葡萄糖依赖性。文献[14]研究显示,采用西格列汀治疗糖尿病,能显著降低患者FPG、糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)水平。本研究中,对糖尿病大鼠采用西格列汀干预,结果显示,干预组大鼠FPG、FINS、HOMAIR均明显低于模型组,ISI显著高于模型组(P<0.05),说明西格列汀能够控制糖尿病大鼠的血糖水平。
Martinov等[15]研究表明,胰岛耐受性与胰腺环境有关,当胰腺无炎症反应的情况下,CXCL10会缺失。炎症反应是造成胰岛β细胞功能异常、凋亡的重要原因,长期暴露于炎症因子,可引起β细胞基因异常表达,使其功能丧失,最终凋亡[16]。趋化因子具有趋化性,其在免疫细胞募集和迁移中发挥重要。CXCL10是一种趋化因子,可介导炎症反应,抑制血管生成,在许多疾病发病中具有重要作用[17]。国外有研究用CXCL10对胰岛β细胞进行干预,结果显示,干预后的胰岛素mRNA表达水平明显低于对照组,细胞凋亡明显增加[18]。胰岛β细胞可产生CXCL10,而CXCL10又能影响胰岛细胞的胰岛素分泌功能,抑制胰岛β细胞的增殖,并诱导其凋亡,最终促进糖尿病的发生。有研究显示,糖尿病患者发病早期时血清CXCL10水平呈现高表达,在抑制其内源性表达后,糖尿病发病率明显降低,说明CXCL10在糖尿病发病中有着重要作用[19]。在糖尿病大鼠模型中,胰岛β细胞分泌CXCL10是吸引其受体CXCR3浸润胰岛的动力。T辅助细胞高度表达CXCR3,并被CXCL10激活,产生免疫反应。CXCL10与CXCR3结合,趋化炎症因子,至炎症部位,在淋巴细胞、自然杀伤细胞、T辅助细胞中均有表达。由胰岛β细胞产生的CXCL10能够通过自分泌与其受体结合,进而抑制胰岛β细胞再生,当CXCR3缺失时,糖尿病发病率显著降低。文献[20]研究显示,在糖尿病患者中,胰腺中表达CXCR3的细胞数量及CXCL10水平均显著上调,说明CXCL10及其受体与糖尿病发病密切相关。目前,有关DPP-4抑制剂对胰岛β细胞CXCL10及其受体表达影响的相关研究较少,本研究选用DPP-4抑制剂西格列汀作为干预药物,研究其对CXCL10及其受体表达的影响,结果显示,干预组胰腺组织形状不规则,界限模糊,细胞数量较空白组少,较模型组多。经西格列汀灌胃治疗后,大鼠胰岛β细胞CXCL10及其受体mRNA及蛋白表达量明显降低。说明DPP-4抑制剂能够逆转胰岛β细胞减少,下调CXCL10及其受体的表达量。国外一项随机实验研究显示,西格列汀能够显著降低CXCL10表达[21],与本研究结果相符合。
综上所述,DPP-4抑制剂能够明显降低糖尿病大鼠的FPG、FINS水平,并下调糖尿病大鼠胰岛β细胞CXCL10及其受体的表达量,可为糖尿病的临床治疗提供新的靶点。
参考文献
[1] Guasch-Ferré M,Hruby A,Toledo E,et al.Metabolomics in Prediabetes and Diabetes: A Systematic Review and Meta-analysis[J].Diabetes Care,2016,39(5):833-846.
[2] Kim N H,Choi J,Kim N H,et al.Dipeptidyl peptidase-4 inhibitor use and risk of diabetic retinopathy: A population-based study[J].Diabetes & Metabolism,2018,44(4):361-367.
[3] LONG M,CAI L,LI W,et al.DPP-4 Inhibitors Improve Diabetic Wound Healing via Direct and Indirect Promotion of Epithelial-Mesenchymal Transition and Reduction of Scarring[J].Diabetes,2018,67(3):518-531.
[4] Masuda D,Kobayashi T,Sairyou M,et al.Effects of a Dipeptidyl Peptidase 4 Inhibitor Sitagliptin on Glycemic Control and Lipoprotein Metabolism in Patients with Type 2 Diabetes Mellitus (GLORIA Trial)[J].Journal of Atherosclerosis and Thrombosis,2018,25(6):512-520.
[5] LIU B,SU X,ZHANG Y,et al.Effect of chronic intermittent hypoxia on the expression of CXC chemokine ligand-10 in rat liver and the interventional effect of N-acetylcysteine[J].Journal of Central South University Medical Sciences,2016,41(8):796-803.
[6]鄒文龙,陈克,孙春涛,等.LncRNA53106调控CXCL10影响胰岛β细胞凋亡[J].中华内分泌代谢杂志,2019,35(9):770-776.
[7] Decalf J,Tarbell K V,Casrouge A,et al.Inhibition of DPP4 activity in humans establishes its in vivo role in CXCL10 post-translational modification: prospective placebo-controlled clinical studies[J].EMBO Molecular Medicine,2016,8(6):679-683.
[8] Agarwal S,Sasane S,Kumar J,et al.Evaluation of novel TGR5 agonist in combination with Sitagliptin for possible treatment of type 2 diabetes [J].Bioorganic & Medicinal Chemistry Letters,2018,28(10):1849-1852.
[9] WU W,LIN L,LIN Z,et al.Duodenum Exclusion Alone Is Sufficient to Improve Glucose Metabolism in STZ-Induced Diabetes Rats[J].Obesity Surgery,2018,28(10):3087-3094.
[10] Cho N H,Shaw J E,Karuranga S,et al.IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J].Diabetes Res Clin Pract,2018,138:271-281.
[11] Jia G,Whaley-Connell A,Sowers J R.Diabetic cardiomyopathy: a hyperglycaemia-and insulin-resistance-induced heart disease[J].Diabetologia,2018,61(1):21-28.
[12] Motterle A,Gattesco S,Peyot M L,et al.Identification of islet-enriched long non-coding RNAs contributing to β-cell failure in type 2 diabetes[J].Molecular Metabolism,2017,6(11):1407-1418.
[13] Tahara N,Yamagishi S I,Bekki M,et al.Anagliptin, A Dipeptidyl Peptidase-4 Inhibitor Ameliorates Arterial Stiffness in Association with Reduction of Remnant-Like Particle Cholesterol and Alanine Transaminase Levels in Type 2 Diabetic Patients[J].Current Vascular Pharmacology,2016,14(6):552-562.
[14]李志琛.西格列汀联合阿卡波糖对2型糖尿病患者的临床研究[J].中国临床药理学杂志,2019,35(20):2543-2546.
[15] Martinov T,Spanier J A,Pauken K E,et al.PD-1 pathway-mediated regulation of islet-specific CD4+ T cell subsets in autoimmune diabetes[J].Immunoendocrinology (Houston,Tex),2016,3:e1164.
[16] CHEN D,WU D,SHAO K,et al.MiR-15a-5p negatively regulates cell survival and metastasis by targeting CXCL10 in chronic myeloid leukemia[J].Am J Transl Res,2017,9(9):4308-4316.
[17] Wolf R M,Jaffe A E,Steele K E,et al.Cytokine, Chemokine, and Cytokine Receptor Changes Are Associated with Metabolic Improvements after Bariatric Surgery[J].The Journal of Clinical Endocrinology and Metabolism,2019,104(3):947-956.
[18] Schive S W,Mirlashari M R,Hasvold G,et al.Human Adipose-Derived Mesenchymal Stem Cells Respond to Short-Term Hypoxia by Secreting Factors Beneficial for Human Islets In Vitro and Potentiate Antidiabetic Effect In Vivo[J].Cell Medicine,2017,9(3):103-116.
[19] Srivastava R,Khan A A,Chilukuri S,et al.CXCL10/CXCR3-Dependent Mobilization of Herpes Simplex Virus-Specific CD8+ T(EM) and CD8+ T(RM) Cells within Infected Tissues Allows Efficient Protection against Recurrent Herpesvirus Infection and Disease[J].Journal of Virology,2017,91(14).
[20] WANG X X,WANG Q Q,WU J Q,et al.Increased expression of CXCR3 and its ligands in patients with vitiligo and CXCL10 as a potential clinical marker for vitiligo[J].The British Journal of Dermatology,2016,174(6):1318-1326.
[21] Dubé M P,Chan E S,Lake J E,et al.A Randomized, Double-blinded, Placebo-controlled Trial of Sitagliptin for Reducing Inflammation and Immune Activation in Treated and Suppressed Human Immunodeficiency Virus Infection[J].Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America,2019,69(7):1165-1172.
(收稿日期:2020-05-20) (本文編辑:张爽)

