基于trnH-psbA和matK序列的不同种油茶种苗DNA条形码分析
代佳妮 于靖 戚华沙 郑蔚 王健 吴友根 赖杭桂 胡新文


摘 要:為有效鉴别出不同种油茶种苗,收集101份不同种油茶种苗作为试材,其中18份越南油茶、79份普通油茶、1份博白大果油茶、3份红花油茶,利用叶绿体基因组trnH-psbA和matK序列进行扩增并测序分析,随后对序列进行拼接及特征分析,并计算样本种间及种内遗传距离,构建系统发育树。结果表明:101份供试材料的trnH-psbA序列全长381 bp,有10个变异位点,可通过变异位点鉴别出越南油茶、红花油茶及部分普通油茶,系统发育树将越南油茶聚为一支,自展支持率为64%;matK序列全长797 bp,有5个变异位点,可通过变异位点鉴别出越南油茶、红花油茶及部分普通油茶,系统发育树将红花油茶聚为一支,越南油茶聚为一支,自展支持率分别为65%和64%。因此,trnH-psbA序列可对越南油茶进行有效鉴别,而matK序列可对越南油茶和红花油茶进行有效鉴别。该研究结果对避免油茶种苗混杂、规范海南油茶种苗市场有一定的指导意义。
关键词:trnH-psbA序列;matK序列;油茶;DNA条形码
中图分类号:S794.4 文献标识码:A
DNA Barcoding Identification of Different Species in Camellia Based on trnH-psbA and matK Sequences
DAI Jiani1, YU Jing1*, QI Huasha1, ZHENG Wei1, WANG Jian1, WU Yougen1, LAI Hanggui2, HU Xinwen2
1. Institute of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. College of Tropical Crops, Hainan University, Hai-kou, Hainan 570228, China
Abstract: In order to effectively identify the species of Camellia seedlings, we collected 101 samples of Camellia seedlings as the test materials, including 18 C. vietnamensis, 79 C. oleifera, 1 C. gigantocarpa, and 3 C. chekiangoleosa. In order to identify all the samples effectively, the trnH-psbA and matK sequences of the chloroplast genome were used for amplification and sequencing analysis, followed by splicing and characterization of the sequences. Subsequently, the sequences were spliced and analyzed, and the genetic distances between the samples were calculated, and the phylogenetic tree was constructed. The results showed that the trnH-psbA sequence of the 101 test materials was 381 bp in length and had 10 mutation sites, which could be used to identify C. vietnamensis, C. chekiangoleosa and parts of C. oleifera. Phylogenetic trees gathered C. vietnamensis as a branch with a self-developed support rate of 64%. The matK sequence showed 797 bp in length and had 5 mutation sites. C. vietnamensis, C.chekiangoleosa and parts of C. oleifera could be identified by the mutation sites. The phylogenetic tree showed that all C. chekiangoleosa species were clustered into one branch with a self-developed support rate of 65%, and all C. vietnamensis species were clustered into one branch with a self-developed support rate of 64%. Therefore, the trnH-psbA sequence could be used to identify C. vietnamensis effectively, and the matK sequence could be used to identify C. vietnamensis and C. chekiangoleosa effectively. The results have certain practical significance for avoiding the hybridization of Camellia seedlings as well as regulating the Hainan Camellia seedling market.
Keywords: trnH-psbA sequence; matK sequence; Camellia; DNA barcode
DOI: 10.3969/j.issn.1000-2561.2021.03.001
油茶是山茶科(Theaceae)山茶属(Camellia)中种子油脂含量较高且具有一定经济价值的植物总称,所属物种约有50个,多为常绿小乔木[1]。油茶籽油中不饱和脂肪酸的含量高于90%,此外,还富含植物甾醇、维生素E、多酚、角鲨烯和类胡萝卜素等多种功能性成分,在预防和治疗心脑血管疾病、抗菌消炎、抗老化等方面,均可发挥一定的作用[2]。油茶在中国已有约2000年的栽培历史,是我国四大木本油料作物之一,具有重要的经济、社会和生态价值[3],其在长江流域和亚热带的高山及丘陵地带多有种植[4],分布于湖南、江西、福建等18个省市[5]。我国油茶种质资源非常丰富,主栽培种包括普通油茶(Camellia oleifera Abel.)、越南油茶(Camellia vietnamensis T. C. Huang ex Hu)、博白大果油茶(Camellia gigantocarpa)、红花油茶(Camellia chekiangoleosa)等[6]。海南省曾是广东的一个行政区,加之部分海南岛油茶果形接近高州油茶,因此,有些学者和海南民间多数认为海南岛油茶属高州油茶(越南油茶C. vietnamensis)[7]。越南油茶适应海南岛常年高温高湿的生态环境,但产果量低于普通油茶。近年来,为了提高茶果产量,许多种植户试图引进内陆普通油茶在海南岛上种植,但外来苗木在海南岛的表现普遍较差,生长速度缓慢、抗逆性差、易受病虫侵害,从而导致存活率较低,盲目的大面积引种普通油茶曾一度造成了海南油茶产业的重大损失[8]。目前,海南省市场上的油茶种苗鱼龙混杂,不少商贩利用普通油茶种子繁育实生苗或作为砧木以降低育苗成本,种植户不慎购买后会面临油茶死亡率高、结果率低的风险。因此,采取有效手段对油茶种苗进行鉴别,对海南油茶产业的发展有着重要的实际意义[9]。
在油茶种质资源鉴定方面,目前常用的有形态学鉴定和分子标记技术2种方法。在形态学鉴定方面,主要以数量性状作为依据进行分类,如刘姝利等[10]选取了50株湖北麻城的早熟油茶,通过观测其种实颜色、形状及成熟期等性状,对该地油茶种质资源进行了评估;杨立荣等[11]以海南省21个老油茶林为研究对象, 取其种实为实验材料,对果实质量、出籽率、果皮厚度等10个数量性状指标进行了观测,从而探究了海南油茶与高州油茶的异同之处,为提高种质资源选育效率提供了基础。在分子学方面,姜德志等[12]选取了109个油茶种质材料为样本,采用ISSR分子标记和聚类分析,鉴定了材料间的亲缘关系;谢荟等[13]利用SRAP分子标记,围绕广西省广宁红花油茶种质资源遗传多样性展开了研究。基于分子数据及相应分析手段应用于分类鉴定是對传统鉴定方法的有益补充,尤其是DNA条形码技术的出现,为物种鉴定提供了新的思路。DNA条形码是通过一段较短的标准基因片段作为分子探针,对物种进行鉴定的分子生物学技术。目前,叶绿体片段matK、rbcL、trnH-psbA和核糖体基因及其转录间隔区的ITS/ITS2等标准条形码常以不同的组合的形式用于植物鉴定中[14]。与其他鉴定方法相比,使用基于测序的DNA条形码可以有效提高物种鉴定稳定性、缩短鉴定时间、降低物种鉴定技术门槛,因此,为了更好地对海南油茶种苗进行鉴定,本研究收集了海南大学儋州校区油茶种质资源圃的101份油茶材料,基于DNA条形码技术,利用trnH-psbA序列和matK序列对不同油茶样本进行鉴定,旨在评价这2个序列在鉴别不同油茶物种上的可行性及有效性,为不同种油茶种苗的鉴别提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 试验材料 于2018年采自海南大学儋州校区的油茶种质资源圃,共101份样本,包括越南油茶18份,红花油茶3份,博白大果油茶1份,普通油茶样本79个,试材编号及样品信息见表1。采集油茶新梢幼叶,迅速用硅胶干燥,常温保存。
1.1.2 试剂和仪器 植物基因组DNA提取试剂盒(中国福际FORE GENE公司)、引物(上海生工)、琼脂糖、PCR MIX(含染料)、GoldView核酸染液、1×TAE缓冲液、2kb DNA marker、无水乙醇、β-巯基乙醇、6×Loading Buffer。电热恒温水浴锅(天津泰斯特)、台式高速冷冻离心机(西川蜀科)、万分之一分析天平(上海佑科)、PCR扩增仪(杭州安杰思)、立式压力蒸汽灭菌器(上海申安)、迷你电泳仪(杭州奥盛)、全自动雪花制冰机(常熟雪科)。
1.2 方法
1.2.1 叶片总DNA提取 经硅胶干燥的叶片,用植物基因组DNA提取试剂盒提取各样本总DNA。用万分之一分析天平称取琼脂糖1.00 g,加入1× TAE缓冲液50 mL,配制2.00%琼脂糖,混匀后微波炉加热2 min,滴加GoldView核酸染液2 μL,混匀倒入电泳槽中,待凝固后将电泳槽放入电泳仪中。取每个样本总DNA 5 μL 和6× Loading Buffer 1 μL混匀后点样进行电泳检测,剩余总DNA保存4 ℃冰箱备用。
1.2.2 PCR扩增 参照Kuzmina等[15]和Sang等[16]的方法设计适用于油茶trnH-psbA和matK序列的特异性引物,分别用于PCR扩增和测序。trnH-psbA正向引物序列:GTTATGCATGAAC GTAATGCTC,反向引物序列:CGCGCATGGTG GATTCACAATCC;matK正向引物序列:CGTAC AGTACTTTTGTGTTTAC GAG,反向引物序列:ACCCAGTCCATCTGGA AATCTTGGTTC。PCR反应体系(25 μL):PCR Mix 12.5 μL,引物F(10 μmol/L)1.0 μL,引物R(10 μmol/L)1.0 μL,模板DNA 1.0 μL,ddH2O 9.5 μL。PCR反应程序如下:95 ℃预变性4 min,94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1 min,35个循环,72 ℃延伸10 min,4 ℃保存。PCR扩增所得产物在0.8%琼脂糖凝胶进行电泳。
1.2.3 双向测序 委托上海桑尼生物科技有限公司完成。
1.3 数据处理
获得测序峰图后,利用CodonCode Aligner V 8.0.1软件进行序列校对拼接,在此基础上辅以人工校正。为了验证所得序列是否为目标序列,使用NCBI在线工具对完整的trnH-psbA和matK序列进行BLAST相似性检索(越南油茶trnH-psbA序列的GenBank登录号为KX121735.1,matK序列的GenBank登录号为KX216418.1;红花油茶trnH-psbA序列的GenBank登录号为HQ427072.1,matK序列的GenBank登录号为MG431968.1;博白大果油茶trnH-psbA序列和matK序列的GenBank登录号均为AB443612.1;普通油茶trnH-psbA序列和matK序列的GenBank登录号均为KY406750.1。)。序列间变异位点的分析、种内和种间遗传距离的计算[基于Kimura-2- Parameter (K2P)模型]以及邻接(NJ)系统发育树的构建均利用MEGA 5.0软件进行分析完成。
2 结果与分析
2.1 总DNA提取和PCR扩增
本试验101份样本提取总DNA电泳质量检测均出现明亮清晰且单一的条带,说明干燥油茶新梢幼叶样本总DNA提取成功率为100%(图1)。由图2和图3可知,PCR产物电泳条带清晰,表明该序列扩增条带纯度较高;有些条带也出现亮度偏暗情况,表明PCR扩增产物浓度偏低。
2.2 trnH-psbA和matK序列的特征分析
如表2所示,trnH-psbA序列长381 bp,G+C含量24.90%,符合叶绿体基因GC含量较低的特点,有10个变异位点,占全长的2.68%,有7个简约信息位点,占总长度的1.84%,转换与颠换的比值为0.52,能够提供较多的物种鉴定信息。matK序列全长797 bp,G+C含量为32.50%;简约信息位点共3个,序列较保守;变异位点5个,分别为202、583、700、708、782 bp位点;序列的转换与颠换的比值为1.06,主要是G与A之间发生转换。
由表3可知,trnH-psbA序列根据10个变异位点把101份油茶样本归类成12大类,变异位点分别为117、173~179、253、280、281、331、362、
363、368、375 bp。其中,类型五(博白大果油茶)在368 bp和375 bp分别由G和T变为T和G,117 bp缺失,由此根据3个变异位点来鉴别博白大果油茶,但本实验只有1个博白大果油茶样本,需进一步验证。3份红花油茶样本被归为两类(类型三和类型六),均在331 bp由T变异为C,在368 bp由G变异为T,因此可初步根据331 bp和368 bp两个变异位点来鉴别红花油茶。18份越南油茶样本中有17份trnH-psbA序列完全一致,类型一(番赛一)在375 bp存在1处种内变异,这可能与环境、地理因素的影响相关,其余越南油茶样本均归类为类型二,在331、363、368 bp处发生变异,初步认为这3个变异位点可用来鉴别越南油茶。通过比较79份普通油茶(表1中序号为23~101)的trnH-psbA序列,发现均出现变异位点,归类为类型四、类型七至类型十二,所有普通油茶样本在363 bp处均未发生变异,大部分普通油茶在331 bp处未变异,少量普通油茶在331 bp处变异为C,因此可根据331 bp和363 bp这2个变异位点来鉴别部分普通油茶。
由表4可知,matK序列根据5个碱基位点把101份油茶样本归类成6大类,变异位点分别为202、583、700、708、782 bp。其中,类型一包括18份越南油茶,在583 bp位点由G变为A,该变异位点可用来鉴别越南油茶,类型二包括3份红花油茶样品,均在202 bp处由A变异为C,其余位点无变异,因此202 bp可用于红花油茶的鉴别。类型三、类型四、类型五对应的碱基突变位点分别为708、782、700 bp,其样品均为普通油茶,因此,这3个位点可用于普通油茶单株的鉴别。类型六(67份普通油茶和1份博白大果油茶)的matK序列均未发生变异,即博白大果油茶未产生特异性的变异位点,matK序列未能将博白大果区分鉴别出来。
2.3 trnH-psbA序列种内、种间遗传距离分析
种间遗传距离大于种内遗传距离可作为理想DNA条形码序列要求,trnH-psbA序列种内和种间遗传距离见表5和表6,普通油茶与其他油茶的最小种间遗传距离为0.005,最大种内遗传距离为0.011,不满足理想DNA条形码要求,表明trnH-psbA序列不能有效区分普通油茶与其他油茶。红花油茶与其他油茶的最小种间遗传距离为0.003,最大种内遗传距离为0.003,不满足理想
DNA条形码的要求,表明trnH-psbA序列不能有效鉴别出红花油茶。博白大果油茶与其他油茶的最小种间遗传距离为0.005,没有种内遗传距离(只有1个样本),无法通过遗传距离得出结论,若加大样本量可进一步得到验证。越南油茶与其他油茶的最小种间遗传距离为0.003,最大种内遗传距离为0.003,初步表明该序列不能有效鉴别越南油茶。
2.4 matK序列种内、种间遗传距离分析
由表7和表8可看出,越南油茶最大种内遗传距离为0,与其他油茶最小種间遗传距离为0.001,其种间遗传距离大于种内遗传距离,表明matK序列可将越南油茶与其他油茶进行区分。普通油茶最大种内遗传距离为0.001,与其他油茶的最小种间遗传距离为0,即matK序列无法对普通油茶进行鉴别。红花油茶的最大种内距离为0,与其他油茶的最小种间距离为0.001,表明matK序列可用来鉴别红花油茶。由于博白大果油茶只有1个样本,无法通过遗传距离得出结论,若加大样本量可进一步得到验证,除此之外,可通过博白大果所特有的外形长势将与其他品种进行区分鉴别。综上所述,matK序列可鉴别红花油茶和越南油茶。
2.5 系统发育树的构建
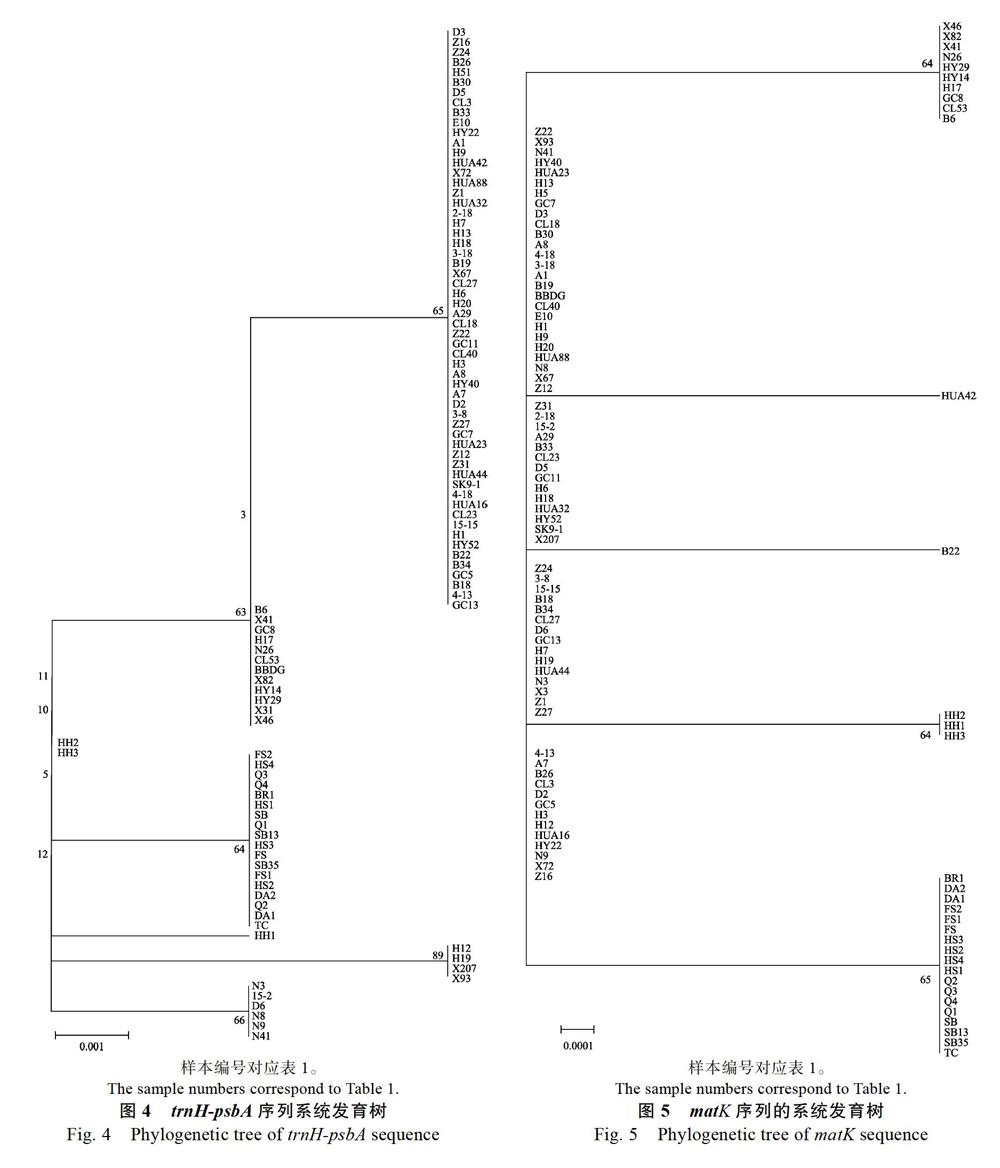
2.5.1 trnH-psbA序列系统发育树的构建 通过MEGA 5.05软件用NJ法构建系统发育树,trnH-psbA序列如图4所示,所有样本聚为6大支。其中18个越南油茶样品聚为一大支,自展支持率为64%;样品H9、H19、仙207和仙93聚为一大支,自展支持率为89%;样品15-2、D6、N3、N8、N9、N41聚为一大支,自展支持率为66%。长林53、仙41等11份普通油茶和1份博白大果油茶聚为一小支,自展支持率为63%,表明普通油茶与博白大果亲缘关系较近,可能在物种进化过程中发生了基因交流;3份红花油茶中,有2份样品(红二、红三)聚为一支,红一则单独成一支,自展支持率均低于50%,可能因为红花油茶的种源差异较大且多态性丰富。通过对系统发育树的分析得出,利用trnH-psbA序列可有效区分越南油茶和其他油茶。
2.5.2 matK序列系统发育树的构建 matK序列系统发育树的构建结果如图5所示,其中18份越南油茶单独聚为一支,3份红花油茶单独聚为一支,自展支持率分别为64%和65%;B6、GC8、Z12Z22H17等10份普通油茶样本聚为一支,自展支持率为64%;博白大果与其余普通油茶未聚成支。以上结果表明matK序列可鉴别出红花油茶和越南油茶,但不能对其他油茶进行区分鉴别。
3 讨论
油茶是我国特有的木本油料树种[1],其籽油中含有脂肪酸、植物甾醇、维生素E、多酚、角鲨烯和类胡萝卜素等多种功能活性成分[2],具有重要的经济、社会和生态价值[3]。研究表明,DNA条形码技术可有效地对不同物种进行分类鉴定,但在山茶科植物评价和鉴别上应用较少[17],目前,国际植物学界主推的植物条形码序列主要有ITS2、matK、rbcL、trnH-psbA、rpoB等,其中matK序列的PCR扩增成功率比较低,引物的通用性比较差[18]。trnH-psbA序列在物种鉴定方面有较高的鉴定成功率[19-20],且叶绿体序列trnH-psbA在物种水平和属水平鉴定效率远高于叶绿体其他条形码候选序列[21]。
在山茶属植物鉴别方面,戚华沙等[9]选取trnH-psbA、rbcL、matk和ITS2序列作为目的序列,对不同种油茶种子进行鉴定,其中,利用trnH-psbA序列可将普通油茶与其他油茶种进行有效鉴别,而matK序列则可用来鉴别越南油茶。在此基础之上,本研究利用DNA条形码技术,选取了trnH-psbA和matK序列对101份油茶样品进行鉴别。
结果表明,越南油茶可基于trnH-psbA序列和matK序列进行鉴别;而红花油茶和普通油茶则更适用基于matK序列的DNA条形码进行鉴定,其中,对普通油茶的鉴别还需进一步实验验证;可初步根据trnH-psbA序列的3个变异位点来鉴别博白大果油茶,但本研究博白大果油茶样品不足,还需进一步验证。综合以上结果,基于DNA条形码技术,联合使用trnH-psbA、和matK序列,可对越南油茶和红花油茶进行有效鉴别,该结果可为不同种油茶种苗的鉴别提供科学依据。除此之外,DNA条形码技术的使用还可减少海南油茶種苗混杂的情况,对规范海南油茶种苗及茶油市场,推动海南油茶产业更好发展有重要意义。日后可通过更多实验,探索出更多适合于山茶科植物,特别是油茶物种分类鉴别的理想DNA条形码候选序列。
参考文献
[1] 黎先胜. 我国油茶资源的开发利用研究[J]. 湖南科技学院学报, 2005, 26(11): 127-129.
[2] 薛 莉, 黄晓荣, 汪雪芳, 等. 食用植物油营养功能成分及检测技术的研究进展[J]. 食品安全质量检测学报, 2017, 8(2): 446-451.
[3] 李海波, 丁红梅, 陈友吾, 等. 12个油茶品种的SSR特征指纹鉴别[J]. 中国粮油学报, 2017, 32(10): 171-178.
[4] 王伟强. 浅谈油茶品种的选择[J]. 现代园艺, 2016(21): 32-33.
[5] 何 方, 何 柏. 油茶栽培分布与立地分类的研究[J]. 林业科学, 2002, 38(5): 64-72.
[6] 于小玉, 喻方圆, 刘建兵, 等. ISSR在油茶品种鉴别和遗传多样性分析中的应用[J]. 南京林业大学学报(自然科学版), 2013, 37(1): 61-66.
[7] 周亚东. 浅谈油茶文化[J]. 热带林业, 2017, 45(2): 42-48.
[8] 贾效成, 陈良秋, 余凤玉, 等. 海南本地油茶优良品系遗传及经济性状研究初报[J]. 热带农业科学, 2018, 38(6): 56-60.
[9] 戚华沙, 代佳妮, 杨英楠, 等. 基于trnH-psbA和matK序列的油茶种子DNA条形码鉴定[J]. 分子植物育种, 2019, 17(15): 5057-5065.
[10] 刘姝利, 舒常庆, 程德峰, 等. 湖北麻城早熟油茶果实性状研究[J]. 经济林研究, 2017, 35(3): 168-173.
[11] 杨立荣, 张治礼, 陈加利, 等. 海南油茶种实数量性状多样性评价[J]. 经济林研究, 2018, 36(3): 69-76.
[12] 姜德志, 方应有, 肖 贤, 等. 基于ISSR标记的油茶种质资源遗传基础分析[J]. 湖北农业科学, 2018, 57(2): 119-125.
[13] 谢 荟, 祝文娟, 张应中, 等. 基于SRAP分子标记的广宁红花油茶种质资源遗传多样性研究[J]. 中南林业科技大学学报, 2017, 37(8): 93-97,113.
[14] 张彩云, 黄珊珊, 颜海飞. DNA条形码技术在中药鉴定中的应用进展[J]. 中草药, 2017, 48(11): 2306-2312.
[15] Kuzmina M L, Johnson K L, Barron H R, et al. Identi-fication of the vascular plants of Churchill, Manitoba, using a DNA barcode library[J]. BMC Ecology, 2012, 12(1): 1-11.
[16] Sang T, Crawford D, Stuessy T. Chloroplast DNA phylogeny, reticulate evolution, and biogeography of Paeonia (Paeoniaceae)[J]. American Journal of Botany, 1997, 84(8): 1120.
[17] 溫贝贝. 基于DNA条形码技术对山茶属植物物种鉴别的探讨[D]. 郑州: 河南农业大学, 2017.
[18] 陈亚辉, 朱海军, 生静雅, 等. DNA条形码序列对不同品种美国山核桃的鉴定[J]. 江苏农业学报, 2013, 29(6): 1445-1450.
[19] 杨 培, 周 红, 马双姣, 等. 叶绿体psbA-trnH序列鉴定药食同源肉桂类药材[J]. 中国药学杂志, 2015, 50(17): 1496-1499.
[20] 张宏意, 袁林林, 饶秋红, 等. 不同产地何首乌叶绿体psbA-trnH基因序列分析[J]. 中草药, 2018, 49(5): 1146-1149.
[21] 陈士林, 庞晓慧, 姚 辉, 等. 中药DNA条形码鉴定体系及研究方向[J]. 世界科学技术-中医药现代化, 2011, 13(5): 747-754.
责任编辑:黄东杰
收稿日期 2020-03-01;修回日期 2020-05-26
基金项目 海南省自然科学基金高层次人才项目(No. 820RC585);海南省重大科技计划项目(No. ZDKJ2017004)。
作者简介 代佳妮(1996—),女,硕士研究生,研究方向:植物次生代谢。*通信作者(Corresponding author):于 靖(YU Jing),E-mail:yujinghxy@163.com。

