PDS5A在胰腺癌中的表达及预后的生物信息学分析
徐明昊,王圆圆,荆雨,孙翠翠,王庆军
(锦州医科大学附属第一医院,辽宁 锦州 121000)
胰腺癌是死亡率很高的恶性肿瘤,位列癌症相关死因的第4位,以及消化系统癌症相关死因的第2位。手术切除是唯一有可能治愈的手段,但由于患者就诊时多处于疾病相对进展或多发转移阶段,仅15%~20%的患者适合行胰腺切除术。此外,即使是完全切除后,预后也很差。切缘阴性(R0)胰十二指肠切除术后,淋巴结阴性者的5年生存率约为30%,淋巴结阳性者为10%[1]。因此,寻找胰腺癌相关特异性基因对于胰腺癌早期筛查具有重要临床意义。粘连蛋白(cohesins)是连接两个染色体拷贝(姐妹染色体)之间的一种蛋白质复合物,其可以确保姐妹染色单体在细胞分裂的时候被均等分配到了子代细胞中。
早期姐妹染色单体解离蛋白(PDS5)是和粘连蛋白相关的一种蛋白质,可以沿着不同的染色体区域与粘连蛋白结合;在脊椎动物中有两种PDS5形式:PDSA和PDSB。研究显示PDS5A与细胞周期相关,可促进G2/M期细胞增殖,机制可能是通过与p63的相互作用促进细胞周期进而导致肿瘤进展[2]。PDS5A是一种核蛋白,在细胞中姊妹染色单体的建立、维持起重要作用。在乳腺癌、肾癌、食管癌、胃癌、肝癌和结肠癌及恶性胶质瘤中观察到PDS5A表达水平的改变[3]。但其在肿瘤发生发展过程中的具体机制尚不明确。本研究通过应用GEPIA分析来自TCGA数据库和GTEx项目的所有恶性肿瘤患者数据,发现PDS5A在胰腺癌表达与患者的预后具有相关性。因此我们在本研究分析其在胰腺癌中的表达及其与分期、预后的关系。
1 资料与方法
1.1 TCGA数据库下载基因表达数据
用于筛选患者差异基因的数据下载自TCGA数据库的RNA-seq数据。项目名称为“pancreatic adenocarcinoma,PAAD”。用平台文件中的探针ID将下载的资料转化为Gene symbol,得到标准基因名称的矩阵。
1.2 GEPIA 分析基因表达及与分期及预后的关系
在GEPIA2的搜索框中输入目标基因名称“PDS5A”,在分析工具栏里选择“profile”,输入基因名称“PDS5A”,分析其在所有肿瘤中的表达情况。分析工具栏里选择“BOXBAR”,添加所有肿瘤类型,logFC临界值设为1,P值设为0.05,对比分析并筛选PDS5A基因在正常及肿瘤组织间有统计学差异表达的肿瘤类型。分析工具栏里选择“stage BAR”,肿瘤类型为“pancreatic adenocarcinoma,PAAD”,分析PDS5A基因与胰腺癌分期的关系。分析工具栏里选择“multiple Survival Plots”,输入基因名称“PDS5A”,分组方式选“Quartile”,选择所有肿瘤。分析PDS5A在所有肿瘤中与生存(OS,DFS)的相关性。
1.3 筛选差异基因及GO富集
对下载的基因表达数据以PDS5A表达的中位值为分界,分为PDS5A低表达及高表达组。应用limma R语言包筛选差异基因,其中Fdr临界值设为0.05,logFC临界值设为1,筛选后的差异基因进行GO富集。
1.4 材料与试剂
PCNA-1(人胰腺癌细胞)、BON-1(人胰腺神经内分泌瘤细胞)、HPDE6-C7(胰腺导管上皮细胞)购于中科院上海生命科学研究院。鼠抗人多克隆PDS5A抗体购于Abnova公司,鼠抗人单克隆 GAPDH 抗体购于北京中杉金桥公司。
1.5 Western blot
取细胞株行预处理后加入RIPA裂解液,提取蛋白,采用BCA法测定蛋白浓度。于10%的SDS-PAGE中电泳,电泳结束后将凝胶中的蛋白质转移至PVDF膜,室温5%脱脂奶粉封闭2 h,用一抗 PDS5A(抗体终浓度均为 1∶500)进行4 ℃孵育过夜。后用以辣根过氧化物酶标记的相应二抗(稀释度 1∶1500)室温孵育1.5 h,TBST 洗涤后用发光显色并拍照。以 GAPDH(稀释度 1∶1500)作为内参对照。
1.6 统计学方法
PDS5A基因及其异构体的表达与预后的关系应用Kaplan-Meier法计算,两组间生存率比较采用Log-rank检验,P<0.05代表有统计学意义。
2 结 果
2.1 PDSA在不同类型肿瘤中的表达情况
应用 GEPIA分析来自TCGA数据库和GTEx项目中各种肿瘤的肿瘤组织及正常组织中PDS5A表达情况。在TCGA数据库中我们观察PDS5A在肿瘤组织及正常组织中表达情况,见图1A。进一步可以发现在胆管癌(cholangiocarcinoma,CHOL)、弥漫性大B细胞淋巴瘤(lymphoid neoplasm diffuse large b-cell lymphoma,DLBC)、胰腺癌(pancreatic adenocarcinoma,PAAD)、胃腺癌(stomach adenocarcinoma,STAD)、胸腺瘤(thymoma,THYM)中PDS5A高表达,差异有统计学意义,见图1B。


A:PDS5A在肿瘤组织与正常组织的表达水平;B:PDS5A在肿瘤组织中高表达且具有统计意义的肿瘤,*表示P<0.05
2.2 PDS5A表达与肿瘤预后的关系分析
应用 GEPIA2分析来自TCGA数据库中不同肿瘤的PDS5A表达情况与生存的相关性。我们在250例PAAD数据中发现PDS5A高表达与总生存 (overall survival,OS)具有负相关性,差异有统计学意义,P<0.05,见图2A。与无病生存期(disease-free survival,DFS)差异无相关性,见图2B。

A:PDS5A表达与胰腺癌OS的相关性;B:PDS5A表达与胰腺癌DFS的相关性
2.3 PDS5A与肿瘤分期的相关性
进一步亚组分析我们观察了PDS5A基因与胰腺癌分期的相关性,发现PDS5A与分期无相关性,见图3。
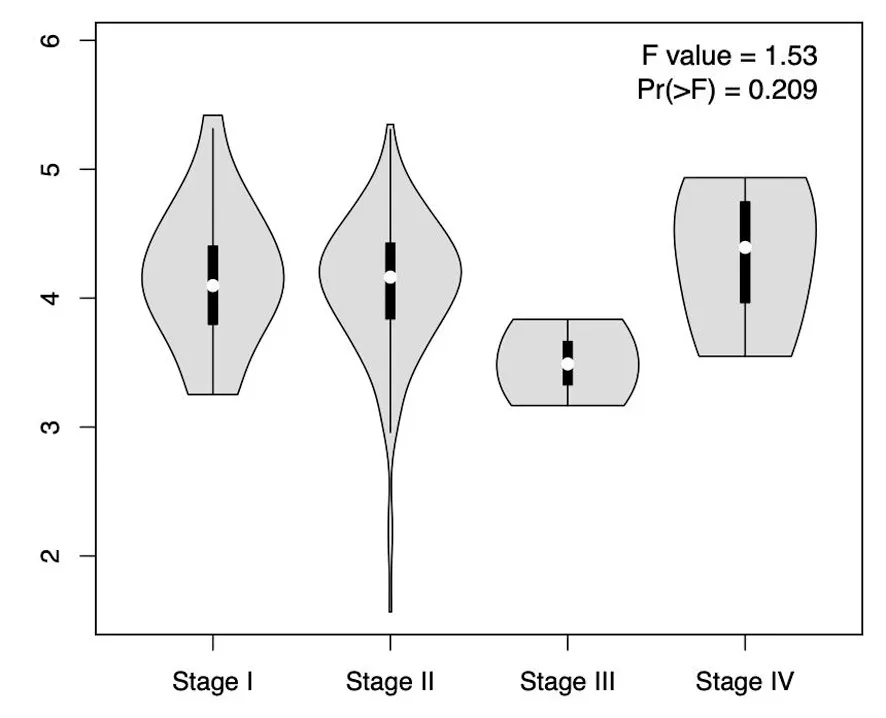
图3 PDS5A表达与胰腺癌分期的相关性
2.4 差异基因的GO富集分析
通过筛选PDS5A不同表达组的差异基因,并进行GO富集。我们发现PDS5A相关差异基因主要富集于消化系统功能相关的AQP5、SPINK1及上皮细胞结构功能相关的MUC6、TFF2等基因上,见图4。进一步的柱状图分析显示PDS5A基因的表达与这些基因有相关性,其高表达的同时AQP5、SPINK1、MUC6、TFF2表达降低,差异有统计学意义,见图5。

图4 PDS5A高低表达组差异基因的GO富集
2.5 PCNA-1(人胰腺癌细胞)、BON-1(人胰腺神经内分泌瘤细胞)、HPDE6-C7(胰腺导管上皮细胞)中PDS5A表达
Western blot结果显示,PCNA-1细胞中PDS5A的表达高于BON-1及HPDE6-C7细胞,见图6。

**表示P<0.01;*表示P<0.05
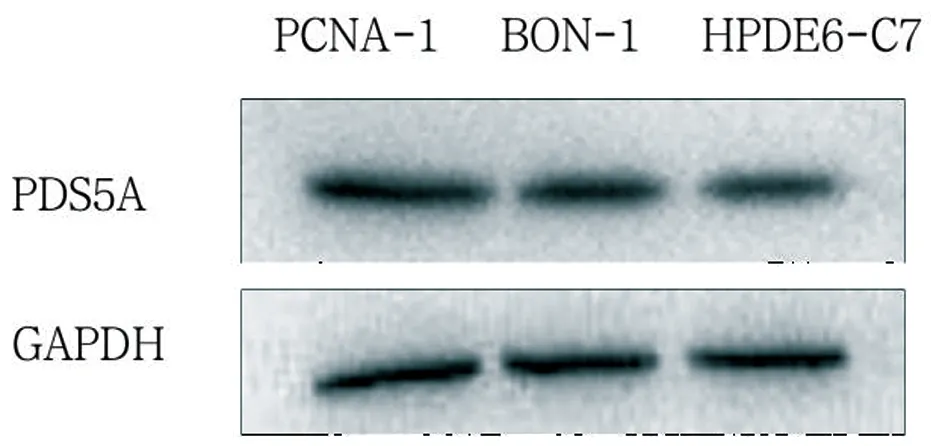
图6 PDS5A在不同细胞中的表达
3 讨 论
染色体不稳定和非整倍体形成,即染色体的获得和丢失,是大多数恶性肿瘤细胞的特征,发生在肿瘤形成的早期阶段[4]。这种改变可导致细胞内信号网络的放松调节,抑癌基因的缺失和致癌基因的过度表达[5]。PDS5蛋白质早熟解离,是一种在姐妹染色单体存在凝聚时表达的核蛋白,与粘蛋白复合物相互作用形成环状结构,将姐妹染色单体连接在一起,并通过有丝分裂使纺锤体在子细胞之间平均分布[6]。在人类细胞中,PDS5参与稳定复制的机制被干扰从而导致DNA出现损伤[7]。因此,PDS5表达缺陷不仅导致染色体错配和非整倍体出现,而且导致DNA修复缺陷,从而导致有丝分裂细胞死亡和癌变。脊椎动物中有两种PDS5蛋白,PDS5A和PDS5B,但其功能机制尚不十分明确。
研究表明,在乳腺癌细胞中过表达PDS5A可使G1期细胞数量增加和caspase-3活化增强,进而导致肿瘤细胞凋亡。此外,与相应的正常组织相比,在乳腺和肾脏肿瘤样本中观察到PDS5A mRNA的下调[8],而另一项研究报告了在食管、胃、肝脏和横结肠肿瘤中PDS5A mRNA水平的上调。PDS5A在鼻咽癌细胞中的过度表达导致细胞过度增殖,但PDS5A siRNA的表达则减低[2]1-11。总之,这些数据表明PDS5A在肿瘤发生、发展过程中可能具有极强组织特异性,不同的细胞和组织类型,可显示出肿瘤细胞增殖抑制或过度增殖作用。因此本研究旨在探讨PDS5A与恶性肿瘤的关系及机制。我们通过GEPIA在线分析软件分析了在各个恶性肿瘤中PDS5A表达,发现其在5种肿瘤组织中高表达,且与正常组织相比,差异有统计学意义。同时,我们Western blot的研究显示PDS5A在胰腺癌细胞中的表达高于正常胰腺细胞。进一步的预后分析表明其与胰腺癌预后指标OS具有相关性,PDS5A高表达组显示出较差的OS结局,但与DFS并未显示出相关性。考虑其原因可能是可RO切除的胰腺癌患者相对体能较好、分期较早、无转移及血管浸润,因此这部分患者未表现出DFS的差异。同时有研究显示,病灶相对局限的胰腺癌最可能通过切除治愈,不过有局限性淋巴结受累的胰腺癌患者接受完全R0切除后,约有30%也可能长期生存[1]185-191。
研究表明,ⅠA期、ⅠB期、ⅡA期、ⅡB期和Ⅲ期胰腺癌患者的中位生存期分别为38、24、18、17和14个月[9],这说明胰腺癌分期越晚,预后越差。但遗憾的是我们的分析显示PDS5A的表达与肿瘤的分期并无相关性,考虑可能与获取的病理组织分期及特点有关。胰腺癌预后差,初诊时往往已经因患者病灶广泛、浸润血管、远处转移、体能欠佳失去手术机会,因此纳入的可手术病理标本往往分期较早,进而导致患者的筛选存在偏倚而无法观察到与分期的关系。
我们进一步通过对PDS5A高表达组与低表达组差异基因的GO富集发现,AQP5、SPINK1、MUC6、TFF2等相关差异基因主要富集在消化功能和上皮结构相关功能基因类别上,同时与PDS5A的表达负相关。肿瘤所依赖的各种代谢都需要水分子的参与,而水通道蛋白可以快速特异的转运水分子。AQP5作为水通道家族成员之一,在维持肿瘤细胞渗透压稳定,肿瘤细胞迁移、EMT,肿瘤新生血管形成过程中起到重要作用[10]。SPINK1又被称为胰腺分泌性胰酶抑制因子,由 56 个氨基酸残基组成,可抑制胰蛋白酶原活性,拮抗胰腺的“自身消化”。其与胰蛋白酶的比例参与维持胰腺内环境稳定。SPINK1 基因突变与慢性胰腺炎的发生密切相关,而后者则是胰腺癌发生的危险因子。研究证实,SPINK1 作为肿瘤抑癌基因参与负向调控肿瘤细胞的侵袭、迁移,进而诱导肿瘤细胞凋亡[11]。MUC 6(黏蛋白 6)作为黏蛋白家族成员之一,由上皮细胞分泌,参与保护黏膜上皮、调节细胞黏附等功能,当上皮细胞受损或癌变时异常表达。有研究显示,粘蛋白相关疫苗可通过激活患者的免疫系统起到抗肿瘤作用[12]。另有研究报道,通过调节黏蛋白的表达,可明显抑制肿瘤进展[13]。FFT2作为三叶因子家族成员之一,具有及保护及修复黏膜、促进肿瘤细胞调往等功能[14],所以被认为是抑癌因子。这与我们的发现基本一致,PDS5A高表达与AQP5、SPINK1、MUC6、TFF2等抑癌基因低表达相关,故认为可导致胰腺癌预后不良。
总结,染色体不稳定和非整倍体形成,是大多数恶性肿瘤细胞的重要特征,发生在肿瘤发展的早期阶段。但其在肿瘤中的发生、发展中的具体作用尚不十分清楚。我们的分析表明PDS5A在胰腺癌中的表达与患者预后相关,其高表达提示预后不良。进一步富集分析表明其与消化功能及上皮结构相关基因呈负相关。我们提出假设,其在胰腺癌中的高表达也可能通过这两方面的功能异常导致肿瘤转移能力及恶性程度增强,进而使患者预后较差。本研究目前主要集中于现有数据库临床样本资料的分析并进行了初步的Western blot分析,进一步的研究将在免疫组化及更进一步的细胞实验验证相关机制。

