不同类型双色百合的花色形成分析
王 欢,孔 滢,窦晓莹,郎利新,白锦荣*
(1 北京市辐射中心,北京 100875;2 北京市科学技术研究院,北京 100089;3 北京师范大学 核科学与技术学院射线束技术教育部重点实验室,北京100875)
花色是观赏植物最重要的品质性状之一,决定着花卉作物的商业价值。百合(Liliumspp.)是世界著名的花卉,有着很高的观赏价值和经济价值。百合花色具有广泛的变异,有白色、黄色、橙色、粉色、紫色、红色等。花色的形成主要受花朵中色素种类和含量的影响[1]。花青苷[2]和类胡萝卜素[3-5]是百合花被片中积累的主要色素成分,粉色花中主要花色成分为花青苷[2],黄色和橙色花中主要含有类胡萝卜素,红色花中同时含有花青苷和类胡萝卜素[3-4,6]。
双色百合是百合花朵着色模式的一种变异类型[7]。由于不同种类和含量的色素成分在百合花被片不同区域的差异积累,在同一花被片上形成了两种不同的花色。与单色花相比,双色百合具有更独特的花色表型和更高的观赏价值。亚洲百合主要有两种双色类型,一类是花青苷在花被片上部积累着色,例如‘Lollypop’花被片上部为粉色、下部为白色[7-8];另一种类型是花青苷在花被片下部积累着色,例如‘Tiny Padhye’上部白色、下部为深紫色[9],‘Grand Cru’上部为黄色、下部具有红色大花斑[10]。关于双色花形成机理已有研究,在矮牵牛(Petuniahybrida)[11-12]、山茶(Camelliajaponica)[13]和大丽花(Dahliavariabilis)[14-15]中,CHS基因的转录后沉默是双色花瓣形成的主要原因。双色百合中,‘Lollypop’双色性状的形成是由于花青苷合成基因的转录调控引起的[8];‘Tiny Padhye’中,花青苷合成基因在花被片下部特异表达导致花青苷特异地积累于花被片下部[9];‘Grand Cru’黄色花被片下部红色大花斑的形成则是由于LhMYB18的转录调控[10]。
目前双色百合形成的研究主要集中在花青苷成分和代谢通路上,而对类胡萝卜素组成未进行分析,类胡萝卜素成分和含量对双色百合形成的影响尚不明确。本研究以花被片上部分别为白色、黄色和橙色,下部为紫红色的3种双色类型的亚洲百合为实验材料,对花色表型、花青苷和类胡萝卜素成分及含量进行综合分析,明确不同类型双色百合的差异和形成的物质基础,以期为百合花色形成机理研究和花色的遗传改良提供理论依据。
1 材料和方法
1.1 实验材料
供试材料为3个亚洲百合双色品种,分别为‘Black Eye’(BE)、‘Pieton’(PI)和‘Twosome’(TW),花部性状如图1所示。种球于2018年购自荷兰,栽植于北京市辐射中心怀柔百合资源圃(地理位置40°15′N,116°42′E)。试验于2020年6月百合盛花期进行,选取生长状况一致的植株3株,在晴天上午9:00~10:00剪取新鲜花朵,测定花色表型,并将花被片上、下部分别取样(去除中脉部分),经液氮速冻后保存于-80 ℃冰箱中备用。

图1 3个亚洲百合双色花品种表型BE.Black Eye;PI.Pieton;TW.TwosomeFig.1 Flower phenotype of three bicolor Asiatic hybrid lilies
1.2 试剂与标准品
色谱级甲醇、甲酸、三氟乙酸、乙腈和乙醇购自德国Merck公司,色谱级甲基叔丁基醚、正己烷和丙酮购自上海安谱实验科技股份有限公司,色谱级2,6-二叔丁基-4-甲基苯酚(BHT)购自美国Sigma-Aldrich公司。超纯水由Milli-Q超纯水系统(Millipore,Bedford,MA,USA)制备。
标准品矢车菊素3-O-β-芸香糖苷、紫黄质和新黄质购自美国Sigma-Aldrich公司;α-胡萝卜素、花药黄质、γ-胡萝卜素、六氢番茄红素、八氢番茄红素、ε-胡萝卜素、α-隐黄质、辣椒玉红素购自BOC Sciences;叶黄素和β-阿朴胡萝卜素醛购自上海阿拉丁生化科技股份有限公司;番茄红素、β-胡萝卜素和虾青素购自上海易恩化学技术有限公司;玉米黄质购自上海毕得医药科技有限公司;β-隐黄质和辣椒红素购自Extrasynthese。
1.3 实验方法
1.3.1 花色表型测定于百合盛花期时,取新鲜开放的百合花被片,用英国皇家园艺学会比色卡(Royal Horticultural Society Color Chart,RHSCC)和色差仪(NF333,Nippon Denshoku Industries Co.Ltd.,Japan)对花色进行测定。使用色差仪时,以光源C/2°为条件进行花色表型测定,测定位置为内花被片的上部和下部着色中央部位。测定时将色差仪的集光口对准测定位置,获得花色的明度L*值、色相a*和b*值,并计算彩度C*=(a*2+b*2)1/2和色相角h=arctan(b*/a*)。重复测定3次,取平均值。
1.3.2 花青苷含量分析将花被片样品从-80 ℃冰箱中取出,在液氮中迅速研磨成粉末。将适量的样品加入花青苷提取液(三氟乙酸∶甲醇∶甲酸∶水=1∶70∶2∶27,v∶v∶v∶v)中,充分涡旋混匀,4 ℃ 过夜静提。离心后取上清,经0.22 μm微孔滤膜过滤,将萃取液保存于-20 ℃ 冰箱中。利用HPLC-DAD分析系统(1200,Agilent Technologies,CA,USA)进行花青素成分分析,色谱柱为ZORBAX Eclipse Plus C18分析柱(4.6 mm×250 mm,5 μm,Agilent Technologies,CA,USA)。流动相A:0.1% 甲酸溶液,流动相B:0.1%甲酸乙腈溶液。流速:1.0 mL/min;柱温:30 ℃;检测波长:530 nm。梯度洗脱程序参考前人设置[9]。用标准品矢车菊素3-O-β-芸香糖苷制作标准曲线,以标准品浓度为横坐标,峰面积为纵坐标,绘制标准曲线,标准曲线方程为y=16193x-35.627,R2=0.9996。将检测出的花青苷的峰面积代入标准曲线方程中,计算得到待测样本中花青苷的含量。
1.3.3 类胡萝卜素定性定量分析将超低温保存的样品进行冷冻干燥后,用研磨仪研磨(30 Hz,1 min)至粉末状。称取50 mg粉末溶解于1 mL正己烷∶丙酮∶乙醇(2∶1∶1,v∶v∶v)提取液中,加入0.01% BHT(w/v)及内标。室温下涡旋提取20 min。12 000 g离心5 min后,吸取上清液。重复上述步骤,收集上清液,浓缩至干后保存。加入100 μL甲醇∶甲基叔丁基醚(1∶1,v∶v)溶液溶解样品,涡旋均匀,12 000 g离心2 min。经0.22 μm微孔滤膜过滤后保存于棕色进样瓶中,用于LC-MS/MS分析。每个样品进行3次生物学重复。
采用LC-APCI-MS/MS系统(UHPLC,ExionLCTMAD;MS,Applied Biosystems 6500 Triple Quadrupole)对类胡萝卜素样品进行分析,并利用软件Analyst 1.6.3处理质谱数据。色谱柱为YMC C30柱(2 mm×100 mm,3 μm)。流动相A为甲醇∶乙腈(3∶1,v∶v),含0.01% BHT和0.1%甲酸;流动相B为甲基叔丁基醚,含0.01% BHT。洗脱梯度(流动相A∶流动相B):0 min,100∶0(v∶v);3 min,100∶0(v∶v);6 min,58∶42(v∶v);8 min,20∶80(v∶v);9 min,5∶95(v∶v);9~10 min,100∶0(v∶v);11 min,100∶0(v∶v),流速为0.8 mL/min,进样量2 μL,柱温28 ℃。质谱条件主要包括:大气压化学离子源(atmospheric pressure chemical ionization,APCI)温度350 ℃,气帘气(curtain gas,CUR)25 psi。
配制不同浓度的类胡萝卜素标准品溶液,采集各个浓度标准品的对应信号的质谱峰强度数据。以外标与内标浓度比值为横坐标,外标与内标峰面积比值为纵坐标,建立不同类胡萝卜素的标准曲线(表1),根据标准曲线方程,计算样本中类胡萝卜素的绝对含量。

表1 类胡萝卜素标准品的标准曲线方程Table 1 Standard curve equation of carotenoid standards
1.4 数据分析
采用Excel 2013对数据进行整理,用IBM SPSS Statistics 20.0进行方差分析、Duncan’s差异显著性分析(P<0.05)和多元线性回归分析。用RStudio软件进行数据分析和图片绘制,使用factoextra包进行主成分分析。
2 结果与分析
2.1 双色百合不同部位的花色表型
对3个双色百合花被片正面的花色进行测定,各品种花被片表型参数值如表2所示。3个双色百合品种中,明度值L*随着花被片颜色变深而降低,花被片上部的L*值高于下部,白色、黄色花被片的L*值高于橙色花被片,紫红色花被片L*值较低。橙色花被片的色相a*值最高,黄色和白色花被片的a*值最低。花被片上部的色相b*值高于花被片下部,黄色和橙色花被片的b*值明显高于其他颜色的花被片,紫红色花被片b*值最低。彩度值C*在花被片上部高于花被片下部,橙色花被片的彩度值C*最高,白色花被片C*值最低。色相角h值显示所测品种的色度在红色到黄色之间。花色表型分布如图2所示,3个双色百合花被片上部分别为白色系、黄色系和橙色系,花被片下部均为紫红色系,深浅程度不同。在a*、b*二维色度空间上,花被片上部和下部的颜色分布在第Ⅰ、Ⅱ象限中。不同双色百合品种花被片上部和下部花色表型具有明显的差异。

表2 3个双色百合品种花被片正面花色表型参数值Table 2 Color parameters on the adaxial surface of tepals of three bicolor lily cultivars
2.2 双色百合中的花青苷含量
对3种双色百合盛花期花被片上下部的花青苷含量进行HPLC分析,结果发现(图3),3种双色百合中,仅在花被片下部检测到花青苷,且仅检测到一种花青苷即矢车菊素-3-O-β-芸香糖苷,花被片上部均未检测到花青苷。不同百合品种花被片下部中,深紫色的‘Black Eye’中花青苷含量显著高于紫色的‘Twosome’和‘Pieton’,是二者的3倍左右;而‘Twosome’和‘Pieton’中花青苷含量差异不显著。由此可见,3个双色百合花被片下部紫色呈色是由于单一花青苷成分的特异积累,紫色的深浅程度与花青苷含量具有相关性。

BE.Black Eye;PI.Pieton;TW.Twosome;u.花被片上部;d.花被片下部。下同图2 3个双色百合品种花被片上部和下部的花色表型分布BE.Black Eye;PI.Pieton;TW.Twosome;d.Basal tepal;u.Upper tepal.The same as belowFig.2 Distribution of flower color on the upper and basal of tepals of three bicolor lily cultivars
2.3 双色百合中类胡萝卜素成分及含量
在3个双色百合品种的花被片上部和下部样品中,共检测到15种类胡萝卜素成分(图4)。就类胡萝卜素总含量而言,‘Pieton’花被片中类胡萝卜素总含量较高(112.382~130.432 μg/g),‘Twosome’花被片中类胡萝卜素总含量处于中等水平(74.372~107.653 μg/g),‘Black Eye’中类胡萝卜素总含量最低(50.721~71.509 μg/g)。在花被片不同部位中,‘Black Eye’和‘Pieton’花被片下部的类胡萝卜素总含量高于上部,而‘Twosome’中类胡萝卜素总含量则在花被片上部较高。进一步比较各类萝卜素成分含量,玉米黄质(16.667~37.367 mg/g)在各个样品中含量都较高,其含量在‘Black Eye’花被片中占类胡萝卜素总含量的50%以上。花药黄质、紫黄质和β-胡萝卜素在‘Pieton’花被片中含量较高,八氢番茄红素和辣椒红素在‘Twosome’花被片中含量较高,叶黄素在‘Black Eye’和‘Pieton’花被片中含量也较高。其他类胡萝卜素的含量处于较低水平,γ-胡萝卜素、α-胡萝卜素、ε-胡萝卜素和β-阿朴胡萝卜素醛在所有样品中含量均低于1%。对不同双色百合中的类胡萝卜素成分进行比较发现,花药黄质和紫黄质是‘Pieton’花被片中的特征成分,这2种成分的含量是‘Black Eye’和‘Twosome’的2倍以上;辣椒红素是‘Twosome’花被片的特征成分,其含量是‘Black Eye’和‘Pieton’的2倍以上;‘Black Eye’中未检测到特征类胡萝卜素成分。综上所述,不同双色百合品种花被片上部和下部中类胡萝卜素含量差异显著,且类胡萝卜素成分在不同类型双色百合中的积累具有特异性。

NA.未检测到;不同小写字母表示在0.05水平上差异显著,下同图3 3个双色百合品种花被片中花青苷含量NA.Not detected;Different lowercase letters indicate significant differences at 0.05 level;the same as belowFig.3 Content of anthocyanin in the tepals of three bicolor lily cultivars

图4 3个双色百合品种花被片中类胡萝卜素含量Fig.4 Contents of carotenoids in tepals of three bicolor lily cultivars
2.4 双色百合中类胡萝卜素的主成分分析
对百合花被片样品中含量均高于1%的11种类胡萝卜素物质进行主成分分析(图5),结果显示PC1和PC2分别能够解释样品中51.9%和34.1%的差异,不同百合品种分布在不同象限中。‘Pieton’花被片中具有较高含量的花药黄质、紫黄质、β-胡萝卜素和叶黄素,除β-胡萝卜素外,其余成分在花被片下部含量较高;‘Twosome’花被片中的特征成分为辣椒红素和辣椒玉红素,辣椒红素是其主要成分,且在花被片上部含量较高;与‘Pieton’和‘Twosome’相比,‘Black Eye’花被片上部和下部类胡萝卜素含量差异较大,花被片下部有着更高含量的玉米黄质。以上分析表明,类胡萝卜素成分和含量具有明显的品种间差异;而同一百合品种花被片上部和下部中类胡萝卜素组成比较接近,含量差异明显。
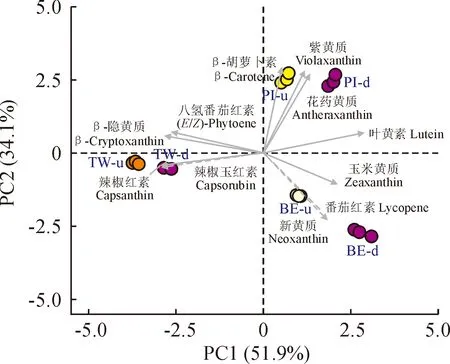
图5 3个双色百合品种花被片中类胡萝卜素含量的主成分分析Fig.5 Principal component analysis of carotenoids contents in tepals of three bicolor lily cultivars
2.5 色素成分对花色的影响
为了解析色素组成与百合花被片颜色形成的关系,以花被片色差参数L*、a*、b*作为因变量,以花青苷成分矢车菊素-3-O-β-芸香糖苷以及类胡萝卜素的主要成分作为自变量,进行多元线性回归分析。其中类胡萝卜素的主要成分包括八氢番茄红素、玉米黄质、花药黄质、紫黄质、辣椒红素、叶黄素和β-胡萝卜素共8个指标(分别以x1、x2、x3、x4、x5、x6、x7、x8表示)。获得的回归方程为:L*=76.627-4.597x1-1.187x6(R2=0.692,P<0.01);a*=-67.333+2.174x6+1.718x3+2.476x8(R2=0.941,P<0.01);b*=-23.905+2.972x2-2.349x6(R2=0.792,P<0.01)。
回归分析结果表明,百合花被片颜色与色素成分之间存在极显著相关性(P<0.01)。矢车菊素-3-O-β-芸香糖苷和辣椒红素是影响L*值的关键色素,这2种成分的积累可以显著降低花被片的亮度,其中矢车菊素-3-O-β-芸香糖苷回归系数的绝对值更大,对亮度值L*的影响更为显著。辣椒红素对b*值也具有显著负效应,并与色相a*值呈负相关,其含量的增加可以降低花朵的黄度、提高花朵的红度。β-胡萝卜素和玉米黄质对a*值具有显著正效应,影响花被片红色的呈现。此外,无色的八氢番茄红素与黄度b*值也呈显著正相关。因此,可以认为矢车菊素-3-O-β-芸香糖苷、辣椒红素、八氢番茄红素、玉米黄质和β-胡萝卜素是影响百合花色的主要成分。
3 讨 论
本研究对3个不同类型的双色百合品种花被片不同部位的花色表型、花青苷和类胡萝卜素成分及含量进行了综合分析,结果发现,3个双色百合中,仅在紫色花被片下部检测到一种花青苷即矢车菊素3-O-β-芸香糖苷,花被片上部均未检测到花青苷。不同类型双色百合品种花被片中积累不同种类和含量的类胡萝卜素,而同一品种花被片上部和下部中的类胡萝卜素种类相近、含量差异显著,说明花青苷和类胡萝卜素成分对百合花色的形成具有显著影响。
3.1 花青苷对百合花色的影响
花青苷是植物中一种重要的类黄酮化合物,可以使植物呈现粉色、红色、橙色、蓝色和紫色等[16-17]。百合花被片中的花青苷成分主要是矢车菊素3-O-β-芸香糖苷,一些百合品种中少量积累矢车菊素3-O-β-芸香糖苷-7-O-β-葡糖苷[2]。本研究对3个双色百合品种花被片中的花青苷成分进行分析,仅在紫色花被片下部检测到矢车菊素-3-O-β-芸香糖苷一种花青苷成分,白色系、黄色系和橙色系花被片上部则未检测到花青苷,与前人对于双色百合的分析结果一致[8-9]。百合花被片中花青苷的含量与色相差异具有正相关性,不同花色百合品种中花青苷含量不同,表现为棕色>深红色>粉红色>浅粉色[6]。本试验中3种双色百合花被片下部中,‘Black Eye’花被片下部呈深紫红色,其矢车菊素-3-O-β-芸香糖苷含量最高。多元线性回归分析表明,矢车菊素-3-O-β-芸香糖苷的含量影响花色表型参数L*值和C*值,其含量的增加可以降低花被片的亮度和彩度。研究表明,花青苷在不同花色类型百合花被片中的差异积累主要由R2R3-MYBs转录因子调控[6,10,18-20],其结果使花被片呈浅粉色、粉色、红色和棕色等。本研究中花青苷在不同品种、同一品种花被片不同部位的差异积累是否由R2R3-MYB类转录因子调控,需要进一步研究。
3.2 类胡萝卜素对百合花色的影响
类胡萝卜素是自然界中广泛分布的一类色素,可以赋予蔬菜、果实和花卉黄色、橙色至红色等丰富多彩的色泽,对于园艺植物的外观品质具有重要影响[21-22]。已有研究发现,百合花被片中积累不同种类的类胡萝卜素,其中黄色花被片中含有花药黄质、(9Z)-紫黄质、叶黄素、紫黄质和β-胡萝卜素[3-4],橙色和红色花被片中含有辣椒红素[3,23-24],粉色和白色品种花被片中含有少量的类胡萝卜素[3,25-26]。本试验利用LC-APCI-MS/MS技术对3个亚洲百合双色品种的类胡萝卜素物质进行定性定量分析,共检测到15种类胡萝卜素物质,其成分和含量在不同品种中的积累具有特异性,同一百合品种花被片上部和下部中的主要类胡萝卜素组成相同、含量差异显著。黄色品种‘Pieton’中类胡萝卜素含量最高,其特征成分为花药黄质、紫黄质和β-胡萝卜素,花被片下部含量较高;橙色品种‘Twosome’中的主要成分为八氢番茄红素、辣椒红素和玉米黄质,花被片上部含量较高,其中辣椒红素是其特征成分;白色品种‘Black Eye’中类胡萝卜素含量最低,其中玉米黄质含量较高,但并不是其特征类胡萝卜素成分。研究表明,类胡萝卜素的积累对桂花[27-28]、水仙[29]、黄色月季[30]等的花色表型具有显著影响。本研究中,多元回归分析表明辣椒红素是影响百合花被片呈色的重要类胡萝卜素成分,其含量越高,花色越红、亮度和黄度越低。β-胡萝卜素和玉米黄质的增加也与红色的呈现正相关。八氢番茄红素为无色的类胡萝卜素,其与柑橘果皮红色性状显著正相关[31];在本研究中八氢番茄红素对b*值具有显著影响,这可能是由于八氢番茄红素是类胡萝卜素代谢通路下游有色类胡萝卜素合成的重要前体物质。
3.3 类胡萝卜素成分的差异积累
类胡萝卜素合成途径中番茄红素的环化反应是调控代谢途径的关键分支点。番茄红素在番茄红素β-环化酶(LCYB)和番茄红素ε-环化酶(LCYE)的催化下,在α-分支中产生δ-胡萝卜素和α-胡萝卜素,在β-分支中产生γ-胡萝卜素和β-胡萝卜素[21]。LCYB和LCYE酶活性的差异可导致类胡萝卜素不同分支的代谢流向。随后β-羟化酶(BCH)和ε-羟化酶(ECH)将α-胡萝卜素转化为叶黄素;β-胡萝卜素在BCH的作用下生成β-隐黄质和玉米黄质,之后玉米黄质在玉米黄质环氧酶(ZEP)的环氧化作用下依次生成花药黄质和紫黄质,紫黄质进一步在新黄质合成酶的作用下生成新黄质,或者是在紫黄质脱环氧酶(VDE)的作用下逆转化生成玉米黄质[21-22,32]。花药黄质和紫黄质可以在辣椒红素/辣椒玉红素合成酶(CCS)的催化下分别生成辣椒红素和辣椒玉红素[4,33]。本试验中3种百合花被片中叶黄素含量均不高,而β-分支中的玉米黄质、花药黄质、紫黄质、辣椒红素在不同品种中分别有较高的含量,推测可能是由于LCYB和LCYE基因表达水平的差异导致了类胡萝卜素合成在两条分支途径产生了差异。本研究还发现,‘Twosome’花被片中辣椒红素和辣椒玉红素特异积累,花药黄质和紫黄质含量则较低;而‘Pieton’则相反,其花被片中有较高含量的花药黄质和紫黄质,而辣椒红素和辣椒玉红素含量极低或不含有。橙色和黄色百合花被片颜色差异的原因可能是由于CCS基因的差异表达,进而使得类胡萝卜素成分的差异积累导致的。
综上所述,不同类型双色百合花色的形成是由于花青苷和类胡萝卜素成分在花被片不同区域的差异积累导致的。花被片上部积累类胡萝卜素,其成分和含量的差异使不同品种呈现白色、黄色和橙色;花被片下部同时积累花青苷和类胡萝卜素,使其呈现深紫色。本研究结果为双色百合呈色的分子调控机制解析奠定了基础,对于百合花色的遗传改良具有重要的指导意义。

