兴安落叶松生理指标和光合特性对不同光环境的响应
李金博 曾昭文
摘要:以北方大兴安岭地区主要植被兴安落叶松为试验材料,用黑色遮阴网的方法研究不同光环境下兴安落叶松叶片生理指标及光合特性的变化,并利用叶绿素荧光技术研究不同遮阴条件对兴安落叶松叶片PSⅡ功能的影响。结果表明,随着遮阴程度的增加,兴安落叶松根系活力呈下降趋势,叶面积增长缓慢,且叶片数量下降幅度明显。兴安落叶松叶片地上生物量、地下生物量和胸径均随遮阴程度的增加呈下降趋势。在光照度为70%时,地上生物量比10%光环境下提高193.6%。随着遮阴程度的增加,兴安落叶松叶片的净光合速率(Pn)呈显著降低趋势,叶片的气孔导度(Gs)、蒸腾速率(Tr)变化趋势与之相似。兴安落叶松叶片的光化学淬灭系数(qP)、PSⅡ最大光化学效率(Fv/Fm)和电子传递速率(ETR)随着遮阴程度的增加均呈降低趋势,在光照度为70%时,叶片的非光化学淬灭(NPQ)较10%光环境时降低了26.65%,遮阴显著降低了兴安落叶松的光合能力。
关键词:兴安落叶松;不同光环境;叶绿素荧光;光系统Ⅱ
中图分类号: S791.222.01文献标志码: A
文章编号:1002-1302(2021)08-0149-04
收稿日期:2020-08-20
基金项目:黑龙江省科学院青年创新基金面上项目(编号:CXMS2019ZR01)。
作者简介:李金博(1990―),男,黑龙江哈尔滨人,硕士,研究实习员,主要从事森林土壤生态学研究。E-mail:505662355@qq.com。
通信作者:曾昭文,研究员,主要从事生态学研究。E-mail:zengzw64@163.com。
植物在不同光环境下的反应是复杂的,在不同遮阴程度下,植物个体可能以不同的策略来维持自身生长。强光或者弱光会降低植物的光化学效率,严重的胁迫可能会不可逆转地损害光合器官。近年来,国内外学者对不同植物光合生理方面的研究不断深入[1-3],肯定不同光照度是影响植物生长及存活的重要限制因子[4-6],通过测定光合和叶绿素荧光参数是能够描述植物在不同光照度胁迫下生理状态的重要指标。植物生长发育主要依靠其光合生理过程,而光照度更是直接影响植物的光合生理过程,但过程和机制十分复杂[7-8],因此研究不同光照度对植物光合生理过程的影响是研究植物生理变化机制的基础。
大兴安岭是我国面积最大的森林分布区,其中针叶林是大兴安岭地区生态系统的重要组成部分,兴安落叶松林是我国大兴安岭森林生态系统研究的重点区域[9-10]。兴安落叶松(Larix gmelinii)屬于松科落叶松属的一个品种,是大兴安岭林区最为重要的树种之一。兴安落叶松是强喜光树种,且有很高的经济价值,对维持生态平衡、涵养水源等方面具有极大的促进作用[9]。国内的大量学者已开展对兴安落叶松群落温室气体排放和土壤微生物方面的研究[10],那么在针对个体兴安落叶松生长过程中各外部环境因子对其生长有怎样的影响,尤其针对不同光环境下对其个体生长过程的影响研究较少。本试验通过分析不同遮阴程度下兴安落叶松的生理特性及光合能力,研究在不同光环境影响下兴安落叶松的生长情况,为兴安落叶松的栽培和生长管理提供理论依据。
1 材料与方法
1.1 试验材料与处理
试验于2019年8月在黑龙江呼中国家级自然保护区(122°42′14″~123°18′05″ E,51°17′42″~51°56′31″ N)进行,试验材料为兴安落叶松。利用遮阴网进行遮阴,用光强测定仪测定,设置光照度分别为100%(CK)、70%、40%、10%,并且利用Li-6400光合测定系统(Licor公司,美国)探头进行光照度的测定。
1.2 测定项目和方法
生长参数测定:选择各处理中生长相对一致(三年生)的兴安落叶松测量单株叶片数,测量兴安落叶松幼苗主干上倒数第2~3张完全展开叶的叶片长度和叶片宽度,并计算其叶片面积,公式为叶长×叶宽×0.634 5,其中0.634 5为叶面积指数;每个处理各收获长势均匀的5株待测植株,根系洗净,分别将根和地上部105 ℃杀青30 min、60 ℃烘干 30 h 至恒质量后称其干质量,即得到地下生物量和地上生物量,并计算总生物量(地下生物量+地上生物量),胸径测量采用软尺测量[11]。
对兴安落叶松叶片叶绿素含量和叶绿素荧光参数的测定:叶绿素含量利用CCM-200型叶绿素仪(OPTI-SCIENCES,美国)测定,以叶绿素仪的读数SPAD值作为相对叶绿素含量。
光合气体交换参数的测定:选兴安落叶松新生枝条上倒数第2张完全展开叶,利用Li-6800光合测定系统(Licor公司,美国)将光照度(PFD)设定为 8 000 lx,分别测定对照和不同光照度处理下兴安落叶松叶片的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)等参数。光合气体交换参数测定时气路用空气缓冲瓶连接大气,大气CO2浓度约为390~410 μL/L,每个处理测定10次重复。
叶绿素荧光参数的测定:将兴安落叶松新梢倒数第3张或第4张叶片利用暗适应夹进行0.5 h暗适应后采用便携式脉冲调制荧光仪FMS-2(Hansatch公司,英国)参照张治安等的方法[12]测定初始荧光(Fo)、光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm)、电子传递速率(ETR)、光化学淬灭系数(qP)、非光化学淬灭(NPQ)等,各处理均测定3次重复。
快相叶绿素荧光动力学曲线的测定:选择顶端第2张完全展开叶片,进行30 min暗适应后利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100 max,捷克)测定各暗适应后叶片的OJIP曲线。OJIP曲线由3 000 μmol/(m2·s)的脉冲红光诱导,相对荧光强度的记录从10 μs开始至1 s结束。其中OJIP曲线上O、J、I、P点分别为0、2、30、 1 000 ms 对应的时刻,L和K点分别表示0.15、0.30 ms对应的时刻。
1.3 数据处理方法
运用Excel 2003和SPSS 22.0软件进行数据统计分析,采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果与分析
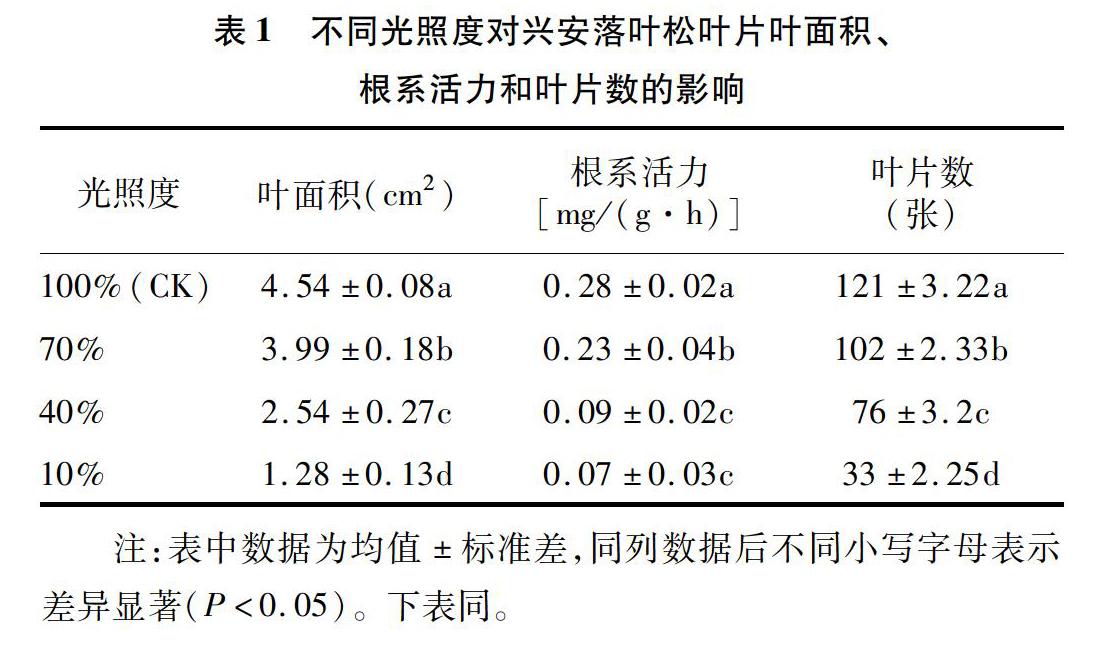
2.1 不同光照度对兴安落叶松叶面积、根系活力和叶片数的影响
由表1可知,随着遮阴程度的增加,兴安落叶松叶面积均呈下降趋势。在遮阴处理时,兴安落叶松叶面积均显著低于对照,说明不同光照度对兴安落叶松叶面积的影响较大。在光照度为40%时,兴安落叶松根系活力与光照度为10%时差异不显著。在光照度为70%、40%和10%时,与对照相比兴安落叶松叶片数表现为显著下降,分别下降了15.7%、37.2%和72.7%。
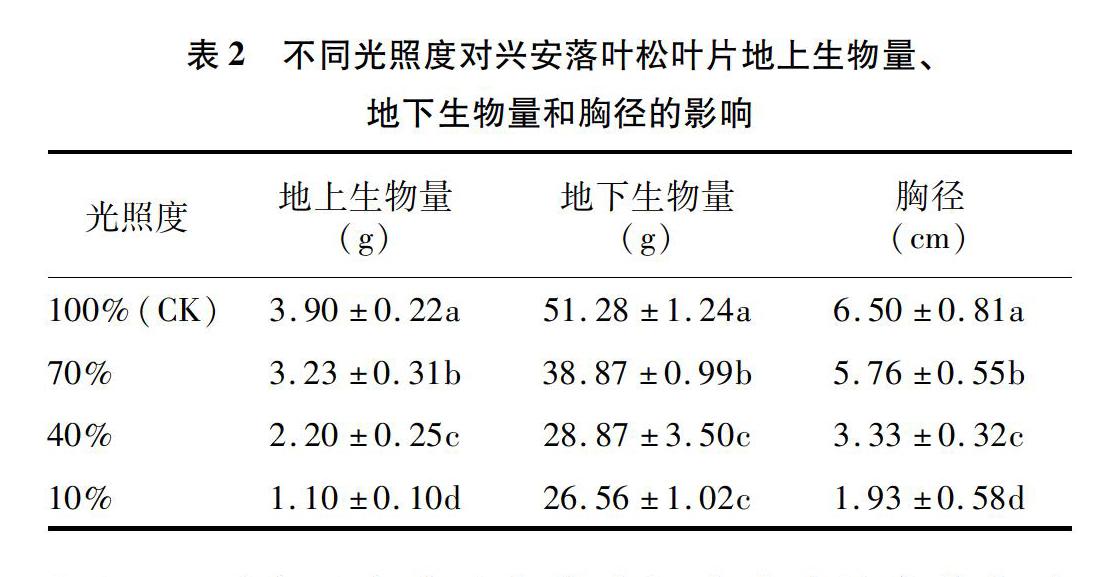
2.2 不同光照度对兴安落叶松叶片地上生物量、地下生物量和胸径的影响
从表2可以看出,兴安落叶松叶片地上生物量随胁迫遮阴程度增加呈下降趋势。在光照度为70%时,兴安落叶松叶片地上生物量含量与对照处理差异显著。地下生物量表现出与地上生物量相同的趋势。兴安落叶松的胸径随着遮阴程度的增加呈现下降的趋势,与光照度为70%时相比,光照度为10%时降低了66.5%。
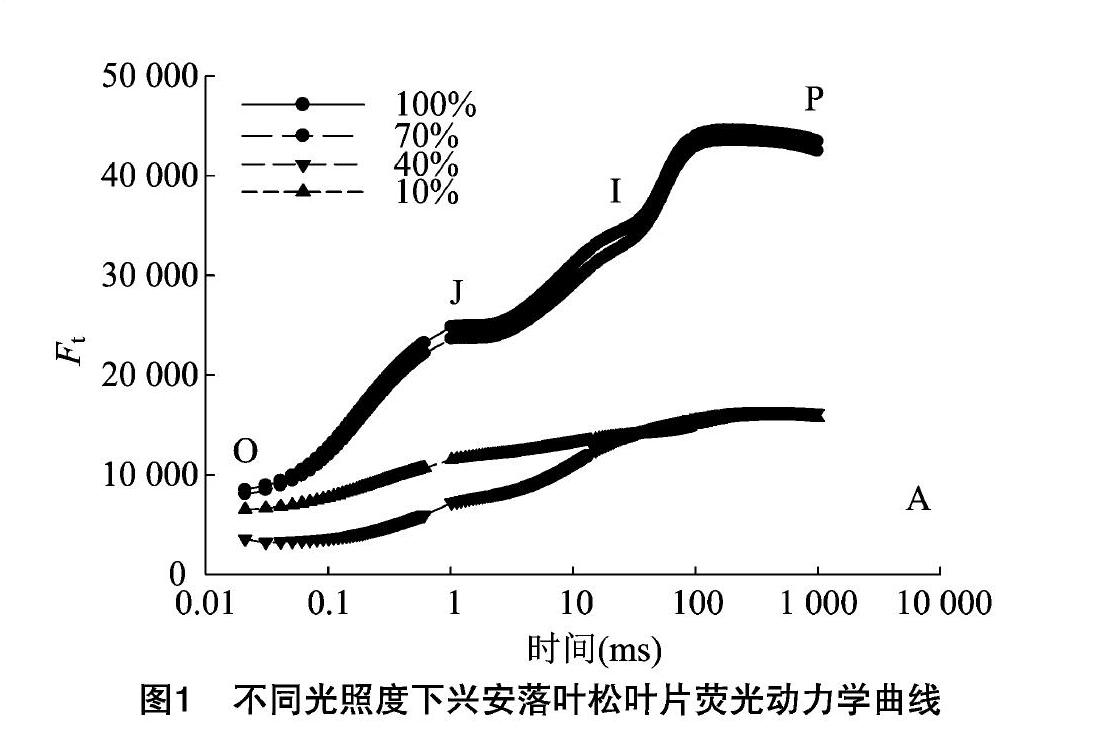
2.3 不同光照度对兴安落叶松叶片叶绿素荧光动力学曲线的影响
由图1可以看出,不同光照度下兴安落叶松叶片叶绿素动力学曲线差异显著。在光照度为40%时,与对照相比差异明显,当光照度处理为70%和100%时兴安落叶松叶片叶绿素动力学曲线相似。
2.4 不同光照度对兴安落叶松叶片光合气体交换参数的影响
由图2可见,随着光照度的减弱,兴安落叶松叶片的净光合速率(Pn)均呈明显下降趋势,在光照度为70%和40%时,兴安落叶松叶片Pn分别显著低于对照15.46%和56.29%。兴安落叶松叶片的气孔导度(Gs)和蒸腾速率(Tr)变化趋势与Pn相似,在光照度为10%时,兴安落叶松叶片的Gs和Tr均急剧降低。
2.5 不同光照度对兴安落叶松叶片PSⅡ最大光化学效率(Fv/Fm)和电子传递速率(ETR)的影响
由图3可以看出,兴安落叶松叶片的Fv/Fm和ETR随着光照度的减弱均呈降低趋势,且ETR的降低幅度大于Fv/Fm。在光照度为40%时,兴安落叶松叶片Fv/Fm与光照度为70%时差异不显著,但随着遮阴程度的增加,光照度为10%时兴安落叶松叶片的Fv/Fm和ETR均呈显著降低趋势,与对照相比分别低于48.94%和72.98%。
2.6 不同光照度對兴安落叶松叶片光化学淬灭系数(qP)、非光化学淬灭(NPQ)的影响
由图4-A可以看出,随着光照度的减弱,兴安落叶松叶片的qP呈显著降低趋势,在光照度为70%时,兴安落叶松叶片的qP较对照显著降低13.32%。由图4-B可以看出,兴安落叶松叶片的NPQ随着光照度的减弱整体呈增加趋势,在光照度为40%时,兴安落叶松叶片的NPQ较对照显著升高47.06%。
3 讨论与结论
植物幼苗由于受到不同光强的影响,叶片的生长会受到较大的影响,从而进一步影响植物的生长,植物的叶面积和根系活力可以反映植物应对外界环境的表现[13-14]。本试验中,在光照度为70%和40%时,兴安落叶松的叶面积显著低于对照,说明遮阴对兴安落叶松叶面积的影响较大。叶片数作为重要的生长指标,在植物生产生长中有着至关重要的作用。在光照度为70%时,兴安落叶松能维持较高的叶面积、根系活力和叶片数,而光照度为40%和10%时,叶面积、根系活力、叶片数、地上生物量、地下生物量和胸径下降幅度均较大,遮阴对兴安落叶松的生长产生极大的影响。
光合作用是植物有机物质积累、生长发育的基础,受植物本身生理特性和环境因素的共同影响,植物光合能力的高低是反映植物生长能力的重要指标[12]。本试验中,随着遮阴程度的增加,兴安落叶松叶片的Gs和Tr均呈显著降低趋势,即在遮阴作用下植物叶片同化能力的降低除了有气孔限制因素外,非气孔因素也会限制叶片的光合作用[15]。本研究结果表明,随着遮阴程度的增加,兴安落叶松叶片Pn均呈显著降低趋势,并且伴随着Gs和Tr的降低,遮阴处理导致兴安落叶松叶片光合碳同化能力降低的原因直接与气孔导度降低有关,这与前人的研究结果[16-18]一致。但随着遮阴程度的增加,Pn的降低幅度明显大于Gs和Tr,特别是在光照度为40%和10%时,兴安落叶松叶片的Pn仍随着遮阴程度的增加呈线性降低趋势,并且Gs和Tr变化趋势较为一致。这说明在光照度为40%和10%时,兴安落叶松叶片的Pn主要受气孔因素的限制。
遮阴处理下光合作用受到抑制[19-21],由于涉及PSⅡ反应中心的生化过程受到干扰,导致电子的产生和利用之间的不平衡,从而导致电子传输率的降低。利用叶绿素荧光技术分析不同程度遮阴处理下兴安落叶松叶片光合指标对不同遮阴程度的响应。结果表明,不同遮阴下兴安落叶松叶片叶绿素动力学曲线差异显著。在光照度为40%和10%时,与对照处理(100%)差异显著。随着遮阴程度加大,兴安落叶松叶片的Fv/Fm、ETR和qP均显著降低,说明在遮阴处理下,叶片光合碳同化能力降低是导致兴安落叶松PSⅡ功能降低的原因,其主要过程包括PSⅡ反应中心光化学活性的降低和电子传递的受阻等。
综上所述,遮阴不仅会导致兴安落叶松根系活力下降,叶面积增长缓慢和叶片数量降低,而且还会导致兴安落叶松地上生物量和地下生物量降低,并会明显抑制兴安落叶松叶片的净光合速率和PSⅡ光化学活性,从而导致兴安落叶松叶片光能吸收和利用能力的改变。
参考文献:
[1]Gosling S N,Arnell N W. A global assessment of the impact of climate change on water scarcity[J]. Climatic Change,2016,134(3):371-385.
[2]Ravi I,Uma S,Vaganan M M,et al. Phenotyping bananas for drought resistance[J]. Frontiers in Physiology,2013,4(9):1-9.
[3]Nichols S N,Hofmann R W,Williams W M. Physiological drought resistance and accumulation of leaf phenolics in white clover interspecific hybrids[J]. Environmental and Experimental Botany,2015,119:40-47.
[4]Liu Y,Li S Q,Chen F,et al. Soil water dynamics and water use efficiency in spring maize (Zea mays L.) fields subjected to different water management practices on the Loess Plateau,China[J]. Agricultural Water Management,2010,97(5):769-775.
[5]Cheng D D,Zhang Z S,Sun X B,et al. Photoinhibition and photoinhibition-like damage to the photosynthetic apparatus in tobacco leaves induced by Pseudomonas syringae pv. Tabaci under light and dark conditions[J]. BMC Plant Biology,2016,16(1):29.
[6]Hu Y B,Sun G Y,Wang X C. Induction characteristics and response of photosynthetic quantum conversion to changes in irradiance in mulberry plants[J]. Journal of Plant Physiology,2007,164(8):959-968.
[7]Mitsuya S,Takeoka Y,Miyake H. Effects of Sodium chloride on foliar ultrastructure of sweet potato (Ipomoea batatas Lam.) plantlets grown under light and dark conditions in vitro[J]. Journal of Plant Physiology,2000,157(6):661-667.
[8]Skotnica J,Matousková M,Naus J,et al. Thermoluminescence and fluorescence study of changes in Photosystem Ⅱ photochemistry in desiccating barley leaves[J]. Photosynthesis Research,2000,65(1):29-40.
[9]Efeoglu B,Ekmekci Y,Cicek N. Physiological responses of three maize cultivars to drought stress and recovery[J]. South African Journal of Botany,2009,75(1):34-42.
[10]王 飛. 兴安落叶松天然林碳密度与碳平衡研究[D]. 呼和浩特:内蒙古农业大学,2013:103-104.
[11]白英辰,陈 晶,康峰峰,等. 模拟氮沉降下不同凋落物处理对太岳山华北落叶松林土壤呼吸的影响[J]. 中南林业科技大学学报,2017,37(4):92-99.
[12]张治安,张美善,蔚荣海. 植物生理学实验指导[M]. 北京:中国农业出版社,2004:138-145.
[13]骆建霞,史燕山,吕 松,等. 3种木本地被植物耐盐性的研究[J]. 西北农林科技大学学报(自然科学版),2005,33(12):121-124,129.
[14]Dias M C,Brüggemann W. Water-use efficiency in Flaveria species under drought-stress conditions[J]. Photosynthetica,2010,48(3):469-473.
[15]Sofo A,Dichio B,Montanaro G,et al. Photosynthetic performance and light response of two olive cultivars under different water and light regimes[J]. Photosynthetica,2009,47(4):602-608.
[16]李海波,陈温福,李全英. 盐胁迫下水稻叶片光合参数对光强的
响应[J]. 应用生态学报,2006,17(9):1588-1592.
[17]Fernandez M D. Changes in photosynthesis and fluorescence in response to flooding in emerged and submerged leaves of Pouteria orinocoensis[J]. Photosynthetica,2006,44(1):32-38.
[18]Chaves M M,Flexas J,Pinheiro C. Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J]. Annals of Botany,2009,103(4):551-560.
[19]Yan K,Chen P,Shao H,et al. Responses of photosynthesis and photosystemⅡ to higher temperature and salt stress in sorghum[J]. Journal of Agronomy and Crop Science,2012,198(3):218-226.
[20]Liu N Y,Ko S S,Yeh K C,et al.Isolation and characterization of tomato Hsa32 encoding a novel heat-shock protein[J]. Plant Science,2006,170(5):976-985.
[21]Zlatev Z. Drought-induced changes in Chlorophyll fluorescence of young wheat plants[J]. Biotechnology & Biotechnological Equipment,2009,23(S1):437-441.

