淫羊藿苷脱糖产物制备及体外抗肿瘤活性
许晓蒙,孙发鑫,冯莹莹,郭文娜,袁 梦,许 卉
(烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
淫羊藿是典型的补阳中药,始载于《神农本草经》,为小檗科植物淫羊藿(EpimediumbrevicornumMaxim.)、箭叶淫羊藿(Epimediumsagittatum(Sieb.et Zucc.)Maxim.)、柔毛淫羊藿(EpimediumpubescensMaxim.)或朝鲜淫羊藿(EpimediumkoreanumNakai)的干燥叶[1]。淫羊藿味辛、甘,性温,归肝、肾经,有补肾阳、强筋骨、祛风湿的功效,具有抗炎、抗氧化、抗衰老、抗抑郁、降血糖、提高免疫力等药理活性,广泛用于阳痿遗精、筋骨痿软、风湿痹痛、麻木拘挛等症[2-5]。现代化学与生物学研究发现,天然异戊二烯基黄酮醇类成分是淫羊藿的主要功效成分,其中以淫羊藿苷(icariin, ICA)天然含量最高,各版《中国药典》都规定其为淫羊藿及相关制品的质量控制指标成分[6-8]。
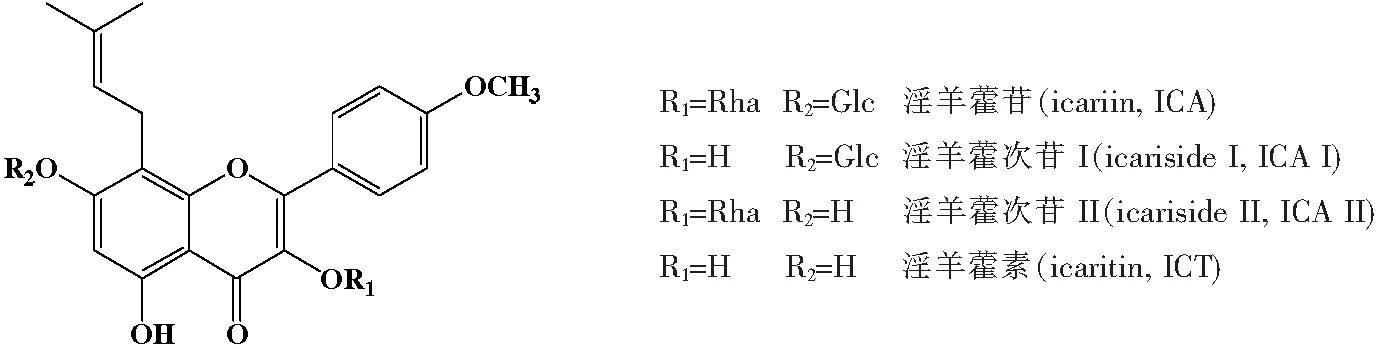
图1 淫羊藿苷相关化合物的化学结构
ICA是一种天然黄酮苷,极易水解生成淫羊藿次苷I(icariside I, ICA I)、淫羊藿次苷II(icariside II, ICA II)和淫羊藿素(icaritin, ICT)等脱糖产物,是ICA发挥生理活性的效应物质基础[9-11]。研究发现,淫羊藿苷及其代谢产物能够抑制人肺癌细胞的体外增殖,其机制与诱导肿瘤细胞S期阻滞和细胞凋亡有关[12]。在相关品种的质量控制中,淫羊藿苷脱糖产物相应受到重视。现行《中国药典》对于羊脂油炒制的炙淫羊藿饮片,即在“含量测定”项下即明确规定:本品按干燥品计算,含淫羊藿苷和宝藿苷I(baohuoside I,即ICA II)的总量不得少于0.60%[1]。目前尚缺少针对ICA及其脱糖产物生物活性差异特性比较的系统研究。
本研究以天然含量丰富的ICA为原料,制备系列脱糖产物ICA I、ICA II和ICT,基于稳定、可控的肿瘤细胞体外增殖模型,评价ICA及其脱糖产物对几种常见、高发人源肿瘤细胞的体外增殖抑制活性,定量比较这类成分的抗肿瘤活性差异,并筛选敏感作用瘤株,为中药淫羊藿及其制品的质量控制和开发应用提供实验依据。
1 材料与方法
1.1 仪器与试剂
超净工作台(北京东联哈尔仪器制造有限公司),CO2培养箱(Thermo),离心机(Eppendorf),CKX31型倒置显微镜(菲律宾奥林巴士公司),酶标仪(DNM-9602 MICROPLATE READER),旋转蒸发仪(巩义市宏华仪器设备工贸有限公司),恒温加热磁力搅拌器(郑州长城科工贸有限公司),Aglient 1100 型高效液相色谱仪(美国安捷伦公司)。
淫羊藿苷(上海茁采生物科技有限公司,批号:20190506),淫羊藿次苷I、淫羊藿次苷II、淫羊藿素对照品(中国食品药品检定研究院),阿霉素(DOX,北京偶合科技有限公司),人肝癌细胞SMMC-7721、人乳腺癌细胞MCF-7、人肺癌细胞A-549、人结肠癌细胞HT-29(ATCC,中科院上海细胞库),DMEM培养基(HyClone Laboratories),胎牛血清(NQBB International Biological Corporation),青霉素-链霉素溶液、胰酶消化液(Beyotime Biotechnology Co.Ltd),MTT、DMSO(Sigma-Aldrich),甲醇、乙腈(Fisher),超纯水(实验室自制),ODS(青岛邦凯高新技术材料有限公司),蜗牛酶(上海萌桠生物科技有限公司),其他试剂均为国产分析纯。
1.2 脱糖产物制备与测定
1.2.1 ICA I制备 称取ICA 100 mg,置100 mL圆底烧瓶中,加适量无水乙醇溶解;加5%硫酸25 mL,置50 ℃水浴中搅拌反应,TLC监测。至反应结束后,加适量去离子水稀释反应液,离心(9000 r·min-1, 10 min),去上清,下层沉淀加水洗至中性,行ODS柱色谱分离纯化,以CH3OH-H2O混合溶剂进行梯度洗脱,HPLC监测,收集目标馏分,浓缩干燥,得黄色固体(58.9 mg)。
1.2.2 ICA II制备 称取ICA 100 mg,置100 mL圆底烧瓶中,加适量DMSO溶解,加入100 mL醋酸-醋酸钠缓冲溶液(0.1 molL-1,pH 6.0)、100 mg蜗牛酶,置37 ℃水浴中搅拌反应,TLC监测。至反应结束后,离心(9000 r·min-1,10 min),去上清,取下层沉淀加甲醇溶解后过滤,滤液浓缩干燥后进行重结晶纯化(CH3OH-H2O),得黄色针状晶体(51.2 mg)。
1.2.3 ICT制备 称取ICA 100 mg,置100 mL圆底烧瓶中,加入2.5 mL硫酸溶液(5 mol·L-1,加9 mL 80%冰醋酸溶液,至于70 ℃水浴中搅拌反应,TLC监测。反应结束后离心(9000 r·min-1,10 min),去上清,沉淀以10倍超纯水洗至中性,过滤后ODS柱色谱分离纯化,以CH3OH-H2O混合溶剂进行梯度洗脱,HPLC监测,收集目标馏分,浓缩干燥,得黄色固体(24.1 mg)。
1.2.4 HPLC测定 色谱分离采用Agilent-TC-C18色谱柱(250 mm×4.6 mm,5 μm),乙腈-水混合溶剂梯度洗脱(0~5 min,35∶65;5~10 min,35∶65→70∶30;10~45 min,70∶30),柱温30 ℃,流速1 mL·min-1,检测波长270 nm;待测试样加流动相制成20~100 μg·mL-1的溶液进样测定,进样量20 μL。
1.3 体外细胞增殖活性测定
1.3.1 样品制备 将ICA、ICA I、ICAII和ICT溶于DMSO(细胞培养级)中,分别配制成作用浓度为0.1、0.3、1.0、3.0、10.0和30.0 μmol·L-1的DMSO溶液,-20 ℃冰箱储存备用。
1.3.2 细胞培养 将人源肿瘤细胞(SMMC-7721、MCF-7、HT-29、A-549)细胞于37 ℃、5% CO2细胞培养箱中培养,培养介质为含10%胎牛血清、1%青霉素、链霉素的DMEM培养液。1~2 d传代一次,取对数生长期细胞,备用。
1.3.3 MTT法测定 取对数生长期的肿瘤细胞,制成细胞悬液,按2×104个/mL的密度接种至96孔板,每孔200 μL,于5% CO2、37 ℃细胞培养箱中孵育24 h后,加不同浓度试验药物(0.1、0.3、1、3、10、30 μmol·L-1)培养24 h,于每孔中加入10 μL MTT(终浓度500 μg/mL),继续培养4 h(5% CO2、37 ℃),弃去上清,加入DMSO 150 μL,振摇至蓝紫色甲瓒结晶完全溶解,以630 nm为参比波长,用酶标仪测定570 nm处的吸光度A570。试验药物各浓度均设置3平行复孔,同时进行空白组测定,并以阿霉素(DOX)作为阳性对照药,浓度为(0.1、0.3、1、3、10、30 μmol·L-1)。根据吸光度测定结果,按(1-实验组平均A570值/空白对照组平均A570值)×100%计算细胞生长抑制率(%),并经SPSS 25.0回归分析,计算得抑制作用的半数抑制浓度(IC50)。
2 结 果
2.1 脱糖产物制备结果
以ICA为原料,通过不同反应和纯化工艺条件,制备获得三种脱糖产物。经与标准品在相同色谱条件下的HPLC图谱对比分析(图2),确证所制得的化合物分别为ICA脱除C-3-鼠李糖或C-7-葡萄糖所得的单脱糖产物ICA I、ICA II,以及同时脱除C-3-鼠李糖和C-7-葡萄糖所得的双脱糖产物,即淫羊藿苷的苷元ICT。
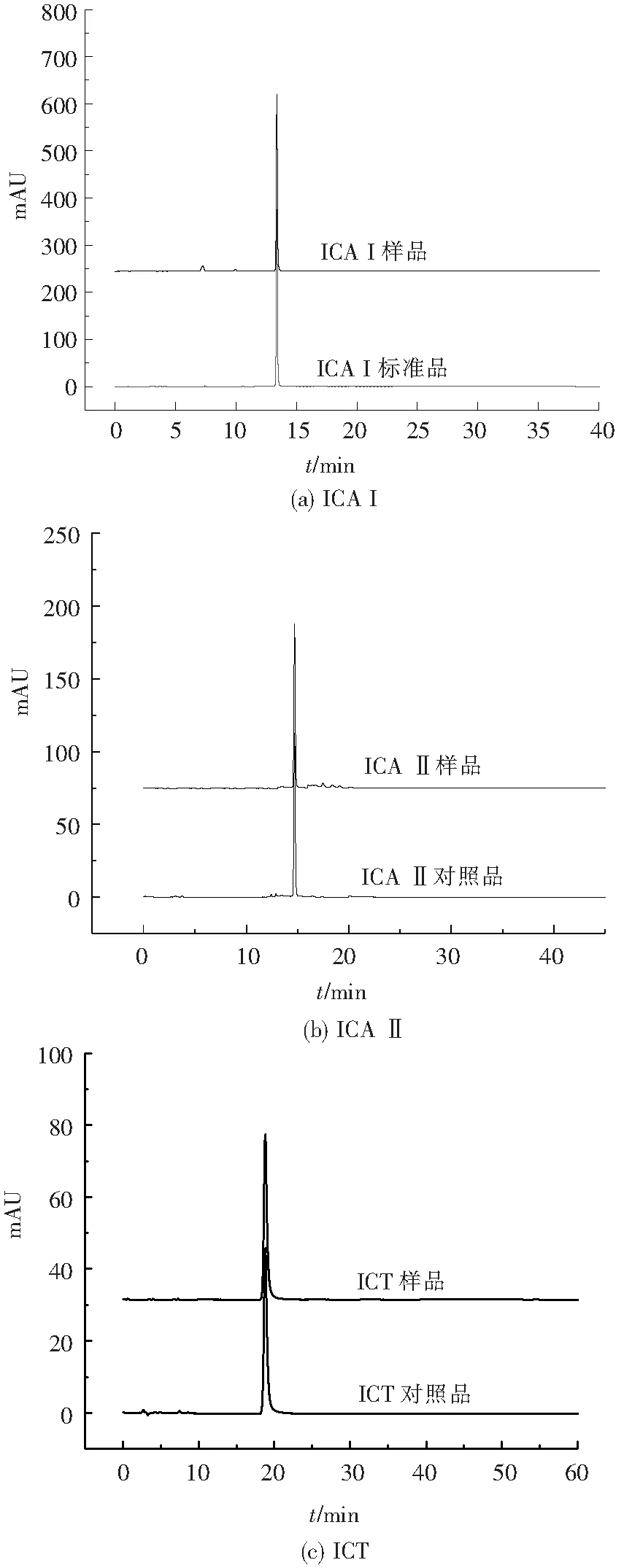
图2 三种脱糖产物纯度检查的HPLC图谱
根据HPLC分析结果,在目标产物结构确证基础上,进一步测定各脱糖产物的纯度和收率,见表1。结果表明,利用本研究建立的脱糖反应及纯化工艺条件,能够制备满足生物活性评价需要的淫羊藿苷脱糖产物。

表1 ICA脱糖产物制备收率及纯度检查结果
2.2 淫羊藿黄酮对肿瘤细胞体外增殖抑制作用
选择四种常见、高发的人源肿瘤细胞开展体外实验,包括人肝癌细胞SMMC-7721、肺癌细胞A-549、结肠癌细胞HT-29和乳腺癌细胞MCF-7细胞株,同时评价了ICA及其单脱糖ICA I、ICA II和双脱糖产物ICT四种黄酮类成分的体外抑制作用强度及量效关系。
2.2.1 ICA及其脱糖产物对四种肿瘤细胞的体外增殖抑制作用 终浓度为0.1~30 μmol·L-1的ICA、ICA I、ICA II、ICT作用24 h后,对四种肿瘤细胞的平均增殖抑制率见图3所示。除 ICA以外,ICA I、ICA II和ICT对四种肿瘤增殖的抑制率均具有浓度依赖性(P<0.05)。
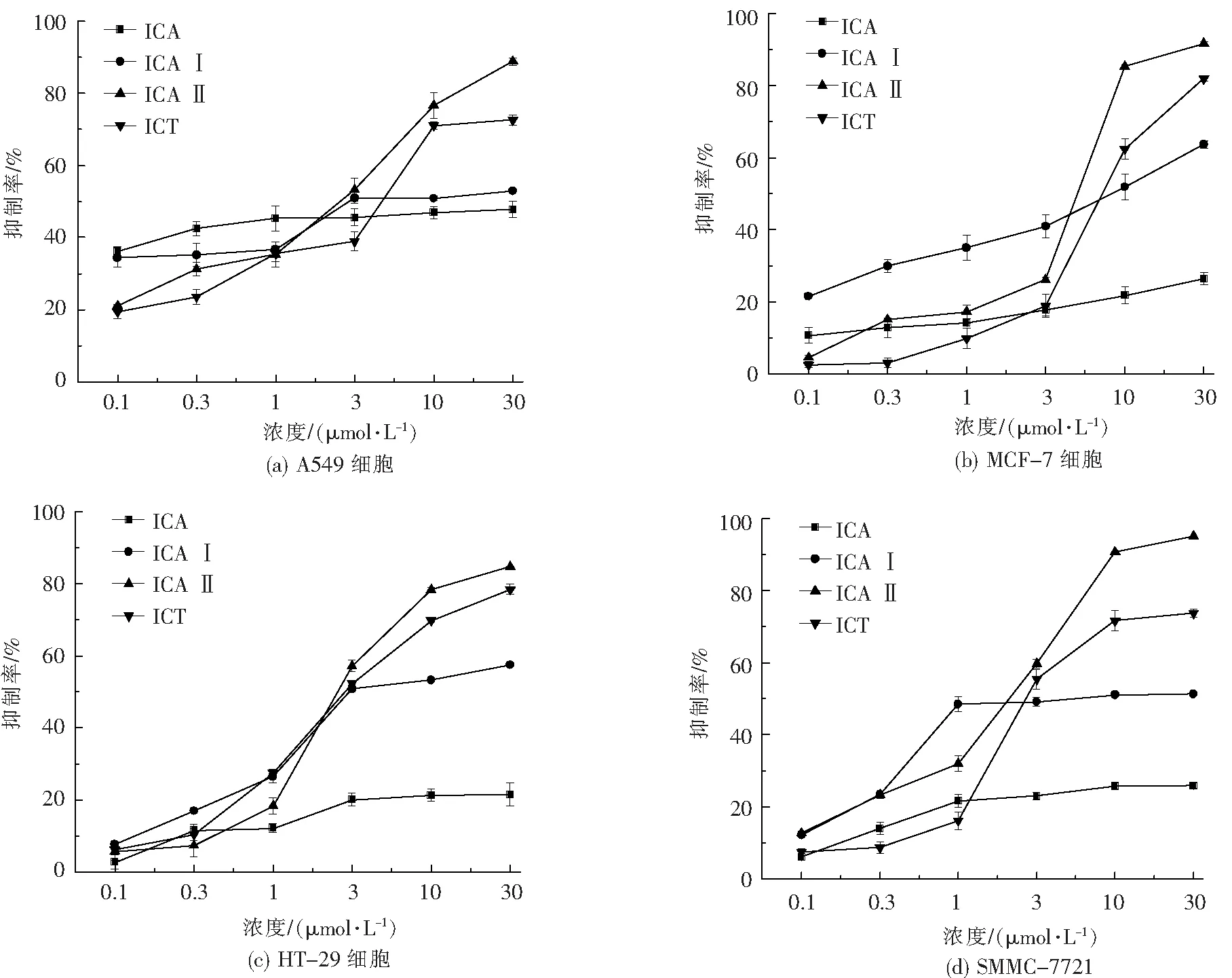
图3 ICA及ICA脱糖产物对四种肿瘤细胞体外增殖的影响
2.2.2 三种脱糖产物对四种肿瘤细胞IC50值 计算ICA I、ICA II和ICT对四种肿瘤细胞的IC50值,结果见表2。
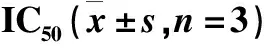
表2 ICA I、ICA II、ICT对人源肿瘤细胞体外增殖抑制作用的
由表2可见,三种脱糖产物中,ICA II对四种肿瘤细胞的IC50值均为最低,表明其增殖抑制效果最显著。此外,从ICA II对四种肿瘤细胞的IC50值对比可见,ICA II对人肝癌细胞SMMC-7721的IC50值最低,为1.26 μmol·L-1,表明SMMC-7721对ICA II的抑制作用最为敏感。由于ICA在0.1~30 μmol·L-1浓度范围内对四种肿瘤细胞最大抑制率均小于50 %,故无法计算IC50值。
3 讨 论
具有化学结构多样性的天然产物始终是现代药物发现的重要来源,多达半数以上的临床药物与天然产物有关,如青蒿素、紫杉醇、喜树碱等。尤其在恶性肿瘤治疗领域,传统中药的功效成分因具有高效、低毒、不易产生耐药性等临床优势,日益引起研究关注[13-14]。利用天然活性成分为先导化合物衍生出低毒、高效的生物活性物质,在新药研发领域发挥着巨大作用。现有研究发现,淫羊藿苷及其脱糖衍生物具有潜在抗肿瘤潜力[15],值得开展进一步的深入评价。本研究基于稳定、可控的肿瘤细胞体外增殖抑制模型,对包括脱糖代谢产物在内的淫羊藿黄酮类化合物进行抗肿瘤活性比较,并筛选发现敏感瘤株,以期为这类天然产物的合理开发应用以及淫羊藿相关产品的科学质量控制奠定基础。
传统中药学认为淫羊藿味辛、甘,性温,归肝、肾经。据文献报道,味辛、甘,性温,归肝经类中药普遍具有抗肿瘤的功效[16]。刘铁汉等[17]对大鼠口服ICA后的排泄物进行了检测,发现ICA在大鼠肠道环境中转化为ICA II后吸收入血,ICA II对人乳腺癌细胞MCF-7和人肝癌细胞HepG2的抗肿瘤活性优于其他黄酮类成分。本研究结果表明ICA II对人肺癌细胞(A-549)、乳腺癌细胞(MCF-7)、结肠癌细胞(HT-29)和肝癌细胞(SMMC-7721)的抗肿瘤活性明显优于其他三种黄酮类物质,并通过比较ICA II对人肺癌细胞(A-549)、乳腺癌细胞(MCF-7)、结肠癌细胞(HT-29)和肝癌细胞(SMMC-7721)的抗肿瘤活性,发现ICA II对人肝癌细胞(SMMC-7721)具有更显著的抗肿瘤作用。淫羊藿兼具保肝、护肝等功效,因此从传统中药中开发肝癌治疗新药角度来看,ICA II具有潜在的抗肿瘤药用价值。
4 结 论
本研究以淫羊藿苷为原料合成了淫羊藿次苷I和淫羊藿次苷II,比较了淫羊藿苷及其三种脱糖代谢物之间的抗肿瘤活性差异,并筛选敏感肿瘤细胞株,最终确定淫羊藿次苷II相较于淫羊藿苷、淫羊藿次苷I、淫羊藿素对肿瘤细胞的增殖抑制作用最强,且筛选出SMMC-7721为最敏感细胞株,为淫羊藿黄酮类化合物的抗肿瘤开发应用提供了实验依据。

