海绵共附生真菌Penicillium sp.YZ-7的次级代谢产物
王鲁敏,肖翠平
(烟台大学化学化工学院,山东 烟台 264005)
海绵(Marine sponge)是地球上最原始的无脊椎动物,其独特的空腔结构和滤食性生活方式,使其拥有“微生物资源库”的美誉[1]。近年来,越来越多的研究表明从海绵中分离得到活性物质需要微生物参与,有的甚至由微生物直接产生[2-4]。目前海洋微生物次级代谢产物已逐步形成系统的研究体系,从海洋微生物中分离得到的化合物数量正在急剧增加[5]。近年来研究人员从海洋真菌中分离得到了大量结构新颖的化合物,这些化合物往往具有广泛的生物活性,如:抗病毒[6]、抗肿瘤[7]、抗污损[8]等。本文以分离自黄渤海潮间带繁茂膜海绵(Hymeniacidonperleve)的一株共附生真菌Penicilliumsp.YZ-7为研究对象,对其次级代谢产物进行分离纯化,分离得到9个化合物(结构式见图1),并以海洋污损细菌为抗污损活性筛选模型对化合物进行抗污损活性初步评价。
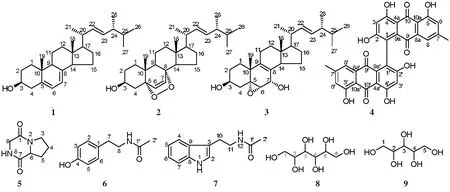
图1 化合物1—9的结构式
1 实验部分
1.1 仪器试剂
超导核磁共振波谱仪AVANCE III 500(德国Bruker公司;高分辨质谱仪P776(美国Waters公司);旋转蒸发仪R206(上海申生科技有限公司);ODS反相硅胶(日本YMC公司);Sephadex LH-20凝胶(美国GE公司);氘代试剂(Cambridge Isotope Laboratories, Inc.);其他有机试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 菌株分离与培养
分离鉴定:菌株YZ-7通过组织接种法分离自黄渤海潮间带繁茂膜海绵Hymeniacidonperleve,经ITS序列比对及形态学分析,确定种属为Penicilliumsp.。菌种保存于中国科学院烟台海岸带研究所生物学与生物资源利用重点实验室-80 ℃冰箱。
菌株培养:取适量冻存在-80 ℃的50%甘油中的菌种于装有20 mL培养基的50 mL三角瓶中,28 ℃摇床震荡培养48 h获得种子培养液。然后以1%的接种量转接到装有150 mL培养基的250 mL三角瓶中,28 ℃摇床震荡培养48 h。然后以0.001接种量接种到装有300 mL真菌培养基(培养基配方:蛋白胨5.0 g,酵母浸粉2.0 g,葡萄糖20.0 g,磷酸氢二钾1.0 g,氯化镁0.5 g,海水1000 mL,调节pH值至7~8)的1000 mL三角瓶中,共接种100瓶,于28 ℃静态培养30 d。
1.3 提取与分离
代谢物提取:培养结束后,过滤分别得到发酵液上清液和菌丝体。发酵液上清液用乙酸乙酯萃取3次,得到发酵液乙酸乙酯提取物;菌丝体用甲醇浸泡24 h,提取3次,得到菌体甲醇提取物。合并得到粗浸膏46.3 g。
代谢物分离:总粗提物经减压硅胶柱层析(100~200目),用石油醚-丙酮体系50∶1、10∶1、5∶1、2∶1、1∶1、1∶2和1∶5梯度洗脱,经TLC分析,合并为8个组分(组分A—H)。组分C(151.1 mg)经硅胶柱层析(石油醚∶乙酸乙酯=5∶1),得到2个亚组分C1和C2。其中,亚组分C1(36.5 mg)经硅胶柱层析,以二氯甲烷为洗脱剂洗脱得到化合物1(22.0 mg)。组分D(175.6 mg)经ODS反相硅胶柱层析(甲醇∶水=80∶20~100∶0,V/V),得到3个亚组分D1—D3。亚组分D1和D2经硅胶柱层析(石油醚∶乙酸乙酯=8∶3)得到化合物2(10.6 mg)和化合物3(15.2 mg)。组分E(105.1 mg)经ODS反相硅胶柱层析(甲醇∶水=70∶30~100∶0,V/V),再经过反复的硅胶柱层析(二氯甲烷∶丙酮=5∶1,石油醚∶乙酸乙酯=1∶2)最终得到化合物4(12.8 mg)。组分F(2.2 g)经ODS反相硅胶柱层析(甲醇∶水=60∶40~100∶0,V/V),得到3个亚组分F1、F2和F3。亚组分F1(1.2 g)经Sephadex LH-20凝胶柱层析(二氯甲烷∶甲醇=1∶1),得到2个次组分F11和F12。次组分F11和F22分别经硅胶柱层析(二氯甲烷∶乙酸乙酯=1∶1,二氯甲烷∶甲醇=40∶1)最终得到化合物5(12.6 mg)、化合物6(9.2 mg)和化合物7(15.0 mg)。组分H(1.6 g)经Sephadex LH-20凝胶柱层析(甲醇洗脱),得到2个亚组分H1和H2。H1和H2再经过硅胶柱层析(二氯甲烷∶甲醇=10∶1~1∶1梯度洗脱)最终得到化合物8(15.3 mg)和化合物9(18.6 mg)。
1.4 抗海洋污损细菌测试
将污损细菌菌株苏云金芽孢杆菌B.thuringiensis、叶氏假交替单胞菌P.elyakovii、铜绿假单胞菌P.aeruginosa接种于海水LB培养基中,37 ℃摇床活化24 h,然后将菌悬液稀释至106 CF/mL。采用滤纸片法[9]来半定量地对分离得到的化合物的抗菌活性进行筛选,样品用DMSO溶解,阴性对照组为DMSO,阳性对照组为氯霉素。每个滤纸片上的样品量为100 μg/片,每次3个平行,滤纸片直径6.0 mm。37 ℃生化培养箱培养24 h后用十字交叉法测量抑菌圈的大小。
2 结果与分析
2.1 化合物结构鉴定
化合物1:无色固体,ESI-MS:m/z396[M]+, 379[M-OH]+。1H-NMR(500 MHz, CDCl3):δH5.59(1H, m, H-6), 5.41(1H, m, H-7), 5.24(1H, dd,J=15.6, 7.8 Hz, H-23), 5.19(1H, dd,J=15.6, 7.8 Hz, H-22), 3.66(1H, m, H-3), 1.06(3H, d,J=6.6 Hz, H-21), 0.97(3H, s, H-19), 0.94(3H, d,J=6.8 Hz, H-28), 0.86(3H, d,J=7.1 Hz, H-27), 0.85(3H, d,J=7.2 Hz, H-26), 0.66(3H, s, H-18);13C-NMR(125 MHz, CDCl3):δC141.4(s, C-8), 139.8(s, C-5), 135.6(d, C-22), 132.0(d, C-23), 119.6(d, C-6), 116.3(d, C-7), 70.5(d, C-3), 55.7(d, C-17), 54.6(d, C-14), 46.3(d, C-9), 42.8(s, C-13), 40.8(d, C-24), 40.8(t, C-4), 40.4(d, C-20), 39.1(t, C-12), 38.4(t, C-1), 37.0(s, C-10), 33.1(d, C-25), 32.0(t, C-2), 28.3(t, C-16), 23.0(t, C-15), 21.1(t, C-11), 21.1(q, C-21), 20.0(q, C-26), 19.6(q, C-27), 17.6(q, C-28), 16.3(q, C-19), 12.1(q, C-18)。化合物1核磁数据与文献[10]对照基本一致,被鉴定为麦角甾醇,分子式为C28H44O。
化合物2:无色晶体,APCI-MS:m/z429[M+H]+。1H-NMR(500 MHz, CDCl3):δH6.52(1H, d,J=8.5 Hz, H-7), 6.26(1H, d,J=8.5 Hz, H-6), 5.24(1H, dd,J=15.3, 7.6 Hz, H-23), 5.16(1H, dd,J=15.3, 8.3 Hz, H-22), 3.98(1H, m, H-3), 1.02(3H, d,J=6.6 Hz, H-21), 0.93(3H, d,J=6.9 Hz, H-28), 0.90(3H, s, H-19), 0.85(3H, d,J=6.9 Hz, H-27), 0.83(3H, s, H-18), 0.83(3H, d,J=6.8 Hz, H-26);13C-NMR(125 MHz, CDCl3):δC135.4(d, C-6), 135.2(d, C-22), 132.3(d, C-23), 130.7(d, C-7), 82.2(s, C-5), 79.4(s, C-8), 66.4(d, C-3), 56.2(d, C-17), 51.7(d, C-14), 51.1(d, C-9), 44.6(s, C-13), 42.8(d, C-24), 39.7(d, C-20), 39.3(t, C-12), 37.0(s, C-10), 36.9(t, C-4), 34.7(t, C-1), 33.1(d, C-25), 30.1(t, C-2), 28.6(t, C-15), 23.4(t, C-11), 20.9(q, C-21), 20.6(t, C-16), 20.0(q, C-27), 19.6(q, C-26), 18.2(q, C-19),17.6(q, C-28), 12.9(q, C-18)。化合物2核磁数据与文献[11]对照基本一致,被鉴定为(22E,24R)-5α,8α-epidioxy-ergosta-6,22-dien-3β-ol,分子式为C28H44O3。
化合物3:白色固体,APCI-MS:m/z427[M-H]-。1H-NMR(500 MHz, CDCl3):δH5.22(2H, m, H-22 and 23), 4.25(1H, brs, H-7), 3.98(1H, m, H-3), 3.34(1H, d,J=2.7 Hz, H-6), 1.16(3H, s, H-19),1.04(3H, d,J=6.6 Hz, H-21), 0.94(3H, d,J=6.8 Hz, H-28), 0.86(3H, d,J=7.0 Hz, H-27), 0.84(3H, d,J=7.0 Hz, H-26), 0.61(3H, s, H-18);13C-NMR(125 MHz, CDCl3):δC135.6(d, C-22), 134.5(s, C-8), 132.0(d, C-23), 126.9(s, C-9), 68.6(d, C-3), 67.1(d, C-7), 65.6(s, C-5), 62.6(d, C-6), 53.7(d, C-17), 49.6(d, C-14), 42.8(d, C-24), 42.1(s, C-13), 40.4(d, C-20), 39.2(t, C-4), 38.0(s, C-10), 35.7(t, C-12), 33.1(d, C-25), 30.9(t, C-1), 30.2(t, C-2), 29.0(t, C-16), 23.8(t, C-15), 23.4(t, C-11), 22.8(q, C-19), 21.0(q, C-21), 20.0(q, C-27), 19.6(q, C-26), 17.6(q, C-28), 11.3(q, C-18)。化合物3核磁数据与文献[12]对照基本一致,被鉴定为(22E,24R)-5α,6α-epoxy-ergosta-8,22-dien-3β,7α-diol,分子式为C28H44O3。
化合物4:红色固体,EI-MS:m/z538[M]+。1H-NMR(500 MHz, 丙酮-d6):δH12.88(2×1H, s, 4,5-OH), 12.12(1H, s, 2-OH), 7.33(1H, s, H-6), 7.11(1H, s, H-8), 6.80(1H, s, H-3), 2.39(3H, s, 7-CH3);13C-NMR(125 MHz, 丙酮-d6):δC190.9(s, C-10), 182.1(s, C-9), 165.4(s, C-2), 164.1(s, C-4), 162.0(s, C-5), 148.5(s, C-7), 133.9(s, C-8a), 132.2(s, C-10a), 123.4(d, C-1), 122.7(d, C-6), 120.5(s, C-8), 113.4(s, C-9a), 110.0(s, C-4a), 107.6(d, C-3), 21.0(q, 7-CH3)。化合物4核磁数据与文献[13]对照基本一致,被鉴定为醌茜素,分子式为C30H18O10。
化合物6:无色晶体。1H-NMR(500 MHz, CD3OD):δH7.04(2H, d,J=8.6 Hz, H-2,6), 6.73(2H, d,J=8.6 Hz, H-3,5), 3.35(2H, t,J=7.5 Hz, H-7), 2.70(2H, t,J=7.5 Hz, H-8), 1.92(3H, s, H-2′);13C-NMR(125 MHz, CD3OD):δC171.8(s, C-1′), 155.5(s, C-4), 129.8(s, C-1), 129.3(d, C-2,6), 114.8(d, C-3,5), 41.0(t, C-7), 34.2(t, C-8), 21.1(q, C-2′)。化合物6核磁数据与文献[15]对照基本一致,被鉴定为N-乙酰基酪胺,分子式为C10H13NO2。
化合物7:无色晶体。1H-NMR(500 MHz, CDCl3):δH8.24(1H, brs, 1-NH), 7.63(1H, d,J=7.7 Hz, H-4), 7.41(1H, d,J=8.2 Hz, H-7), 7.24(1H, td,J=8.1, 1.1 Hz, H-6), 7.16(1H, td,J=8.0, 1.0 Hz, H-5), 7.06(1H, d,J=2.3 Hz, H-2), 3.63(2H, dd,J=12.7, 6.6 Hz, H-11), 3.00(2H, t,J=6.7 Hz, H-10), 1.95(3H, s, H-2′);13C-NMR(125 MHz, CDCl3):δC170.1(s, C-1′), 136.4(s, C-8), 127.4(s, C-9), 122.2(d, C-2), 122.0(d, C-6), 119.5(d, C-5), 118.7(d, C-4), 113.0(s, C-3), 111.3(d, C-7), 39.8(t, C-11), 25.3(t, C-10), 23.4(q, C-2′)。化合物7核磁数据与文献[16]对照基本一致,被鉴定为N-乙酰基色胺,分子式为C12H14N2O。
化合物8:无色晶体。1H-NMR(500 MHz, DMSO-d6):δH4.40(2H, d,J=5.6 Hz, C2,5—O—H), 4.32(2H, t,J=5.7 Hz, C1,6—O—H), 4.13(2H, d,J=7.0 Hz, C3,4—O—H);13C-NMR(125 MHz, DMSO-d6):δC71.8(d, C-3, 4), 70.2(d, C-2, 5), 64.3(t, C-1, 6)。化合物8核磁数据与文献[17]对照基本一致,被鉴定为己六醇,分子式为C6H14O6。
化合物9:无色晶体。1H-NMR(500 MHz, DMSO-d6):δH4.48(1H, d,J=5.5 Hz,), 4.44(1H, t,J=5.4 Hz), 4.34(1H, t,J=5.8 Hz), 4.22(1H, d,J=6.3 Hz), 4.15(H, d,J=7.4 Hz);13C-NMR(125 MHz, DMSO-d6):δC71.9(d, C-3), 71.0(d, C-2), 70.6(d, C-4), 64.2(t, C-1), 63.4(t, C-5)。化合物9核磁数据与文献[18]对照基本一致,被鉴定为木糖醇,分子式为C5H12O5。
2.2 抗海洋污损细菌活性评价
按照实验部分1.4所述方法对分离得到的化合物1—9进行抗海洋污损细菌研究。从表1可以看出化合物1、3、4、5、6、7对这三种污损细菌均有一定的抑制作用,化合物3和4对三种污损细菌有中等强度的抑制作用,化合物2和8对三种污损细菌没有抑制作用。
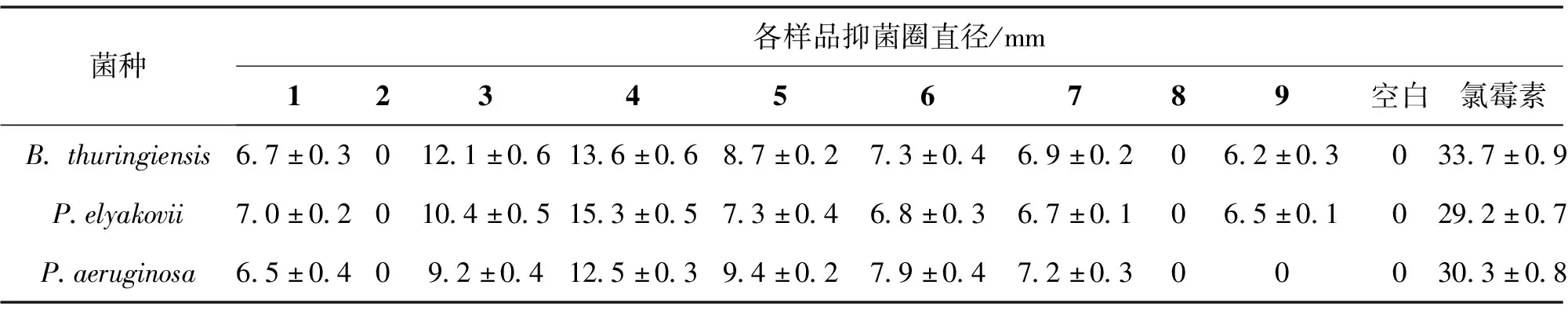
表1 化合物1—9的抗菌活性
3 结 论
从繁茂膜海绵共附生青霉属真菌Penicilliumsp.YZ-7分离得到9个化合物,3个麦角甾醇类化合物、醌茜素、1个二酮哌嗪、2个酰胺类化合物、2个糖醇。以海洋污损细菌为抗污损活性筛选模型对化合物进行抗污损活性初步评价,发现化合物(22E,24R)-5α,6α-epoxy-ergosta-8,22-dien-3β,7α-diol和醌茜素对三种污损细菌有中等强度的抑制作用。

