响应面优化刺五加总黄酮提取工艺及体外抗氧化研究
阚琦缤,刘瑞雪,王晓娅,苏建青,褚秀玲
(聊城大学农学院,山东 聊城 252000)
0 引 言
【研究意义】抗生素类饲料添加剂的禁用,导致畜禽消化道疾病的高发,而氧化应激是造成消化道损伤的重要因素[1]。临床研究显示刺五加[Acanthopanax senticosus (Rupr. Maxim.) Harms]对畜禽消化道具有较好的抗氧化作用,而刺五加总黄酮是其中主要的抗氧化成分[2,3]。通过现代化的提取技术,高效提取刺五加总黄酮,能够缓解刺五加原料药材的紧缺状况,评价其抗氧化能力,开发新型中药饲料添加剂,应用于畜禽临床养殖,对预防畜禽消化道疾病具有重要意义。【前人研究进展】王彦博等[4]采用正交试验优化了麦积山野生刺五加黄酮的提取工艺,发现提取温度和料液比对黄酮得率影响显著(P<0.05),优化后总黄酮得率为(28.11±0.19 )mg·g−1,并评价了提取物清除DPPH自由基、超氧阴离子自由基、羟自由基和总抗氧化能力的作用,显示提取物的抗氧化能力均优于对照品L-抗坏血酸。高腾等[5]采用响应面优化了刺五加茎皮黄酮的提取工艺,结果显示提取温度和提取时间对黄酮得率影响显著(P<0.05),黄酮的最大得率为38.0 mg·g−1。吴桐等[6]用正交试验优化了快速溶剂萃取法提取刺五加叶中的芦丁,结果显示提取温度和循环次数对芦丁的得率影响差异显著(P<0.05),芦丁得率达到0.155 mg·g−1。响应面法是一种解决多变量问题的统计方法,能利用合理性试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,分析回归方程来寻求最优的工艺参数[7]。【本研究切入点】前人关于提取刺五加根茎总黄酮的研究鲜有报道,抗氧化活性是评价其提取效果的关键因素。【拟解决的关键问题】本试验拟通过响应面法优化刺五加总黄酮的超声波辅助乙醇提取工艺,在单因素试验的基础上,通过Box-Benhnken Design响应面优化,获得超声波辅助乙醇提取刺五加总黄酮的最佳提取工艺,并通过体外抗氧化试验评价刺五加总黄酮的抗氧化能力,为刺五加临床的高效应用提供试验依据。
1 材料与方法
1.1 材料与试剂
刺五加饮片(聊城利民大药房),芦丁标准品(中国药品生物制品检定所),RAW264.7细胞(中国科学院干细胞库),RPMI-1640培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),CCK-8试剂盒(上海碧云天生物技术有限公司),试验中所用其 他试剂均为分析纯。
1.2 仪器与设备
LE203E/02电子天平,梅特勒-托利多仪器(上海)有限公司;SB-600DTY超声波多频清洗机,宁波新芝生物科技股份有限公司;UV-5900紫外可见分光光度计,上海元析仪器有限公司;1530酶标仪 ,赛默飞世尔科技(中国)有限公司。
1.3 试验流程
刺五加饮片→清洗干燥(60 ℃)→粉碎过筛(60目)→超声波浸提→过滤→测定总黄酮得率→AB-8 树脂纯化→体外抗氧化能力评价。
1.4 试验方法
1.4.1 刺五加总黄酮提取工艺优化
1.4.1.1 芦丁标准曲线的制备 采用本实验室建立的标 准曲线制作方法[5]制备芦丁标准曲线。
1.4.1.2 刺五加总黄酮的提取 称取2 g刺五加干粉放入150 mL锥形瓶中,加入乙醇溶液并摇晃均匀,然后放入超声波清洗仪中进行提取试验。采用NaNO2-Al(NO3)3-NaOH的显色体系[8]测量溶液中刺五加总黄酮 的得率。
1.4.1.3 单因素试验 本试验选用乙醇-水混合溶剂体系,准确称取2.0 g刺五加干粉,采用控制变量法分别对乙醇体积分数、液料比、提取时间、提取温度进行探究,考查各因素对刺五加总黄酮得率的影响 。各因素条件见表1。
1.4.1.4 响应面试验 在单因素试验基础上,依据Box-Benhnken Design原理,将刺五加总黄酮得率(Y)作为响应值,选取乙醇体积分数(A)、液料比(B)、提取时间(C)和提取温度(D),设计四因素三水平响应面试验,以优化刺五加总黄酮提取工艺。各因素 水平见表2。
1.4.1.5 验证试验 采用响应面优化后的最佳提取工艺,对刺五加进行3次平行提取,验证新工艺的刺五 加总黄酮得率。
1.4.1.6 刺五加总黄酮纯化 根据响应面优化条件提取刺五加总黄酮,并参照Xie 等[9]研究的大孔树脂纯化总黄酮方法,纯化刺五加总黄酮提取液。将纯化后的刺五加总黄酮提取液减压浓缩至总黄酮质量浓度为2.5 mg·mL−1,置于−20 ℃保存,用于体外抗氧化试验。1.4.1.7 细胞培养 RAW264.7细胞采用含有10%胎牛血清的1640培养基,置于37 ℃,5%CO2培养箱内 培养。待细胞生长至80%~90%时进行传代培养。1.4.1.8 H202诱导RAW264.7细胞氧化损伤模型 取对数生长期细胞,将细胞密度调整为5×104个·mL−1,以每孔200 μL接种于96孔板。待细胞生长至80%~90%时,吸去培养基,并使用PBS清洗一遍。加入200 μL含有不同体积分数H2O2的无血清1640培养基,孵育2 h后采用CCK-8法[10]计算细胞存活率。CK组使用不含H202的无血清1640培养基。每个试验 组设定6个重复孔。
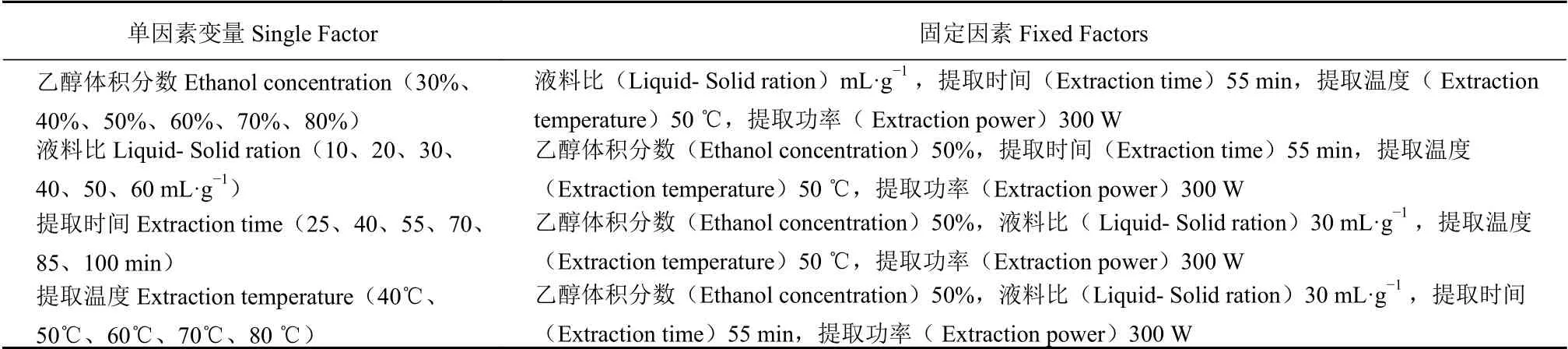
表 1 单因素试验水平Table 1 Level of single factor experiment

表 2 四因素三水平响应面试验Table 2 Response surface experiment of 4 factors and 3 levels
1.4.1.9 刺五加总黄酮提取液对RAW264.7细胞氧化损伤的保护作用 取对数生长期细胞,将细胞密度调整为5×104个·mL−1,以每孔200 μL接种于96孔板。将细胞分为CK组、H2O2组、H2O2+刺五加总黄酮低剂量(30 μg·mL−1)组、H2O2+刺五加总黄酮中剂量(60 μg·mL−1)组、H2O2+刺五加总黄酮高剂量(90 μg·mL−1)组。待细胞生长至80~90%时,吸去培养基,并使用PBS清洗一遍。刺五加黄酮组给予相应计量的刺五加总黄酮作用24 h,CK组和H2O2组以无血清1640培养基代替刺五加总黄酮。处理结束后去除培养基,使用PBS清洗一遍后加入含有400 μM H2O2的无血清1640培养基作用2h,CK组使用无血清1640培养基代替 H2O2。采用CCK-8法计算细 胞存活率。
1.4.2 刺五加总黄酮提取工艺优化
1.4.2.1 DPPH自由基清除能力 按照Sridhar Kandi等[11]的方法测定刺五加总黄酮提取液的DPPH自由基清除活性,并计算清除率和半数抑制浓度(IC50)。以同等质量浓度的L-抗坏血酸作阳性对照。
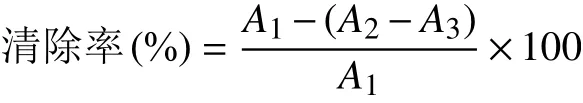
式中,A1:空白组吸光值;A2:刺五加总黄酮组吸 光值;A3:黄酮背景组吸光值
1.4.2.2 ABTS自由基清除能力测定 参考Zhao Z Y等[12]的方法,测定刺五加总黄酮提取液对ABTS自由基的清除活性,并计算清除率和半数抑制浓度(IC50)。以同等质量浓度的L-抗坏血酸作阳性对照。
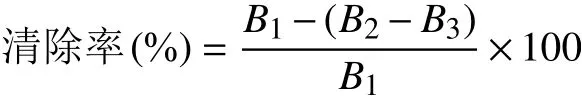
式中,B1:空白组吸光值;B2:刺五加总黄酮组吸 光值;B3:黄酮背景组吸光值。
1.4.2.3 羟基自由基清除能力测定 采用Dai C Y等[13]的研究方法测定刺五加总黄酮提取液对羟基自由基的清除活性,并计算清除率和半数抑制浓度(IC50)。以同等质量浓度的L-抗坏血酸作阳性对照。

式中,C1:空白组吸光值;C2:刺五加总黄酮组 吸光值;C3:黄酮背景组吸光值
1.4.2.4 总还原能力测定 按照Shang H M等[14]的研究方法测定刺五加总黄酮提取液的总还原能力,以同 等质量浓度的L-抗坏血酸作阳性对照。
1.5 数据分析
每1组试验重复3次,试验结果数据以平均值±标准差表示。利用 Design Expert 10.0.7 软件进行响应面设计和结果分析;使用 GraphPad Prism 8.0.1软 件进行作图;使用 SPSS 22.0 进行数据分析。
2 结果与分析
2.1 芦丁标准曲线
如图1所示,当黄酮质量浓度在0~50 μg·mL−1时,方程线性关系良好,可用于测定刺五加总黄酮得 率。
2.2 单因素试验
2.2.1 乙醇体积分数对刺五加总黄酮得率的影响 如图2所示,当乙醇从30%增加到50%,刺五加总黄酮得率逐步提高;当乙醇超过50%,刺五加总黄酮得率与乙醇浓度呈负相关趋势。说明乙醇-水相系统的浓度不同,其极性也不同,对黄酮分子的萃取能力也有变化[15]。在乙醇为50%时,溶剂的萃取能力最强,刺五加总黄酮得率达到最高值(18.58±0.32 )m g·g−1。
2.2.2 液料比对刺五加总黄酮得率的影响 液料比是影响黄酮得率的一个重要因素,较高的液料比可以增加黄酮分子与溶剂的质量传递,从而提高黄酮得率[16];如图3所示,当液料比从10 mL·g−1增加至40 mL·g−1,总黄酮得率增长较为明显,并在40 mL·g−1达 到峰值(19.39±0.17) mg·g−1。
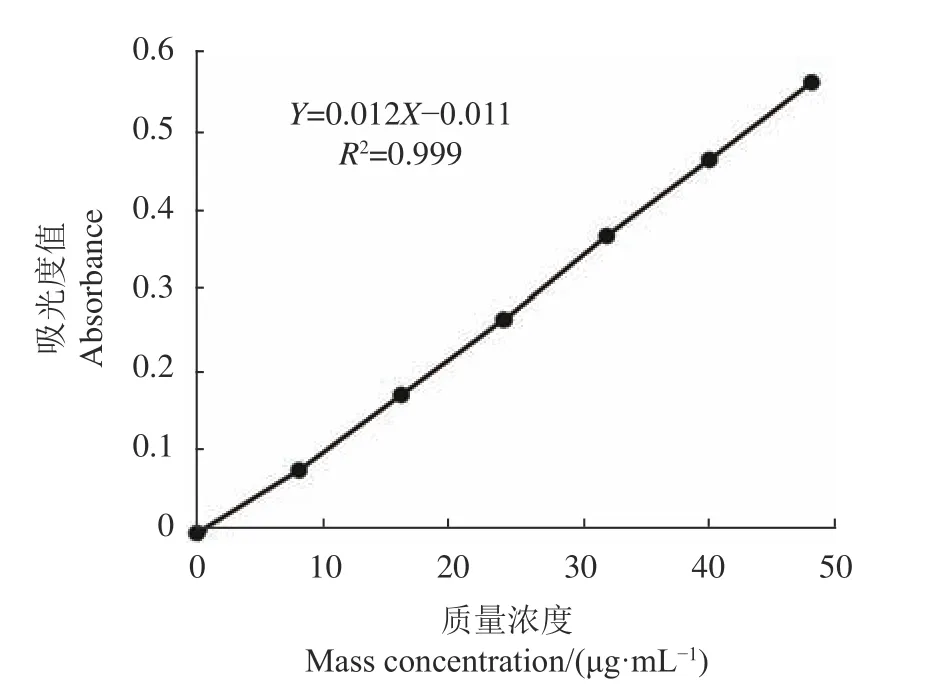
图 1 芦丁标准曲线Fig. 1 Standard curve of rutin
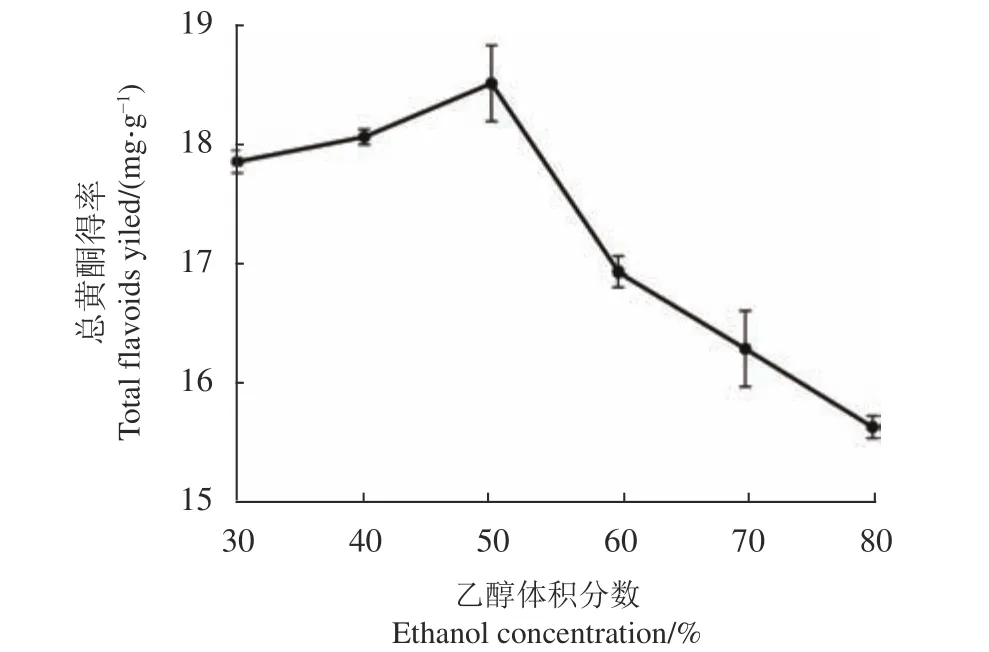
图 2 乙醇体积分数对刺五加总黄酮得率的影响Fig. 2 Effect of ethanol concentration on extraction yield of total flavonoids
2.2.3 提取时间对刺五加总黄酮得率的影响 由图4可知,提取时间从25 min增加到70 min,刺五加总黄酮得率持续上升;当时间超过70 min时,黄酮得率随时间增长而下降,在70 min达到最高值(17.04±0.19 )mg·g−1。其原因可能是超声波会对黄酮分子产生空化作用,提取时间过长将导致黄酮化合物分解,致使得率下降[17]。
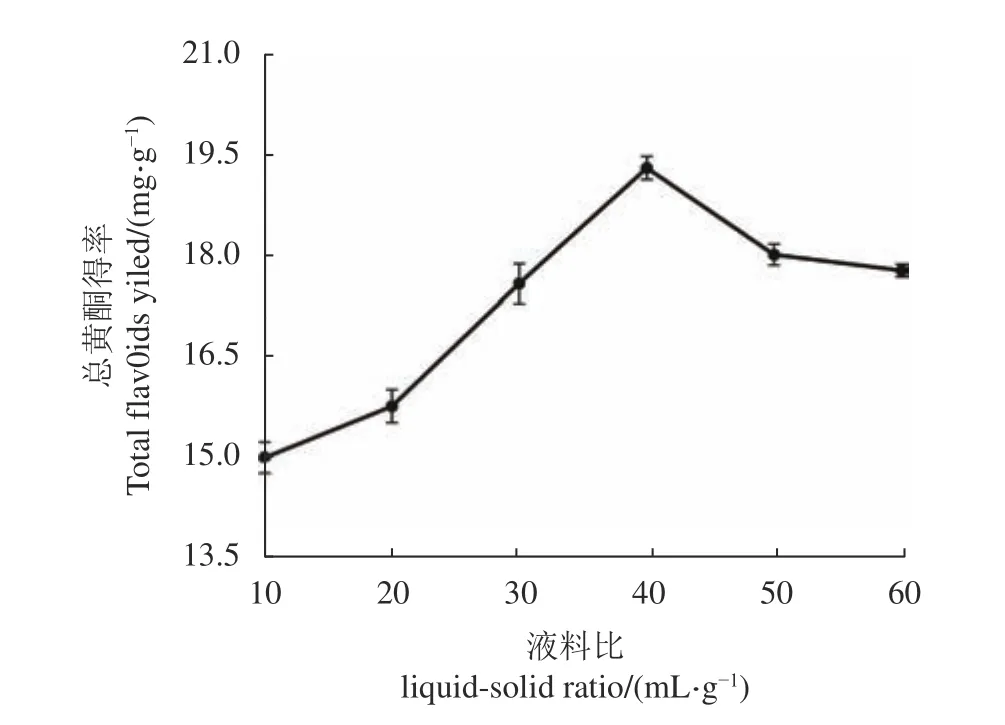
图 3 液料比对刺五加总黄酮得率的影响Fig. 3 Effect of liquid-solid ratio on extraction yield of total flavonoids
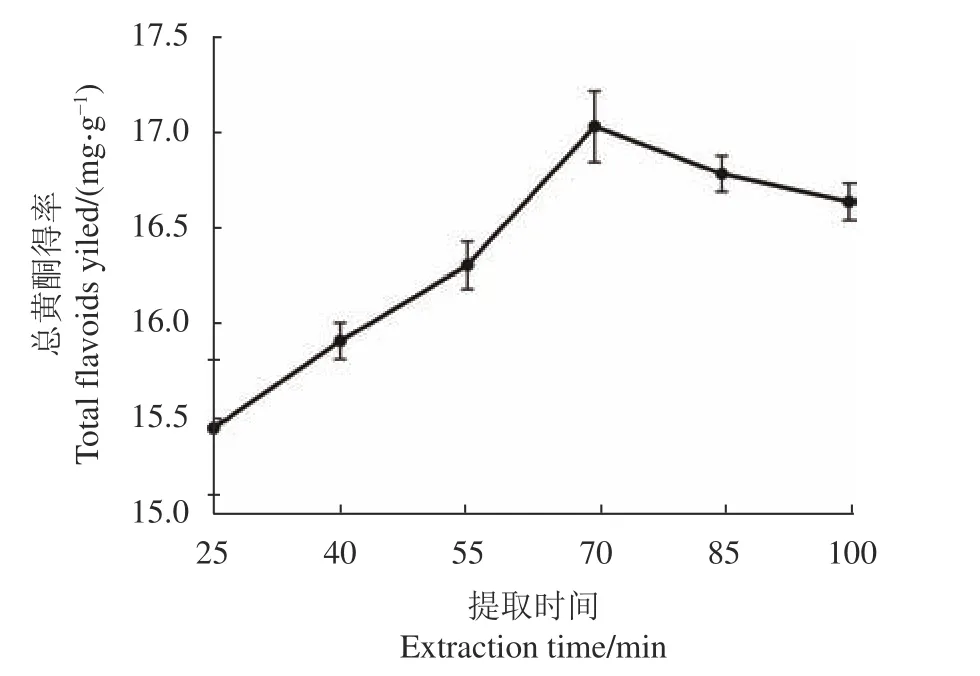
图 4 提取时间对刺五加总黄酮得率的影响Fig. 4 Effect of extraction time on yield of total flavonoids
2.2.4 提取温度对刺五加总黄酮得率的影响 如图5
所示,当提取温度从40 ℃提高到70 ℃,刺五加总黄酮得率逐步提高,在70 ℃时,总黄酮得率达到最高值(18.86±0.25 )mg·g−1;当提取温度升高至80 ℃时,总黄酮得率出现下降。其原因可能是较高的提取温度,能够增加分子的运动速度,加快溶剂的渗透作用,从而使黄酮类化合物迅速扩散到溶剂中[18]。但是提取温度过高将导致部分黄酮类化合物分解[19],降低刺五加总黄酮的提取率。
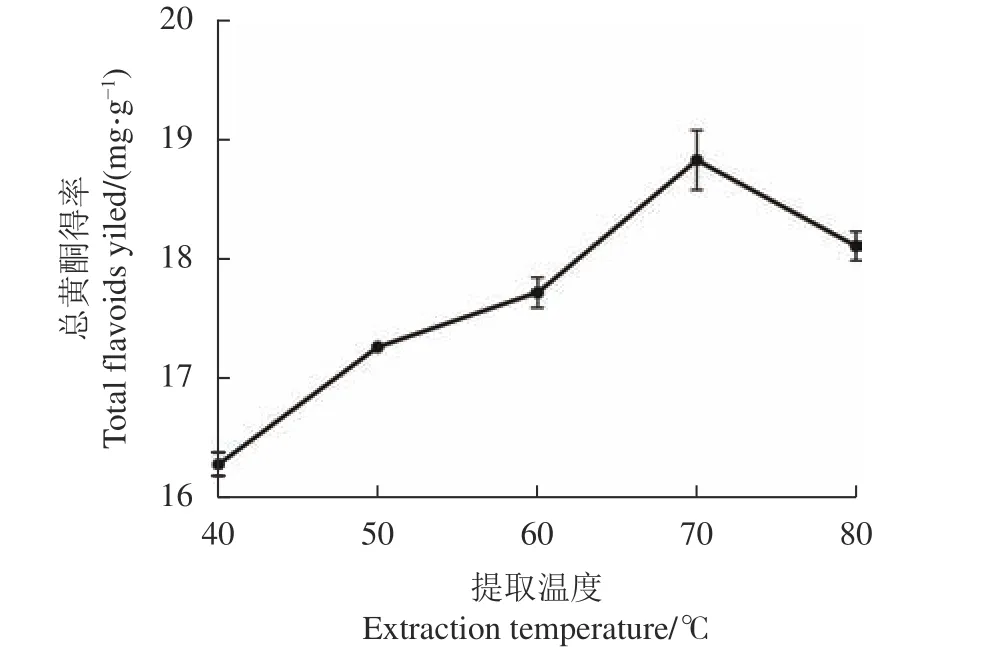
图 5 提取温度刺五加总黄酮得率的影响Fig. 5 Effect of extraction temperature on yield of total flavonoids
2.3 响应面优化试验
2.3.1 响应面试验设计和模型拟合 根据单因素试验结果,将刺五加总黄酮得率作为响应值,选取乙醇浓度、提取时间、液料比和提取温度设计四因素三水平响应面优化试验,共29组。结果见表3。利用Design Expert 10.0.4软件对表3数据进行二次回归拟合,得到回归方程如下:

其中:Y为刺五加总黄酮得率(mg·g−1);A为乙醇(%);B为液料比(mL·g−1);C为提取时间( min);D为提取温度(℃)。
2.3.2 响应面试验数据方差分析 对表3数据进行方 差分析,结果见表4,模型P<0.000 1,说明模型所得方程与实际数据拟合较好,可用该模型设计试验优化刺五加总黄酮的提取。失拟项P>0.05,说明该试验误差小,模型残差由随机误差产生。其中:一次项A、B、C、D的P<0.01,说明乙醇、提取时间、液料比和提取温度对刺五加总黄酮得率的影响极显著;交互项AC、AD、BC、CD的P<0.05,说明乙醇与提取时间,乙醇与提取温度,液料比与提取时间,提取时间与提取温度间的交互作用影响显著;二次项A2、B2、C2、D2的P<0.01,说明对刺五加总黄酮得率的影响均极显著。
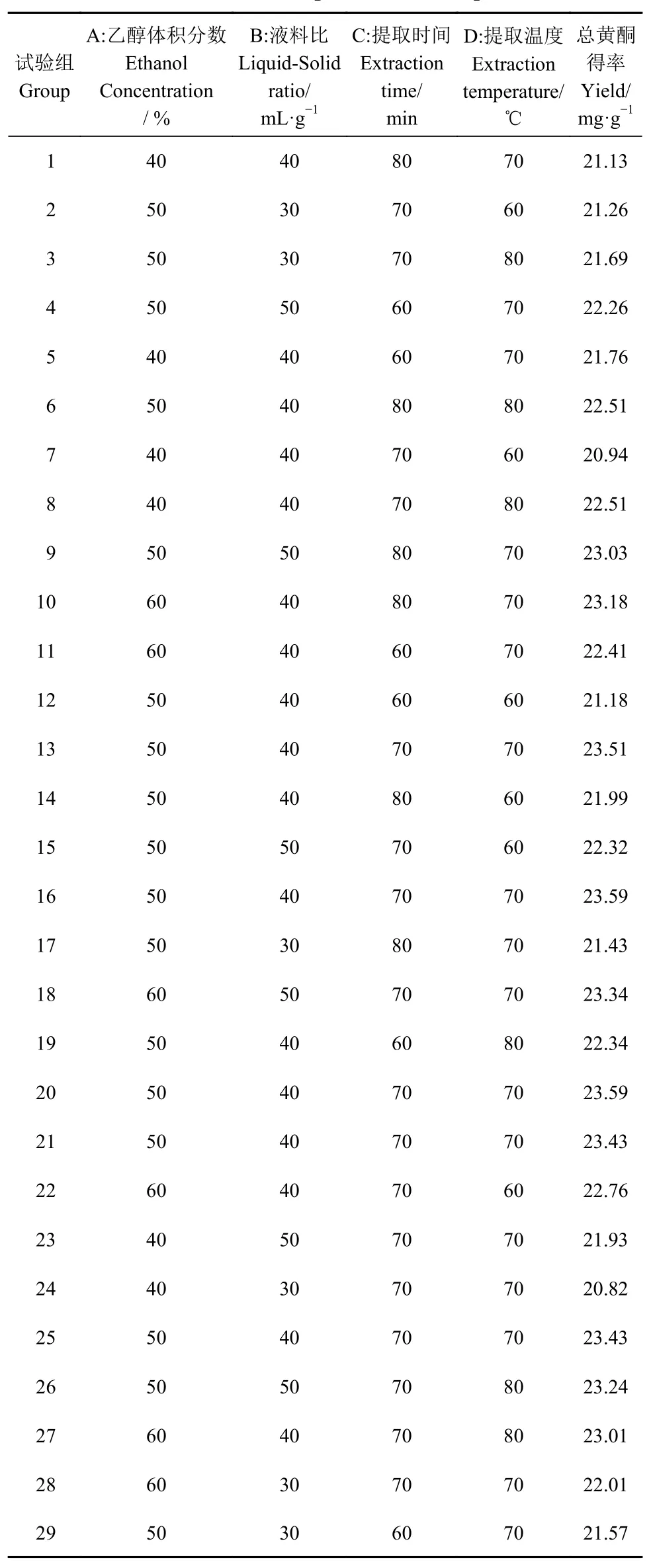
表 3 响应面试验结果Table 3 Results of response surface experiment
使用软件绘制响应面三维曲线,如图6所示,可直观表现各因子对响应值的影响趋势,响应面图中曲线走势越陡,表明该因素对黄酮得率影响越大,如走势平滑,则影响较小。由图6可知,乙醇(A)、料液比(B)、提取时间(C)和提取温度(D)的曲线均较陡,说明他们对提取率影响均较大,与表4分析一致。等高线的形状能反映出两因素交互作用的程度,椭圆形说明交互作用显著,若为圆形则反之。由图6可知,图6(B)、6(C)、6(D)和6(F)的等高线表现为椭圆形且较为紧密,说明乙醇与提取时间,乙醇与提取温度,液料比与提取时间,提取时间与提取温度之间交互作用明 显。
2.3.3 验证试验 根据建立的模型预测刺五加总黄酮最佳提取工艺,即乙醇55%,提取时间73 min,液料比45∶1,提取温度72 ℃,进行3次提取试验,测得刺五加总黄酮实际得率为(24.11±0.17) mg·g−1,与 预测值23.89 mg·g−1接近(表5)。
2.3.4 刺五加总黄酮纯化 经过AB-8树脂纯化后,刺五加总黄酮纯度由纯化前24.75%±0.54%提高至47.65%±0.032%。经过纯化后,刺五加总黄酮纯度约是纯化前的2倍,提升了刺五加总黄酮的质量,可 用于后续抗氧化试验。
2.4 刺五加总黄酮体外抗氧化试验
2.4.1 DPPH自由基清除试验 如图7所示,质量浓度在10~100 μg·mL−1区间内,刺五加总黄酮提取液对DPPH自由基的清除活性随浓度的增加而增加。刺五加总黄酮在10~60 μg·mL−1时,清除活性迅速增强;当超过60 μg·mL−1时,对DPPH自由基的清除活性趋于平缓。刺五加总黄酮提取液和L-抗坏血酸对DPPH自由基的半数抑制浓度(IC50)分别为28.38 μg·mL−1和15.90 μg·mL−1,刺五加总黄酮提取液DPPH自由基清除能力是L-抗坏血酸的55.21%。当质量浓度达到100 μg·mL−1时,刺五加总黄酮提取液和L-抗坏血酸对DPPH自由基的清除率分别为8 8.26%和98.80%。
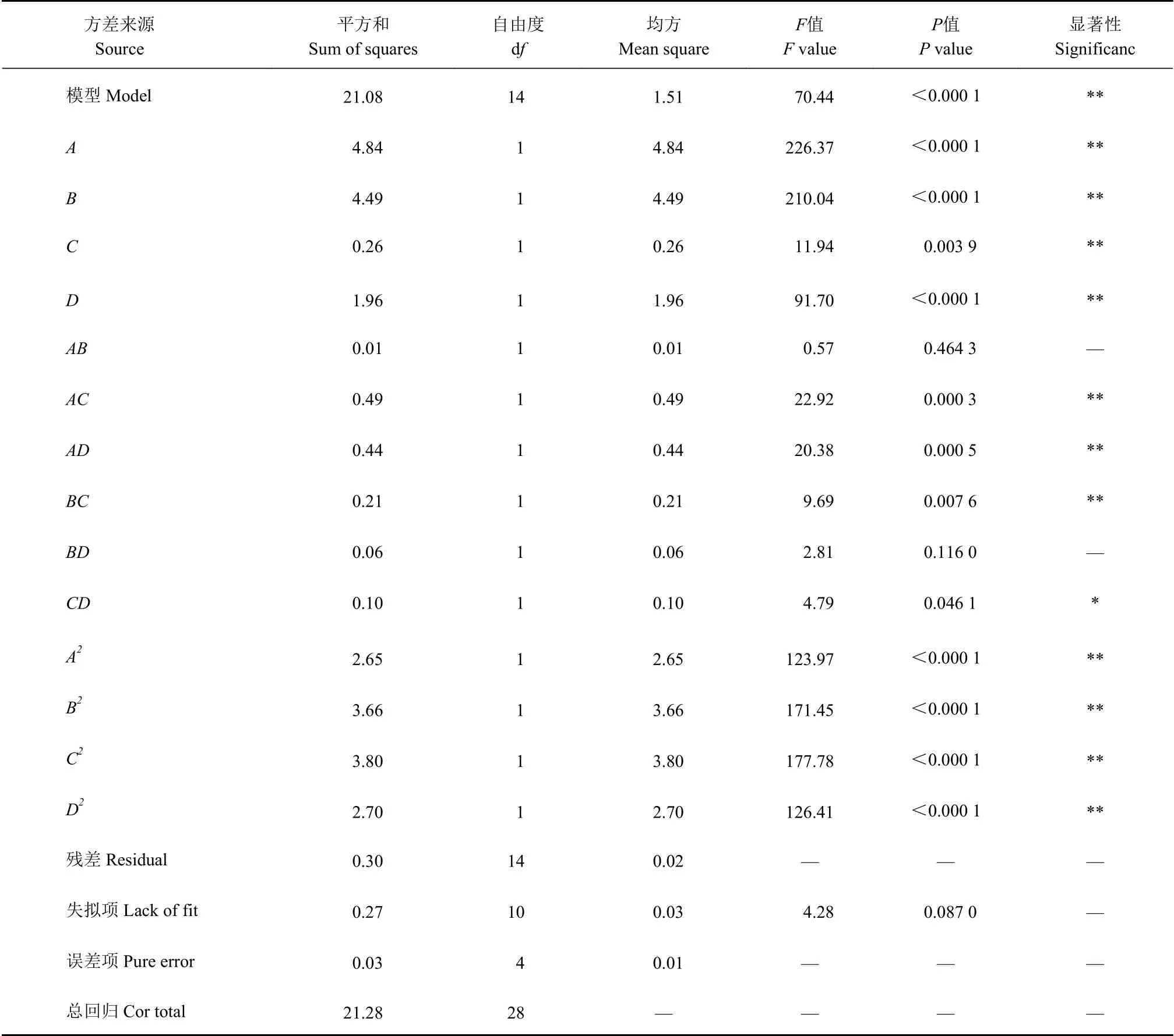
表 4 响应面试验方差分析Table 4 Variance analysis of response surface experiment
2.4.2 ABTS自由基清除试验 由图8可知,刺五加总黄酮提取液对ABTS自由基的清除活性与浓度成正相关。同等质量浓度下,L-抗坏血酸对于ABTS自由基的清除能力要强于刺五加总黄酮提取液,刺五加总黄酮提取液和L-抗坏血酸对ABTS自由基的半数抑制浓度(IC50)分别为103.77 μg·mL−1和59.88 μg·mL−1,刺五加总黄酮对ABTS自由基的清除能力为L-抗坏血酸的57.70%。当质量浓度为300 μg·mL−1时,刺五加总黄酮提取液和L-抗坏血酸对ABTS自由基的最大 清除率分别为93.64%和99.23%。
2.4.3 羟基自由基清除试验 如图9所示,刺五加总黄酮提取液和L-抗坏血酸对羟基自由基的半数抑制浓度(IC50)分别为228.70 μg·mL−1和114.12 μg·mL−1,刺五加总黄酮对于羟基自由基的清除能力是L-抗坏血酸的49.90%。虽然刺五加总黄酮提取液对羟基自由基的清除活性和浓度呈正相关,但增长趋势较为平缓。当质量浓度为300 μg·mL−1时,刺五加总黄酮提取液和L-抗坏血酸对羟基自由基的清除率分别为6 2.82%和85.33%。
2.4.4 总还原能力测定 刺五加总黄酮的还原能力由吸光值的高低表示,吸光值越高其还原能力越强。如图10所示,随着刺五加总黄酮浓度的提高,吸光值也随之快速升高。当质量浓度在10~100 μg·mL−1范围内,刺五加总黄酮提取液吸光值从0.09增加到0.76;L-抗坏血酸吸光值从1.13增加到1.25。在质量浓度为100 μg·mL−1时,刺五加总黄酮提取液的总还原 能力占L-抗坏血酸的61.04%。
2.5 刺五加总黄酮对RAW264.7细胞氧化损伤保护作 用
2.5.1 建立H2O2氧化损伤模型 如图11所示,当H2O2浓 度 从100 μmol·L−1增 加 到1000 μmol·L−1,RAW264.7细胞存活率下降明显,说明H2O2对RAW264.7细胞产生氧化损伤作用,致使部分细胞死亡。H2O2对RAW264.7细胞的半数抑制浓度(IC50)为391.4 μmol·L−1,为了方便后续试验,因此选择400 μ mol·L−1为RAW264.7细胞建模浓度。
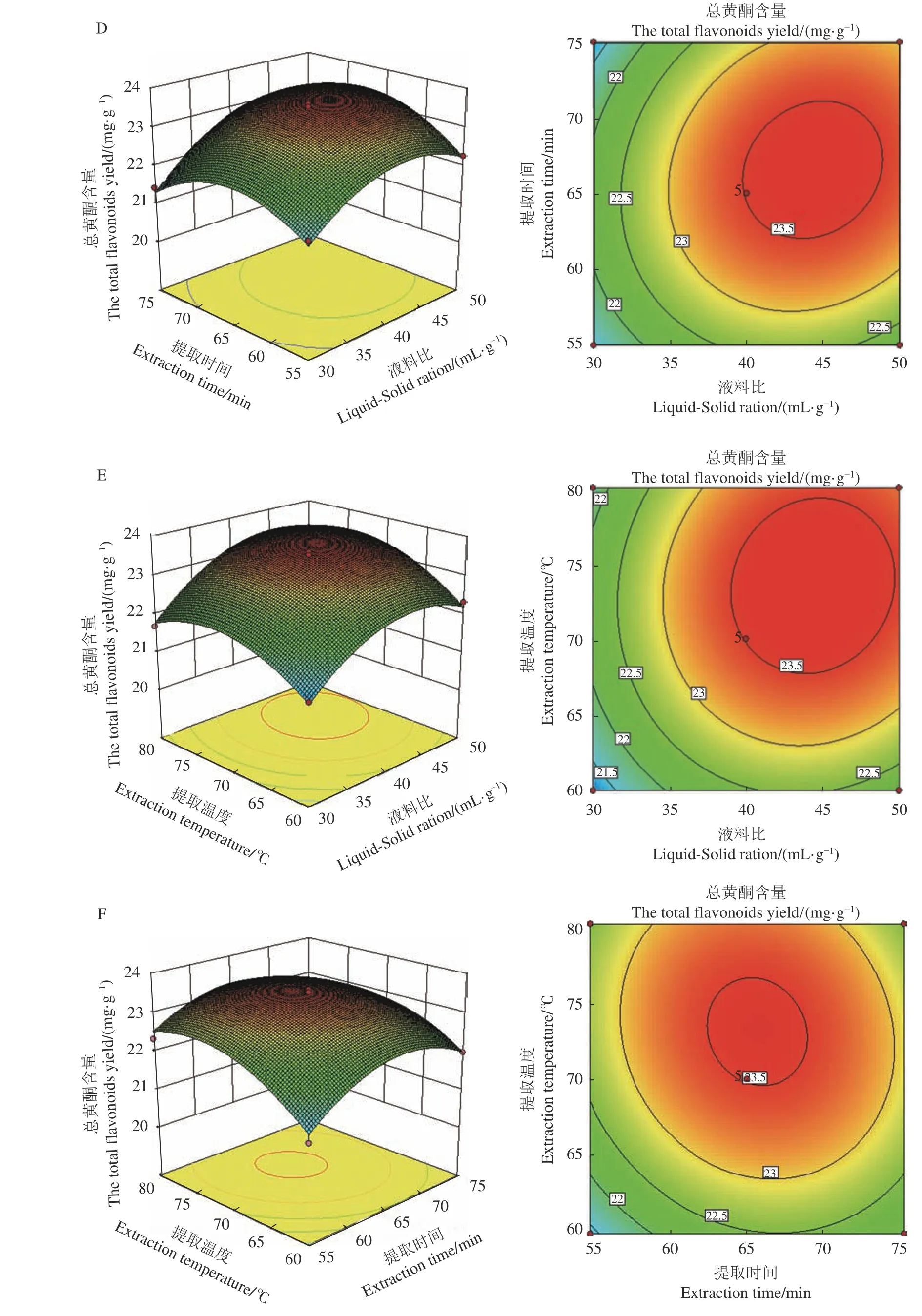
图 6 两因素间交互作用对刺五加总黄酮得率的影响Fig. 6 Effect of interaction between two factors on extraction of total flavonoids
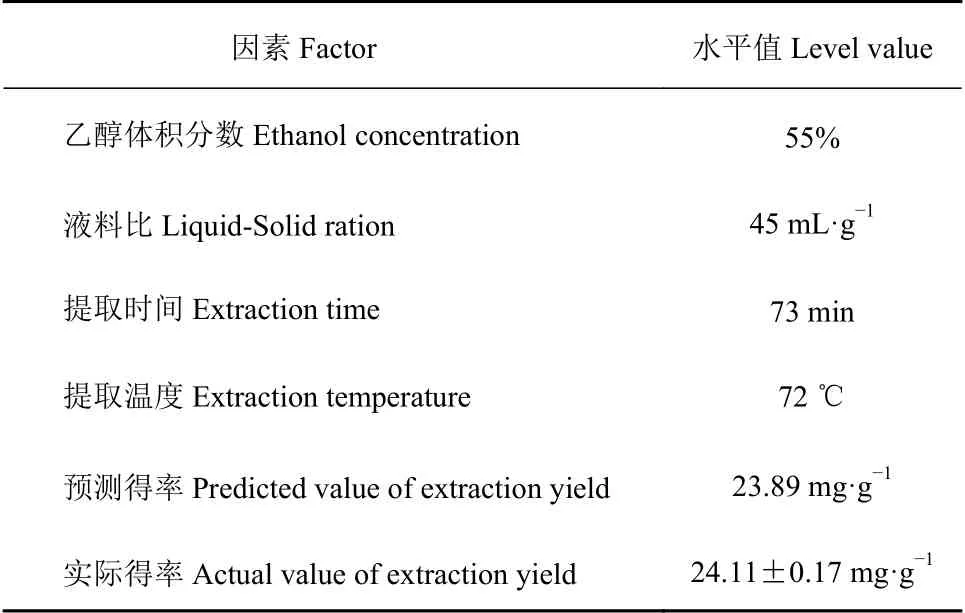
表 5 刺五加总黄酮最佳提取条件Table 5 Optimized conditions for flavonoid extraction from A.senticosus
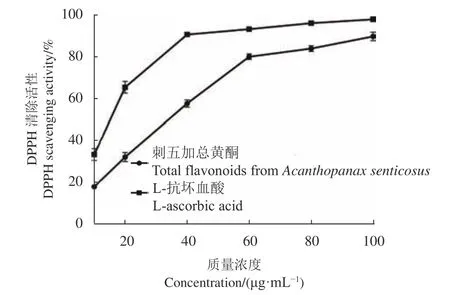
图 7 DPPH自由基清除活性Fig. 7 DPPH free radical scavenging ability of extracted flavonoids
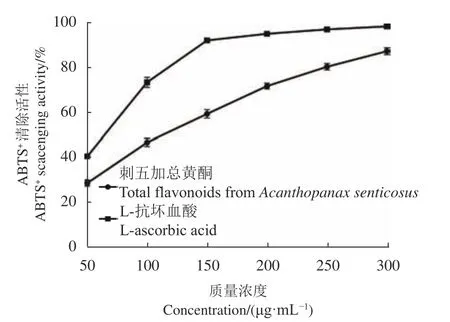
图 8 ABTS+自由基清除活性Fig. 8 ABTS+ free radical scavenging ability of extracted flavonoids
2.5.2 刺五加总黄酮对RAW264.7细胞氧化损伤保护试验 如图12所示,H2O2组细胞活性与CK组相比
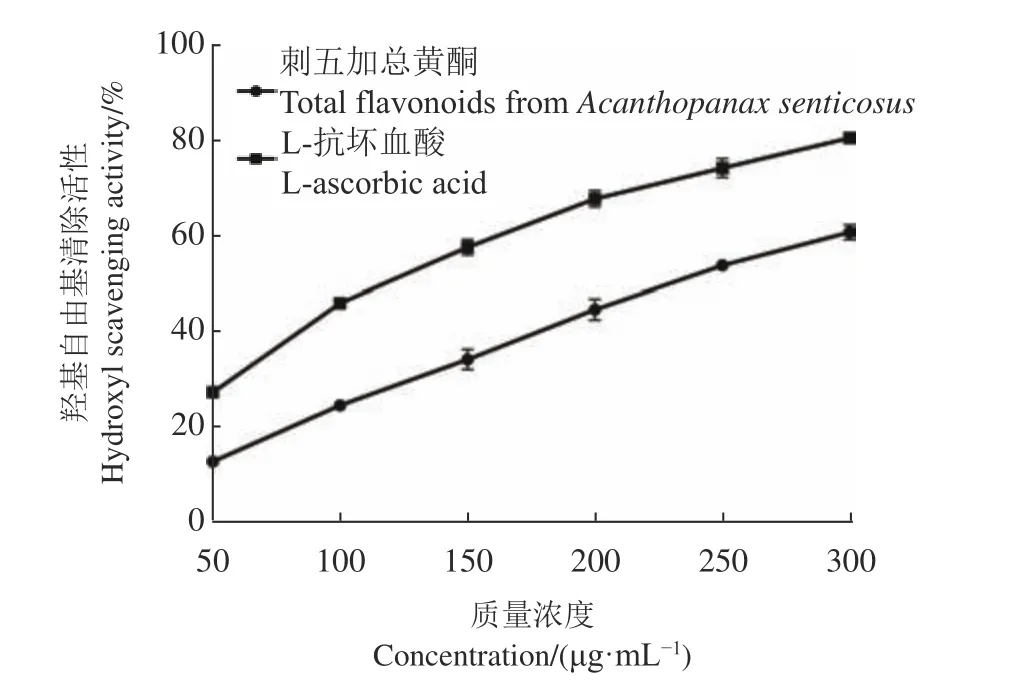
图 9 羟基自由基清除活性Fig. 9 Hydroxyl free radical scavenging ability of extracted flavonoids
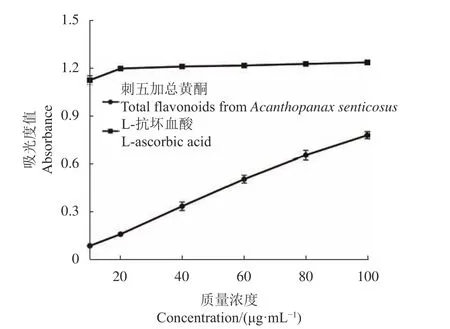
图 10 刺五加总黄酮还原能力Fig. 10 Reducing power of flavonoids extract from A. senticosus
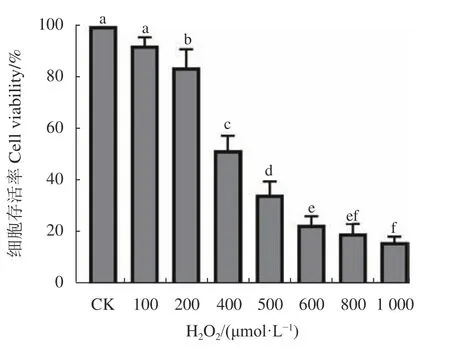
图 11 H2O2对RAW264.7细胞增殖的影响Fig. 11 Effects of H2O2 on proliferation of RAW264.7 cells
下降明显,说明H2O2对RAW264.7细胞造成了一定的氧化损伤。刺五加总黄酮提取液高、中、低组(90、60、30 μg·mL−1)与H2O2组相比,RAW264.7细胞活性明显提高,说明刺五加总黄酮对RAW264.7细胞氧化损伤有较强的保护作用。
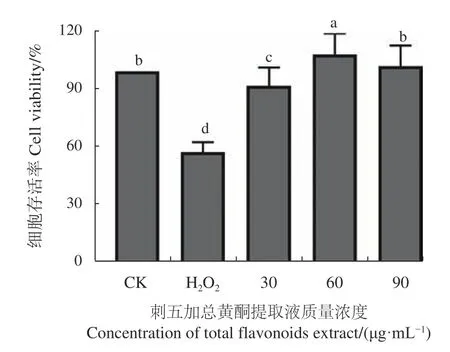
图 12 刺五加总黄酮对RAW264.7细胞氧化损伤保护作用Fig. 12 Effect of extracted flavonoids in protecting oxidative damage on RAW264.7 cells
3 讨论与结论
刺五加传统的提取方法主要是水提法和醇提法,具有使用操作简便、成本低和适用性广的优势,但是随着中药的用量增加,中药成本的升高,需要用更先进的现代化提取技术进行提取。超声波辅助提取具有提取时间短,提取温度低和提取效率高等优点,温和的提取条件能够更好地保护提取物的活性,减少对有效成分的破坏。优化方法常用的有正交设计法和响应面法,正交设计法选取的试验点并不能完全反应整体的情况,且最终结果仅是对所选水平的优化,而响应面法将数据进行多项式拟合后,以图形表达函数关系,且能检查出各因素之间的交互性,具有更好的优化作用。本试验用响应面优化出的提取条件是:乙醇55%,提取时间73 min,液料比45 mL·g−1,提取温度72 ℃,总黄酮得率达到24.11 mg·g−1。和传统的溶剂提取法相比,超声波辅助提取法具有提取时间短、提取温度低和提取效率高的优点。
提取物的活性是评价其提取效果更重要的因素,毕竟提取物最终的药效才是其临床应用的关键价值。氧化应激是体内氧化与抗氧化作用调节失衡,氧化作用处于优势地位,导致机体细胞出现炎性浸润,从而产生过量的氧化中间产物,对机体造成损伤,降低机体的免疫功能[20]。目前,对于中药提取物的抗氧化活性测定主要集中于体外氧化自由基清除试验[21]。结果表明,刺五加总黄酮提取液对3种自由基都具有一定的清除能力,并且剂量依赖性显著。其中刺五加总黄酮提取液对DPPH自由基、ABTS自由基、羟基自由基清除能力的IC50值为28.38 μg·mL−1、107.77 μg·mL−1和228.70 μg·mL−1,分别是L-抗坏血酸IC50值的55.21%、57.70%和49.90%。但是,随着质量浓度的提高,刺五加总黄酮提取液同L-抗坏血酸对3种自由基清除率的差异逐渐缩小。刺五加总黄酮提取液的总还原能力与质量浓度呈正相关,当质量浓度达到100 μg·mL−1,刺五加总黄酮提取液的总还原能力是L-抗坏血酸的0.61倍。其次,试验通过H2O2刺激RAW264.7细胞建立氧化损伤模型,结果表明,30 μg·mL−1、60 μg·mL−1、90 μg·mL−1的刺五加总黄酮组与H2O2处理组比较,均具有显著的抗氧化损伤作用,差异性显著(P<0.05)。由此可见,刺五加总黄酮提取液具有较好的体外抗氧化活性,为刺五加活性成分的深入研究奠定了一定的理论基础。

