肾动脉狭窄致心力衰竭患者的临床特征及诊治经验
王倩,蒋雄京,何际宁,陈阳,董徽,宋雷,邹玉宝
肾动脉狭窄(renal artery stenosis,RAS)所致肾血管性高血压(renal vascular hypertension,RVH)是继发性高血压的常见类型,具有起病隐匿、血压升高显著、靶器官损伤明显等特点,可导致肾脏缺血和估算肾小球滤过率(estimated glomerular filtration rate,eGFR)降低,进而造成心肌肥厚、水钠潴留,严重者可引发心力衰竭。既往临床对RAS致心力衰竭患者的重视程度不足,尤其是疏忽了对青少年人群血压的监测,导致多数患者就诊时已出现靶器官损伤和急性失代偿性心力衰竭;老年RVH患者多因心力衰竭、高血压就诊,但其临床表现并无特异性,易被误诊为原发性高血压,进而延迟治疗[1]。对此,本研究总结了RAS致心力衰竭患者的临床特征及诊治经验,以期为临床诊疗提供参考。
1 资料与方法
1.1 一般资料 本研究为回顾性研究。选取2014—2019年中国医学科学院阜外医院住院的RAS致心力衰竭患者5例。纳入标准:(1)RAS患者除具有难治性高血压的临床表现外,还伴有难以解释的心力衰竭症状及体征(如胸闷、气促、夜间不能平卧、端坐呼吸及双下肢水肿等),且经肾动脉血运重建术得以改善[2-4];(2)左心室射血分数(left ventricular ejection fraction,LVEF)<40%;(3)完成肾动脉介入术治疗。排除标准:(1)合并心脏瓣膜病、缺血性心肌病、肥厚型梗阻性心肌病、先天性心脏病者;(2)合并主动脉狭窄或其他主动脉结构异常者。本研究经中国医学科学院阜外医院伦理委员会审核批准。
1.2 治疗
1.2.1 常规治疗 患者入院后均按照当时心力衰竭诊治指南中的相关要求给予标准的抗心力衰竭治疗方案[2,5],其中生活管理包括适当限制水钠摄入、避免过度劳累、控制体质量等,药物治疗包括利尿剂、肾素-血管紧张素系统抑制剂、β-受体阻滞剂、醛固酮受体拮抗剂,针对应用利尿剂、β-受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)/血管紧张素Ⅱ受体拮抗剂(angiotonin receptor blocker,ARB)/血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)、醛固酮受体拮抗剂后仍存在心力衰竭症状者,可加用地高辛;对于双侧RAS患者,慎用ACEI、ARB、ARNI类药物。在治疗过程中,若患者出现疾病恶化、症状性低血压〔收缩压<90 mm Hg(1 mm Hg=0.133 kPa)〕或心动过缓(心率<50 次/min),则减慢增加药物剂量达到目标剂量的过程。
1.2.2 血运重建术 患者均采用血运重建术,术中采用局部穿刺点(以股动脉或肱动脉为穿刺点)注射利多卡因进行麻醉,选取6 F MPA1(Johnson & Johnson,美国强生)或6 F RDC(Johnson & Johnson,美国强生)指引导管,使用Fielder 0.014 inch×180 cm(Terumo Corporation,泰尔茂株式会社)或Hiwire 0.035 inch×260 cm(Cook Group Incorporated,美国库克公司)引导钢丝,根据患者RAS病因及病变的解剖情况选择肾动脉球囊扩张成形术或支架植入术。
1.2.3 术后随访及管理 术后随访1~5年,随访主要内容包括24 h动态血压、实验室检查指标、超声心动图、肾动脉超声等。
1.3 相关疾病诊断标准
1.3.1 大动脉炎(takayasu arteritis,TA) 根据1990年美国风湿病协会制定的TA诊断标准进行诊断[6]:(1)发病年龄≤40岁;(2)肢体间歇性跛行;(3)肱动脉搏动减弱;(4)脉压>10 mm Hg;(5)锁骨下动脉或主动脉可闻及杂音;(6)动脉造影检查异常:主动脉一级分支或上、下肢近端的大动脉狭窄或闭塞,病变常为局灶性或节段性,可排除动脉粥样硬化或纤维肌性发育不良(fibromuscular dysplasia,FMD)等其他病因。符合上述3项即可确诊。若仍无法确诊,则根据《肾动脉狭窄的诊断和处理中国专家共识》中的TA诊断标准[1]:(1)发病年龄<40岁,女性多见;(2)出现受累血管的症状和/或体征(受累血管供血不足、病变血管狭窄相关体征,急性期可出现受累部位疼痛和炎症指标升高);(3)双功能超声检查(duplex ultrasonogrphy,DUS)、计算机断层血管成像(computed tomography angiography,CTA)、磁共振血管成像(magnetic resonance angiography,MRA)或肾动脉造影发现特征性的病变影像,排除动脉粥样硬化、FMD、先天性动脉血管畸形、结缔组织病或其他血管炎等。满足上述标准的3项且每项符合至少1条即可确诊。
1.3.2 心肌肥厚 心电图示左心室高电压[7-8]:SV1+RV5>3.5 mV(Sokolow-Lyon 电压指数);超声心动图示室壁肥厚[9-10]:室间隔厚度(interventricular septum thickness,IVST)和 /或左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)男性>11.0 mm、女性>10.5 mm。诊断标准[11]:左心室质量指数(left ventricular weight index,LVMI)男性≥115 g/m2,女性≥95 g/m2。
1.3.3 动脉粥样硬化性RAS 动脉粥样硬化性RAS诊断标准[1]:(1)至少具有1项动脉粥样硬化的危险因素,如肥胖、糖尿病、高脂血症、年龄>40岁、长期吸烟。(2)至少具有2项动脉粥样硬化的影像学表现,如肾动脉锥形狭窄或闭塞,偏心性狭窄,不规则斑块,钙化,主要累及肾动脉近段及开口;腹部其他血管动脉粥样硬化的表现。
1.4 观察指标
1.4.1 基线资料 收集患者的基线资料,包括年龄、性别、体质指数(body mass index,BMI)、高血压病程、降压药物服用种类、术前最高血压、心肌肥厚情况、外院诊断、病因、术前CTA/数字减影血管造影(digital subtraction angiography,DSA)检查结果及抗凝/抗血小板药物、激素类药物、免疫抑制剂、ACEI/ARB、β-受体阻滞剂、钙离子拮抗剂(calcium antagonist,CCB)、利尿剂使用情况。
1.4.2 手术治疗情况 收集患者手术治疗情况,包括穿刺点、手术时间、X线曝光时间、造影剂及用量、术中肾动脉狭窄情况、血运重建术、指引导管类型、导引钢丝类型、球囊型号、支架型号。
1.4.3 术前及术后随访时的相关指标 收集患者术前及术后随访时的相关指标,包括24 h平均压、纽约心脏病协会(New York Heart Association,NYHA)分级、实验室检查指标〔包括肌酐、N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)〕、心脏结构和功能指标〔左心房前后径(left atrium anteroposterior diameter,LAD)、左心室舒张末期前后径(left ventricular end diastolic anteroposterior diameter,LVEDD)、右心室舒张末期前后径(right ventricular end diastolic anteroposterior diameter,RVEDD)、IVST、LVPWT、LVEF、左心室质量(left ventricular weight,LVM)、LVMI、肺动脉收缩压(pulmonary artery systolic pressure,PASP)〕。其中NYHA分级标准为Ⅰ级:患者活动不受限,即日常体力活动并未引起明显的气促、疲乏或心悸;Ⅱ级:患者活动轻度受限,即休息时无症状,日常活动则可引起明显的气促、疲乏或心悸;Ⅲ级:患者活动明显受限,即休息时无症状,轻于日常活动即引起明显的气促、疲乏或心悸;Ⅳ级:患者休息时也可出现气促、疲乏或心悸,任何体力活动均会引起不适[2]。采用Philips IE33彩色多普勒超声诊断仪进行诊断,选用S5-1探头,探头频率为1.0~5.0 MHz,患者取左侧卧位,平静呼吸,于右心室流入道切面、右心室心尖四腔心切面获取二维动态图像,记录患者心脏结构和功能指标。根据Devereux校正公式计算:体表面积(body surface area,BSA)=0.006 1× 身 高(cm)+0.012 8× 体 质 量(kg)-0.152 9;LVM=0.8×1.04×〔(IVST+LVPWT+LVEDD)3-LVEDD3〕+0.6;LVMI=LVM(g)/BSA(m2)。
2 结果
2.1 基线资料 本组患者基线资料见表1。5例患者中男性1例,女性4例;年龄13~77岁;除病例5外,其他4例患者有难治性高血压表现,既往最高血压波动于180~196/80~110 mm Hg,患者使用3~4种降压药物(包括利尿剂)血压控制仍不达标;5例患者均有心肌肥厚,具体表现为心电图示左心室高电压和/或超声心动图示室壁肥厚;4例患者外院诊断为扩张型心肌病,1例患者外院诊断为急性重症心肌炎;病因:TA 4例,动脉粥样硬化1例。4例患者术前本院影像学检查见图1(病例1的影像资料为外院,此次入院未复查)。
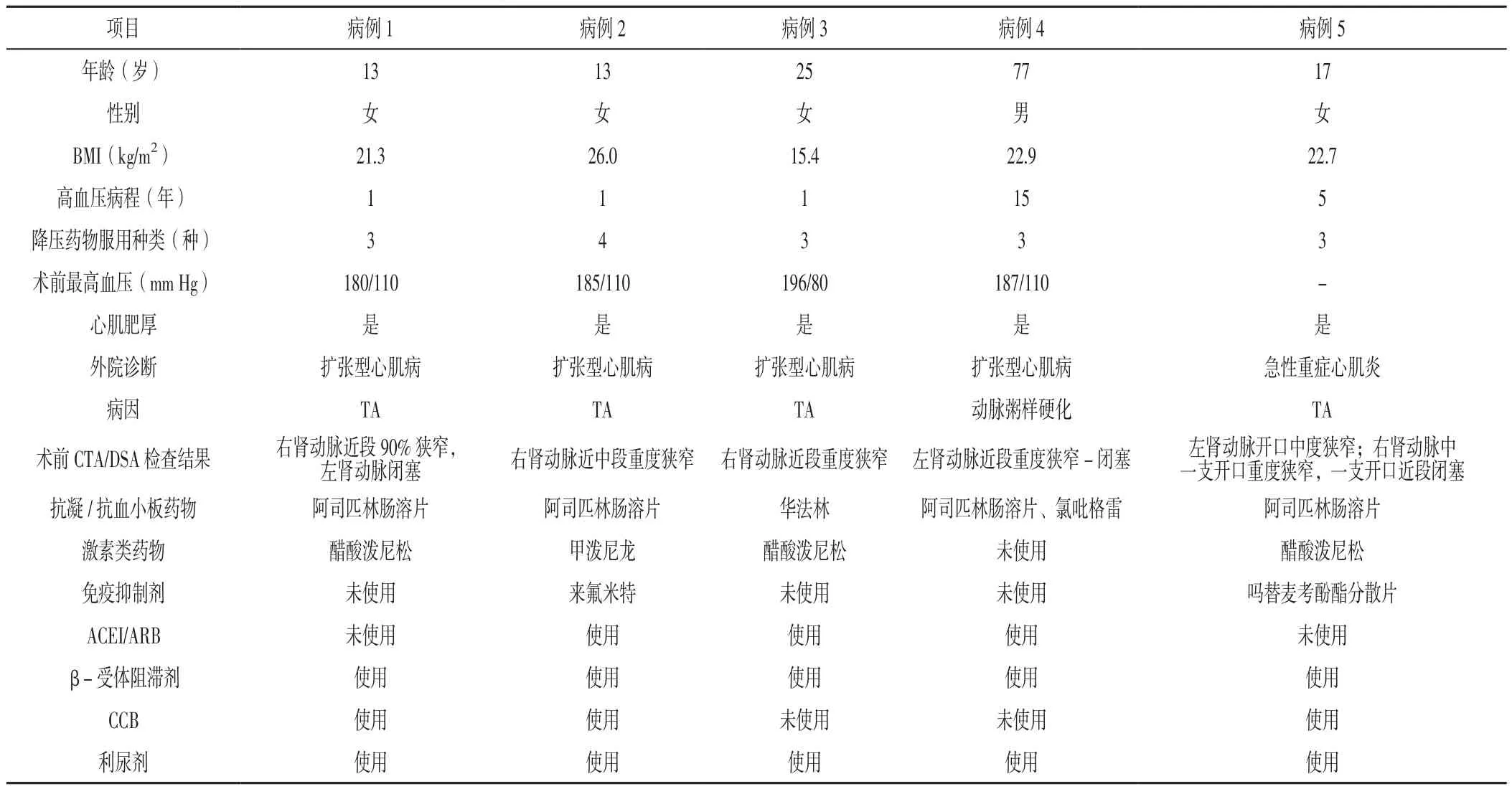
表1 5例患者的基线资料Table 1 Baseline of the 5 patients in this group
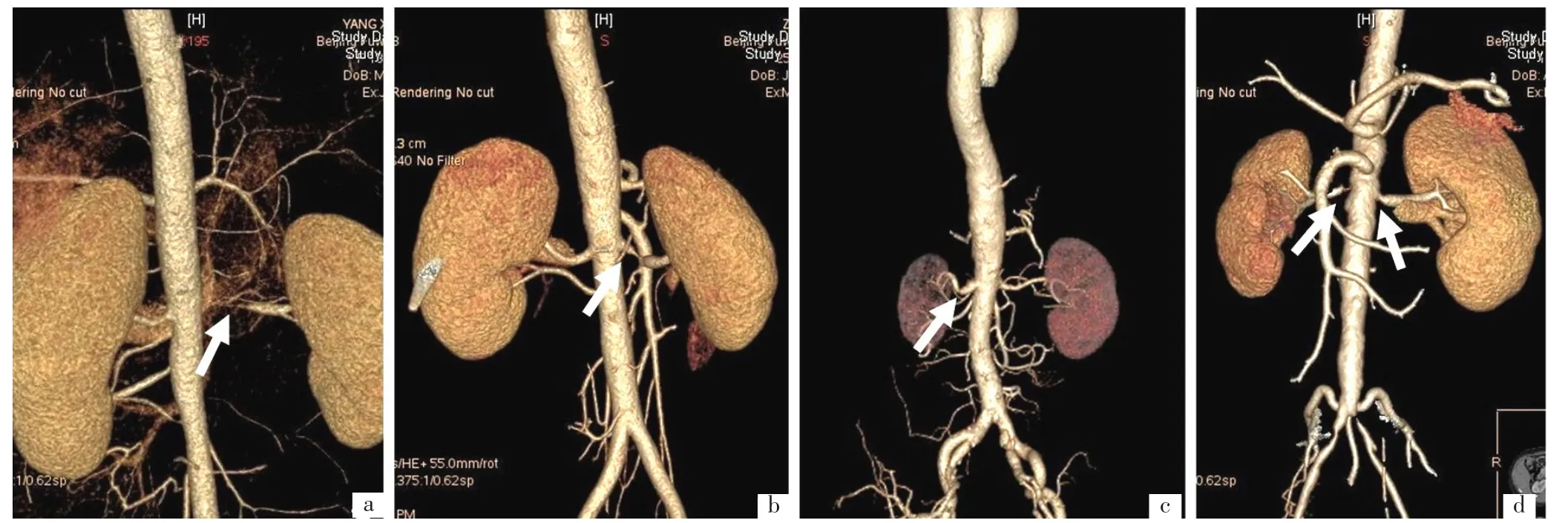
图1 病例2、3、4、5术前本院CTA检查结果Figure 1 Preoperative CTA examination results of the case 2,case 3,cases 4 and case 5 in our hospital
2.2 手术治疗情况 患者手术治疗情况见表2,肾动脉血运重建情况见图2。病例5在血运重建术后第4年再次出现心力衰竭症状,完善检查后发现肾动脉再狭窄,故其先后进行了2次肾动脉球囊扩张成形术。5例患者手术时间为17.0~60.0 min,X线曝光时间为10.0~31.0 min,其中病例1、2、3、5行肾动脉球囊扩张成形术,病例4行动脉球囊扩张成形术+肾动脉支架植入术。

表2 患者手术治疗情况Table 2 Surgical treatment of the patients
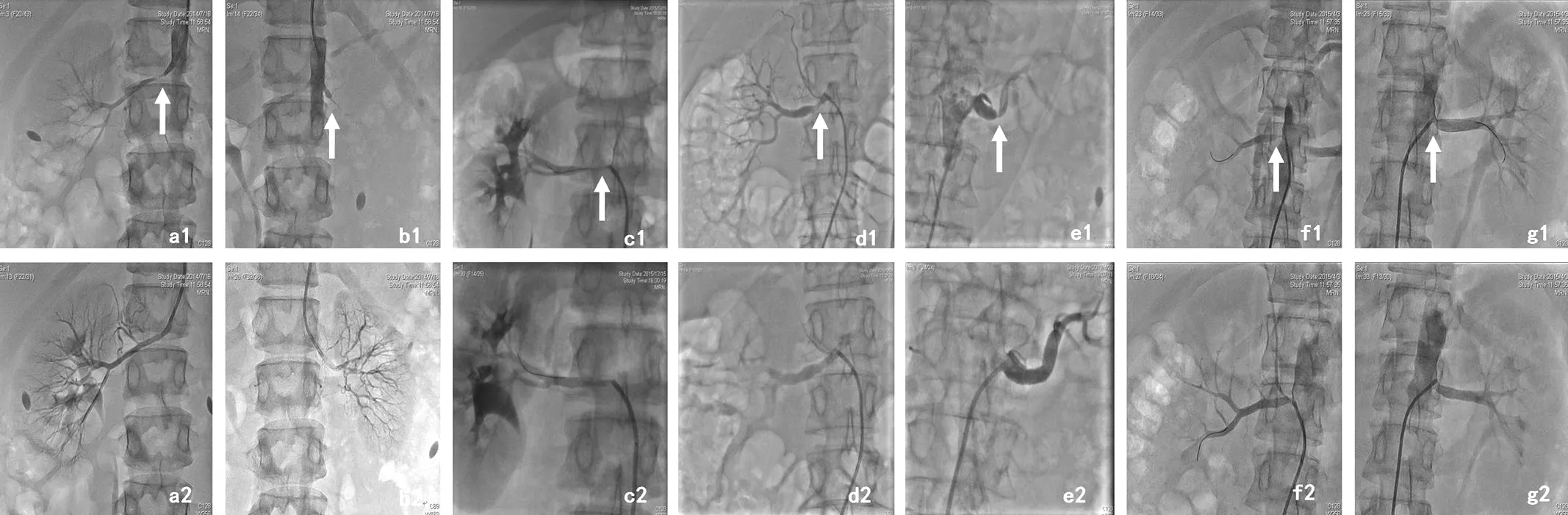
图2 患者肾动脉血运重建情况Figure 2 Renal arterial revascularization of the patients
2.3 术前及术后随访时相关指标 患者术前及术后随访时相关指标见表3。5例患者随访时24 h平均压下降,NYHA分级由术前Ⅲ~Ⅳ级恢复至Ⅰ~Ⅱ级,肌酐由术前 的 55.6~155.0 μmol/L 下 降 至 66.7~95.0 μmol/L,NT-proBNP 由术前的 1 071~35 000 ng/L 下降至 27~2 581 ng/L,LVEF由术前的25.0%~38.0%升高至47.0%~66.0%,LVM由术前的 188.1~354.3 g下降至 147.8~283.1 g,LVMI由术前的133.7~239.4 g/m2下降至 94.8~153.8 g/m2。
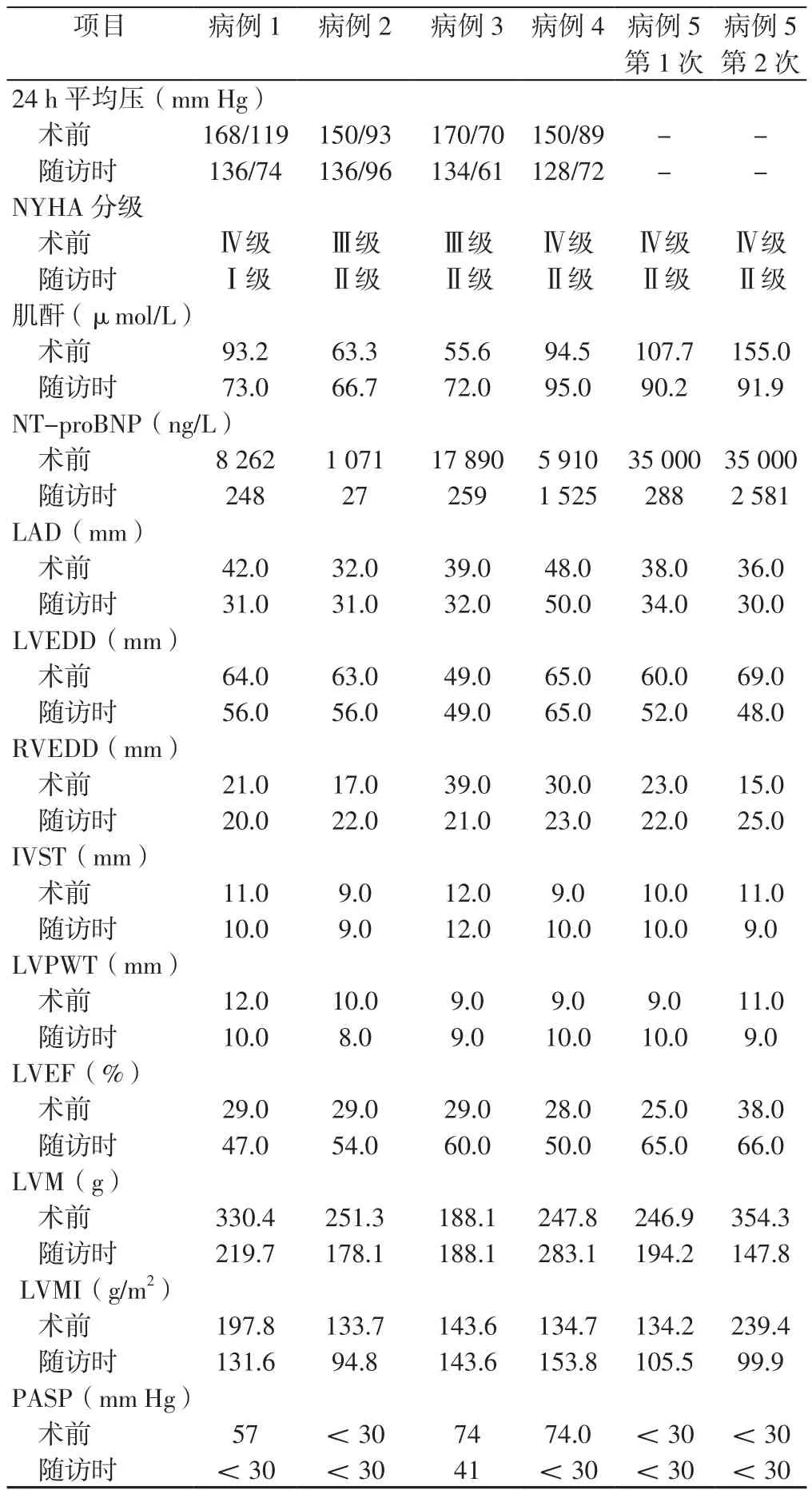
表3 患者术前及术后随访时相关指标Table 3 The related indexes before operation and during follow-up after operation
3 讨论
3.1 RAS致心力衰竭的研究现状 早在1998年,MACDOWALL等[12]发现34%的心力衰竭患者伴有RAS。而最近一项针对366例心力衰竭患者的研究显示,31%的患者伴有RAS,其中37%为双侧RAS[13];EPOCARES临床试验表明,56.8%的心力衰竭合并慢性肾脏病患者伴有RAS,其中38%为双侧RAS[14]。亦有研究表明,19.0%~37.6%的动脉粥样硬化性RAS患者患有心力衰竭,其心力衰竭患病率较无动脉粥样硬化性RAS患者增加3倍[5,15-16]。目前针对RAS致心力衰竭患者预后的研究有限,DE SILVA等[17]研究表明,患有RAS的心力衰竭患者死亡率较无RAS的心力衰竭者高(29%比10%)。RASHEF研究显示,心力衰竭患者RAS患病率为15%,且RAS与其较高的死亡率相关,RAS是心力衰竭患者全因死亡和心血管死亡风险的预测因子〔HR=4.2,95%CI(1.5,11.2),P=0.005;HR=3.5,95%CI(1.2,10.1),P=0.022〕[18]。可见RAS在心力衰竭患者中并不少见,并与其不良事件相关。本研究结果显示,在5例患者中有4例为青少年,且存在心肌肥厚,术前NYHA分级为Ⅲ~Ⅳ级。RAS所致RVH患者的临床表现并无特殊性,尤其是老年患者易被误诊为原发性高血压病,而忽视了RAS这一继发因素的筛查,而青少年及儿童因起病隐匿,平日疏于血压监测,易被忽视,出现症状时多已出现严重的靶器官损伤,易造成漏诊或诊断延迟,进而导致不良事件发生,甚至增加死亡风险,因此在临床上应注意这类疾病的筛查。
RAS所致RVH是继发性高血压的重要病因[19]。有研究显示,年龄>40岁的RAS患者的主要诱因为动脉粥样硬化(94.7%)[20]。因此,高血压既是肾动脉粥样硬化的危险因素,也是导致RAS的诱因,动脉粥样硬化所致RAS病变多位于肾动脉近端及开口[1]。儿童及青少年RAS患者的病因构成完全不同。北美及欧洲国家认为,儿童RAS最常见的病因为FMD,其次为神经纤维瘤病Ⅰ型(neurofibromatosis type 1,NF-1),而中国、印度及非洲国家的学者认为,TA是导致RAS的最常见病因[20-23]。有研究表明,TA主要累及主动脉一级分支及上、下肢大动脉近端,病变性质表现为狭窄、闭塞,可有血栓形成,病理提示动脉弥漫性不规则增厚及纤维化,伴炎性细胞浸润[24]。在本组病例中,4例青少年患者病因为TA,1例老年患者病因为动脉粥样硬化。
3.2 RAS致心力衰竭患者的临床特征及鉴别诊断 RAS致心力衰竭患者既往多伴有RVH,因血压难以控制而导致心肌肥厚、心脏舒张功能障碍,最终发展为心力衰竭。因此,针对该类患者除具有失代偿性心力衰竭的临床表现外,还存在3个典型特征:(1)难治性高血压:血压在使用3种及以上(包括利尿剂)降压药物最大剂量后仍不能控制达标;(2)心肌肥厚:心电图可见左心室高电压,超声心动图可见室间隔和/或左心室后壁增厚等室壁肥厚表现;(3)LVMI明显增加。本组患者均有难治性高血压病史,且存在左心室高电压及室壁肥厚,且LVMI明显增加。RAS致心力衰竭与心肌病致心力衰竭的鉴别诊断:(1)两种疾病患者均表现为咳嗽、气促、呼吸困难和不能平卧,但部分RAS致心力衰竭缓解期患者心功能可恢复正常。(2)RAS致心力衰竭患者多伴有难治性高血压,具有以下特点:年轻且严重的高血压;高血压发作突然,病程较短或发展迅速;高血压患者经ACEI治疗后肾功能恶化;严重高血压伴低钾血症;高血压伴腰背或胁、腹部疼痛;反复发作的肺水肿;有吸烟史,伴有冠状动脉、周围动脉的粥样硬化性病变;腹背部可闻及血管杂音。而心肌病致心力衰竭多因心功能恶化而出现低血压,甚至心力衰竭发作时需采用血管活性药物维持血压。(3)心脏结构异常:两种疾病患者的心脏结构改变有所不同。从超声心动图可见,RAS致心力衰竭患者表现为高血压性心肌改变,心电图可见左心室高电压,室间隔和左心室后壁对称性肥厚,室壁运动幅度多增大,升主动脉扩张,晚期出现心腔扩大,室壁肥厚。而扩张型心肌病致心力衰竭患者主要表现为心腔扩大,左心室球形变,室壁运动幅度减小,相对室壁薄,瓣口开放幅度小;肥厚型心肌病致心力衰竭患者则以左心室心肌受累为著,左心室心肌某节段或多个节段室壁厚度≥15 mm,左心室收缩期内径缩小,严重者心腔可成闭塞样改变,部分患者存在不同程度梗阻,伴有心功能不全时心腔可扩张[25]。(4)合并其他血管受累表现:针对RAS致心力衰竭患者,以动脉粥样硬化为病因的患者可能存在动脉粥样硬化的危险因素如糖尿病、高脂血症和吸烟等,可同时合并冠心病及其他周围血管疾病;以TA或FMD为病因的患者通常发病年龄较小,有颈动脉、锁骨下动脉等其他血管受累典型表现。而心肌病致心力衰竭患者通常无其他血管受累表现。(5)治疗方面:心肌病致心力衰竭患者的治疗目标是改善临床症状和生活质量,预防或逆转心脏重构,降低再住院率及死亡率[3]。药物治疗主要包括尽早使用肾素-血管紧张素系统抑制剂和β-受体阻滞剂,有淤血症状和/或体征的心力衰竭患者应使用利尿剂以减轻水钠潴留,其他治疗包括醛固酮受体拮抗剂、伊伐布雷定的使用,若符合心脏再同步化治疗(cardiac resynchronous therapy,CRT)和/或植入式心脏复律除颤器(implantable cardioverter defibrillator,ICD)适应证,应予以推荐。经以上治疗后病情仍进展至终末期心力衰竭的患者,需根据病情选择心脏移植、姑息治疗、左心室辅助装置的治疗。本研究结果显示,5例患者血运重建术后临床症状明显改善,NYHA分级由术前Ⅲ~Ⅳ级恢复至Ⅰ~Ⅱ级,表明血运重建术可改善RAS致心力衰竭患者可改善心功能。
3.3 RAS致心力衰竭的治疗 RAS致心力衰竭患者的治疗包括药物治疗及血运重建术,其中药物治疗主要针对高血压及心力衰竭症状的治疗。在患者治疗过程中,应注意ACEI的使用,且在使用过程中需密切监测肾功能,其中双侧RAS患者在使用ACEI期间易出现无尿或肾功能急剧恶化等不良事件,因此该类患者需慎用。血运重建术的主要目的是降血压,预防并发症,改善肾功能及治疗RAS严重的病理生理效应,包括心力衰竭、肺水肿和心绞痛,甚至有可能免于透析;次要目的是减少降压药的使用,尤其推荐慢性心力衰竭或心肌病患者使用[26-27]。RAS致心力衰竭患者的血运重建术主要包括肾动脉介入治疗(肾动脉球囊扩张成形术、肾动脉支架植入术)和外科手术治疗。儿童和青少年RAS致心力衰竭患者主要以TA、FMD、NF-1为病因,发病早期隐匿且呈进行性发展,可发展为肾动脉闭塞或产生不可逆的肾功能损伤,目前临床常推荐及早行动脉球囊扩张成形术治疗。单纯动脉球囊扩张成形术可反复进行,可较好地解决肾动脉再狭窄问题。动脉支架植入术一般用于严重病变扩张后造影效果欠佳、复发病变或扩张后出现动脉夹层的青少年RAS患者[28]。在临床实际操作中,需严格把控动脉支架植入术适应证,一旦发生支架内再狭窄,则会进一步增加治疗难度。目前动脉球囊扩张成形术治疗儿童和青少年RAS致心力衰竭的成功率不尽相同,可能与不同研究的样本量、病因、病变分布及病变进展存在差异有关[29],可比性较差。但针对动脉粥样硬化性RAS的血运重建尚存在争议,一般认为有血流动力学意义的RAS、进展性高血压、难治性高血压、恶性高血压、高血压伴不易解释的单侧肾脏缩小、不能耐受降压治疗的高血压患者可考虑行血运重建术,而手术效果受术者的技术水平、血管病变条件等多因素影响,BAX等[30]研究表明,动脉支架植入术并不能对动脉粥样硬化性RAS患者的肾功能产生明显影响,反而出现了手术并发症。另有研究显示,与药物治疗相比,血管成形术治疗对动脉粥样硬化性RAS患者的血压和肾功能并未产生较好的效果,但可降低肺水肿复发率,缓解心力衰竭症状[31]。本研究结果显示,病例1、2、3、4术前及术后肌酐水平均处于参考范围,病例5术前肌酐水平虽有异常,但经肾动脉球囊扩张成形术后恢复正常,推测介入治疗会改善RAS致心力衰竭患者的肾功能,但可能受病程、RAS严重程度、是否双侧RAS等多种因素影响,因此还需延长随访时间的大规模研究进一步验证。
综上所述,RAS致心力衰竭起病隐匿,且患者临床症状无特异性,但对于伴有难治性高血压、心肌肥厚、LVMI明显增加的患者应进一步筛查继发性高血压因素,而采用肾动脉血运重建术治疗可有效改善其心功能。本研究为单中心的回顾性研究,且样本量小,结论还有待于更大规模的病例研究进行验证。
作者贡献:王倩、蒋雄京、宋雷、邹玉宝进行文章的构思与设计;王倩、何际宁、陈阳、董徽进行研究的实施与可行性分析,数据收集、整理、分析,结果分析与解释;王倩撰写论文;邹玉宝进行论文的修订;王倩、邹玉宝负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

