连翘叶连翘苷提取物对高脂饮食诱导 大鼠肥胖的预防作用
王 静,黄庆辰,高敏玥,朱小盼,陈子彤,王少康*,孙桂菊
(东南大学公共卫生学院,环境医学工程教育部重点实验室,江苏 南京 210009)
植物连翘(Forsythia suspensa(Thunb.) Vahl)属木犀科落叶开花灌木,主要产于山西、河南、山东和陕西等地[1]。连翘果是植物连翘的果实,有青翘和老翘两种,青翘是在尚未成熟时采下的果实,老翘是在果实成熟、果壳裂开时采下的果实,连翘作为中药材在我国已有悠久的历史,具有清热解毒、散结消肿等功效[2-4]。连翘叶是植物连翘的叶子,目前在连翘叶中已经有200多种化学成分被分离提取出来,有效成分包括连翘苷、连翘酯苷、绿原酸和芦丁等[5-6],具有抗菌抗炎、抗氧化、抑制人食管癌细胞的增殖和神经保护等作用[7-11]。连翘苷是连翘叶的有效成分,也是主要成分之一,已有研究表明,连翘苷对营养性肥胖小鼠具有减肥作用,能够使肥胖小鼠体质量增长率降低,脂肪湿质量减轻,脂肪系数变小[12-13]。近年来对连翘果实资源的开发比较广泛,而连翘叶资源一直被大量浪费,但经研究证实,连翘叶中连翘苷的含量比老翘高40 倍,比青翘高2~4 倍[14]。连翘叶在民间有食用习惯和历史记载,山西省疾病预防控制中心进行的连翘叶急性经口毒性实验、90 d经口毒性实验等6 项毒性研究结果表明连翘叶具有食用安全性[15]。因此,2017年 原国家卫生和计划生育委员会批准连翘叶新食品原料 终止审查,同时山西省颁布了DBS14/001—2017《食品安全地方标准 连翘叶》,在全国首先将连翘叶列入食品范畴,进行管理[16]。
长期高脂高糖饮食可导致肥胖,肥胖在临床上被称为一种代谢综合征,通常是由于能量消耗、能量摄入和能量储存之间的不平衡造成的。肥胖可导致高血压、血脂异常、内分泌代谢紊乱,同时还是癌症、肾脏疾病等的诱发因素。目前大多数患者会选择节食、减肥药物甚至减肥手术来控制肥胖,但节食可能会损伤认知功能,而减肥药物具有很多副作用,如肺动脉高压、中风、心血管疾病、神经精神疾病等,施行减肥手术的减肥效果显著,也能降低减肥药物所引起的疾病和死亡,但手术带来的风险不容忽视[17-19]。因此,寻找绿色、天然、安全、高效的减肥或预防肥胖的产品具有十分重要的意义,天然植物和植物化学物成本较低且副作用可 忽略[20-21],对其研究越来越多。本研究通过探讨连翘叶中连翘苷提取物对高脂饮食诱导大鼠肥胖的预防作用,有助于连翘叶资源的开发利用,同时也为连翘叶保健功能的开发提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性SD大鼠65 只,体质量(200±10)g,购自浙江省医学科学院,生产许可证编号:SCXK(浙) 2019-0002;动物使用许可证编号:SYXK(苏)2016-0014; 本次动物实验在东南大学实验动物中心进行,已获得东南大学实验动物伦理审查委员会批准(伦理审批号:20190805009)。
连翘叶由山西惠源四海农业科技有限公司提供,全部采自山西阳泉里洪水村。基础饲料和高脂饲料由苏州双狮实验动物科技有限公司提供。
连翘苷标准品(纯度≥98%) 北京世纪奥科生物技术有限公司;总胆汁酸(total bile acid,TBA)试剂盒 南京建成生物工程研究所;瘦素(leptin,LP)、游离脂肪酸(free fat acid,FFA)试剂盒、质量分数4%多聚甲醛通用型组织固定液 南京金益柏生物科技有限 公司;苏木精-伊红染液(hematoxylin-eosin,HE) 珠海贝索生物技术有限公司。水为超纯水,甲醇为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
FW80高速万能粉碎机 天津市泰斯特仪器有限 公司;电子天平 梅特勒-托利多(上海)仪器有限公司; 旋转蒸发仪、油浴锅 上海爱朗仪器有限公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限 公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;1260 LC高效液相色谱仪 美国安捷伦科技公司;BX51T-PHD-J11显微镜 日本奥林巴斯公司;ELx800光吸收酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 连翘苷提取物的制备
连翘苷提取物由本实验室自制,制备过程:将连翘叶粉碎后取适量加20 倍体积水,90 ℃下提取2 次,每次60 min,收集2 次浸提液,离心后取上清液,然后经旋转蒸发仪浓缩,冷冻干燥成粉状(经高效液相色谱仪检测,其中连翘苷质量分数为13.3%),以备后续动物实验用。
1.3.2 动物饲养、分组及干预
SD大鼠饲养于SPF级动物实验室,室温20~26 ℃,相对湿度45%~65%,明暗交替12 h,保持良好的通风。65 只大鼠自由摄食和饮水,适应性喂养基础饲料7 d后,按体质量随机分组:空白对照组(8 只)和肥胖模型组(57 只)。空白对照组饲喂基础饲料,肥胖模型组饲喂高脂饲料,喂养2 周后,给予高脂饲料的57 只大鼠按体质量增加量排序,淘汰体质量增加量较低的17 只肥胖抵抗大鼠。
将筛选出的40 只肥胖敏感大鼠按体质量随机分成5 组,分别为模型对照组和连翘苷提取物低、中、高剂量组,根据国家食品药品监督管理局国食药监保化(2012)107号文件以及《保健食品功能评价指导原则(2020年版)(征求意见稿)》,各种动物实验至少应设3 个剂量组,剂量选择应合理,尽可能找出最低有效剂量。故本实验以连翘苷人体推荐摄入量的5、10、30 倍分别作为低、中、高剂量组;又根据DBS14/001—2017规定,成人干制连翘叶每日推荐食用量不高于6 g/d,因此低、中、高3 个剂量组按连翘叶质量计,分别为0.5、1、3 g/(kgmb·d)。根据前期本实验室测得连翘叶中连翘苷质量分数为5.32%,连翘苷提取物中连翘苷质量分数为13.3%,因此低、中、高剂量组所需连翘苷提取物0.2、0.4、1.2 g/(kgmb·d),即连翘苷剂量分别为26.6、53.2、159.6 mg/(kgmb·d),同时设置标准品组(连翘苷标准品(连翘苷质量分数按98%计)54.3 mg/(kgmb·d), 与中剂量组干预物中的连翘苷剂量相同)。给予高脂饲料,空白对照组和模型对照组灌胃等量的蒸馏水,大鼠灌胃量为2 mL/200 g。每天定时灌胃1 次,持续灌胃6 周。实验期间每天记录给食量和撒食量,每周记录剩食量,每周称量体质量1 次,根据体质量调整灌胃量。
1.3.3 动物实验解剖和组织取材
在干预第6周末,禁食12 h,称量体质量,将大鼠平摊仰卧,用卷尺准确测量鼻尖到肛门的长度作为体长,对大鼠进行股动脉取血,离心取上层血清,于-80 ℃冰箱保存备用。再将大鼠进行二氧化碳吸入处死,解剖取肾周脂肪、睾周脂肪,用生理盐水冲洗,滤纸吸干水分,分别称质量并记录,取睾周脂肪同一部位用质量分数4%的多聚甲醛通用型组织固定液固定,以待后续病理切片观察,其余放-80 ℃冰箱保存备用。
1.3.4 指标的测定
1.3.4.1 摄食量
根据实验期间记录的给食量、撒食量和剩食量,按照公式(1)计算摄食量。
1.3.4.2 肥胖指数(Lee’s指数)
根据实验期间记录的大鼠体质量和体长按照公 式(2)计算Lee’s指数。
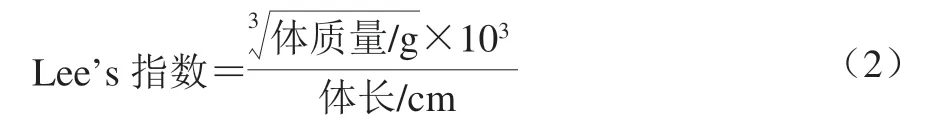
1.3.4.3 肾周、睾周、内脏脂肪系数
肾周、睾周和内脏脂肪系数分别为肾周脂肪质量、睾周脂肪质量、内脏脂肪质量(肾周脂肪质量和睾周脂肪质量之和)与大鼠体质量之比。
1.3.4.4 血清生化指标的检测
用全自动生化分析仪测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度 脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平;TBA水平按照试剂盒要求进行测定;LP、FFA水平按照酶联免疫吸附检测试剂盒要求进行测定。
1.3.4.5 脂肪组织病理切片
脂肪组织采用HE染色,经显微镜镜检和图像采集分析,观察病理组织学变化。
1.4 数据统计分析
采用SPSS 26.0软件进行统计处理,数据均以平均值± 标准差表示,采用LSD检验进行ANOVA方差分析,方差不齐时采用Kruskal-Wallis非参数检验,并用中位数(四分位间距)表示,P<0.05为差异显著。
2 结果与分析
2.1 连翘苷提取物对各组大鼠摄食量和体质量的影响
实验期间各组大鼠摄食量之间无显著性差异 (P>0.05),说明连翘苷提取物对大鼠摄食量无影响。各组大鼠体质量变化见表1,可以看出,模型对照组与空白对照组的体质量相比,均有显著性差异(P<0.05),表明高脂饮食诱导大鼠肥胖成功。实验干预前4 周,各组大鼠体质量逐渐增加,模型对照组与各干预组之间体质量无显著性差异(P>0.05)。干预第5周时,与模型对照组相比,中剂量组、高剂量组和标准品组的体质量分别降低了5.56%、6.24%、5.72%,第6周时,分别降低了7.94%、8.50%、7.98%,差异均具有显著性 (P<0.05)。其中高剂量组体质量减少幅度最大,而中剂量组和标准品组体质量减少幅度相差不大,且无显著性差异(P>0.05),可能是由于中剂量组和标准品组的连翘苷含量相似,从而使预防肥胖的效果相当。

表 1 各组大鼠体质量的变化(n=8)Table 1 Changes in body mass of rats in each group (n = 8)
2.2 连翘苷提取物对肥胖大鼠Lee’s指数的影响
Lee’s指数是评价肥胖程度的指标[22],如表2所示,各组之间体长无显著性差异(P>0.05),表明连翘苷提取物对大鼠体长无影响。与空白对照组相比,模型对照组的Lee’s指数显著大于空白对照组(P<0.05);与模型对照组相比,高剂量组的Lee’s指数降低了4.18%,且具有显著性差异(P<0.05),标准品组与中剂量组的Lee’s指数相比无显著性差异(P>0.05)。

表 2 连翘苷提取物对肥胖大鼠Lee’s指数的影响(n=8)Table 2 Effect of forsythin extract on Lee’s index of obese rats (n= 8)
2.3 连翘苷提取物对肥胖大鼠内脏脂肪含量的影响

表 3 连翘苷提取物对肥胖大鼠内脏脂肪含量的影响(n= 8)Table 3 Effect of forsythin extract on visceral fat contents in obese rats (n= 8)
如表3所示,模型对照组内脏脂肪质量及其系数显著大于空白对照组(P<0.05),说明高脂饮食诱导大鼠肥胖成功。同时,与模型对照组相比,中、高剂量组能够使大鼠内脏脂肪质量及其系数降低,差异均具有显著性(P<0.05),说明连翘苷提取物能够改善肥胖大鼠内脏脂肪蓄积的现象,而且剂量越高,效果越好。此外,中剂量组和标准品组内脏脂肪质量和内脏脂肪系数差异不显著(P>0.05),说明中剂量组和标准品组的干预效果相当。
2.4 连翘苷提取物对肥胖大鼠血清生化指标的影响
实验干预6 周后,大鼠血清生化指标的变化如表4所示,模型对照组的TC、LDL-C、TBA、LP和FFA水平比空白对照组高,且具有显著性差异(P<0.05)。与模型对照组相比,连翘苷提取物能够降低肥胖大鼠的TC、LDL-C、LP和FFA水平,且具有显著性差异 (P<0.05),说明连翘苷提取物能够改善高脂饮食诱导的大鼠血脂紊乱的现象。还发现中剂量组与标准品组降低TC、LDL-C、LP水平的效果差异不显著(P>0.05),说明两组干预效果相似。

表 4 连翘苷提取物对肥胖大鼠血清生化指标的影响(n=8)Table 4 Effect of forsythin extract on serum biochemical indexes in obese rats (n = 8)
2.5 连翘苷提取物对肥胖大鼠脂肪组织的影响

图 1 HE染色大鼠睾周脂肪组织切片Fig. 1 Pathological sections of testis tissue from rats stained by hematoxylin-eosin stainning

表 5 连翘苷提取物对肥胖大鼠脂肪细胞当量直径、周长和面积的 影响(n= 6)Table 5 Effect of forsythin extract on equivalent diameter, circumference and area of adipocytes in obese rats (n = 6)
如图1及表5所示,在相同显微镜视野下,模型对照组与空白对照组相比,脂肪细胞数量减少,脂肪充盈,细胞膨大,且脂肪细胞当量直径、周长和面积显著大于空白对照组(P<0.05)。连翘苷提取物低、中、高剂量组较模型对照组有所改善,可见脂肪细胞数量增加,脂肪细胞变小,但低剂量组效果不明显,高剂量组效果最显著,且与模型对照组相比,低剂量组脂肪细胞的面积 显著减小(P<0.05),中剂量组脂肪细胞的周长和面积显著减小(P<0.05),高剂量组脂肪细胞的当量直径、周长和面积显著减小(P<0.05)。标准品组与中剂量组的干预效果较为相似,可见脂肪细胞数量、大小较为接近。
3 讨 论
连翘叶作为新食品原料,在食品领域应用逐渐广泛,民间已炮制出连翘红茶、绿茶等,此外还有连翘凉茶、天然食品防腐剂和新型抗氧化剂等[23-26]。本研究用连翘叶制备连翘苷提取物,探讨其对高脂饮食诱导大鼠肥胖的预防作用,为连翘叶保健功能的开发提供科学依据。
近年来,肥胖已经成为人们日益关注的重点,1975—2016年,全球儿童和青少年的平均体质指数(body mass index,BMI)和肥胖患病率呈上升趋势,2015年共有1.077亿肥胖儿童和6.037亿肥胖成人,其造成的疾病负担也迅速增加,据统计,高BMI在1990—2015年 导致全球400万 人死亡[27-28]。随着中国经济的发展,中国居民的膳食结构比例也发生了变化,伴随而来的是中国居民疾病谱也发生了变化,无论是成人还是儿童青少年,超重肥胖率均呈现上升趋势,18岁及以上居民平均血压、血糖、TC和TG水平均呈上升趋势[29-30]。
本研究进行6 周干预实验后,发现模型对照组的TC、LDL-C、TBA、LP、FFA水平,相同显微镜视野下脂肪细胞数量及大小、内脏脂肪质量及其系数、Lee’s指数、体质量均显著高于空白对照组,说明高脂饮食诱导大鼠肥胖成功。肥胖患者往往伴随着血脂水平的改变,通常是TG、TC、LDL-C水平升高,HDL-C水平降低[31-33]。本研究发现,模型对照组的TC、LDL-C、TBA、LP、FFA水平明显高于空白对照组,说明高脂饮食会造成体内TC、LDL-C、TBA、LP、FFA水平的升高,还发现高剂量组降低肥胖大鼠TC和LDL-C的效果最明显,中剂量组与标准品组干预效果较为接近,可能是由于两组中所含连翘苷含量相似。但不同剂量组与模型对照组相比,血清TG和HDL-C水平差异不显著,可能是因为实验干预时间为6 周,还不足以使大鼠的血清TG和HDL-C水平发生显著变化。连翘苷提取物还能够降低肥胖大鼠血清LP水平,而对于血清FFA水平,高剂量可能会降低其水平,低、中剂量似乎对肥胖大鼠血清FFA水平没有明显影响。此外,脂肪组织病理结果显示各剂量组较模型对照组脂肪细胞数量增加,脂肪细胞变小,但低剂量组效果不明显,高剂量组效果最显著,中剂量组和标准品组效果较接近。
研究还发现中、高剂量连翘苷提取物能够明显降低肥胖大鼠的体质量,并使肥胖大鼠的Lee’s指数、内脏脂肪系数减小,且对摄食量没有影响,说明连翘苷提取物可能具有安全性;此外还发现连翘苷提取物高剂量组预防肥胖的效果优于中剂量组,而标准品组和中剂量组干预效果 相当,说明连翘苷提取物中连翘苷含量越高,预防肥胖的效果越好,相同剂量的连翘苷可能预防肥胖的效果也相当,此外研究没有发现连翘苷提取物低剂量组对高脂饮食诱导大鼠肥胖的预防作用,可能是由于低剂量组连翘苷含量较低。与赵咏梅等[12]的研究相比,本实验从预防肥胖的角度出发,探究更加全面,同时也通过中剂量组和标准品组的对比,证明了是连翘叶中的连翘苷对高脂饮食诱导大鼠肥胖具有预防作用。
4 结 论
连翘叶中连翘苷提取物通过控制肥胖大鼠的TC、LDL-C、LP和FFA水平的升高,改善肥胖大鼠的血脂水平,并且减缓脂肪组织细胞的增长,降低肥胖大鼠的内脏脂肪质量及其系数、Lee’s指数和体质量,能够预防高脂饮食诱导的大鼠肥胖,连翘叶中的连翘苷是其中的功能性成分。该研究证实了连翘叶中连翘苷提取物可作为绿色、天然、安全、高效的预防肥胖的食品,为连翘叶资源的深入开发利用和连翘叶保健功能的开发提供科学依据。

