果蔬中外泌体样纳米颗粒的分离、表征 和应用研究进展
杨梦楠,刘诗琦,张 静,冉龙奕,陈忠加,马 超,*
(1.北京林业大学生物科学与技术学院,北京 100083;2.北京林业大学工学院,北京 100083)
2013年,诺贝尔生理学或医学奖授予了James E. Rothman、Randy W. Schekman和Thomas C. Südhof 3 位科学家,以表彰他们在细胞囊泡运输的调控机制方面做出的突出贡献。外泌体作为细胞囊泡的重要一员,相关研究亦受到广泛关注,研究人员相继从人、鼠、牛等动物的 组织或细胞中分离鉴定出了外泌体[1-2]。2013年,Ju Songwen等[3]通过差速离心和蔗糖梯度离心相结合的方法首次从葡萄中分离、纯化出了大量50~300 nm的囊泡状结构,并将这种由植物细胞分泌至胞外的类似于动物外泌体的囊泡称为外泌体样纳米颗粒(exosome-like nanoparticles,ELNs),其与外泌体结构相似,且均含有蛋白质、脂质和RNA成分。之后,科学家相继对生姜、葡萄柚、梨、柠檬等数十种果蔬中的ELNs进行了分离、纯化和鉴定,对其结构和化学组成进行了表征,并对其生理功能进行了评价,发现果蔬来源的ELNs具有维持肠道稳态等多种独特的生理活性,并具有递送药物的潜在载体功能,显示出了广阔的应用前景。
1 外泌体的形成过程
细胞外囊泡(extracellular vesicles,EVs)是指由脂质双层膜包裹的细胞外结构[4],在细胞间的通讯中发挥着重要作用。EVs主要包括微泡、凋亡小体和外泌体(exosome)三大类。微泡的直径在100~800 nm之间,主要由细胞膜通过出芽的方式形成。凋亡小体的粒径不均,直径在500~1200 nm之间,主要在细胞凋亡过程中通过发芽、起泡等方式形成[5]。外泌体的直径为30~150 nm,由磷脂双分子层包裹,其释放过程是先由细胞膜向内凹陷形成早期内体,早期内体逐渐成熟后成为晚期内体,晚期内体的膜向内凹陷形成多个管腔囊泡,进而发展为多泡体(multivesicular body,MVB),MVB与细胞质膜融合,最终形成外泌体释放到细胞外[6](图1)。与微泡和凋亡小体相比,外泌体携带了更多的细胞通讯信息,包括蛋白质、脂质和RNA等[7]。研究表明,植物细胞中的纳米囊泡具有与动物细胞外泌体相似的生物学特性,通过内体、多泡体衍生到细胞外,这种机制已通过原位固定后的葡萄切块的结构分析及其蛋白组学分析进行了证实。进一步对衍生的纳米囊泡进行粒径、结构和化学组成分析来鉴定ELNs[3]。
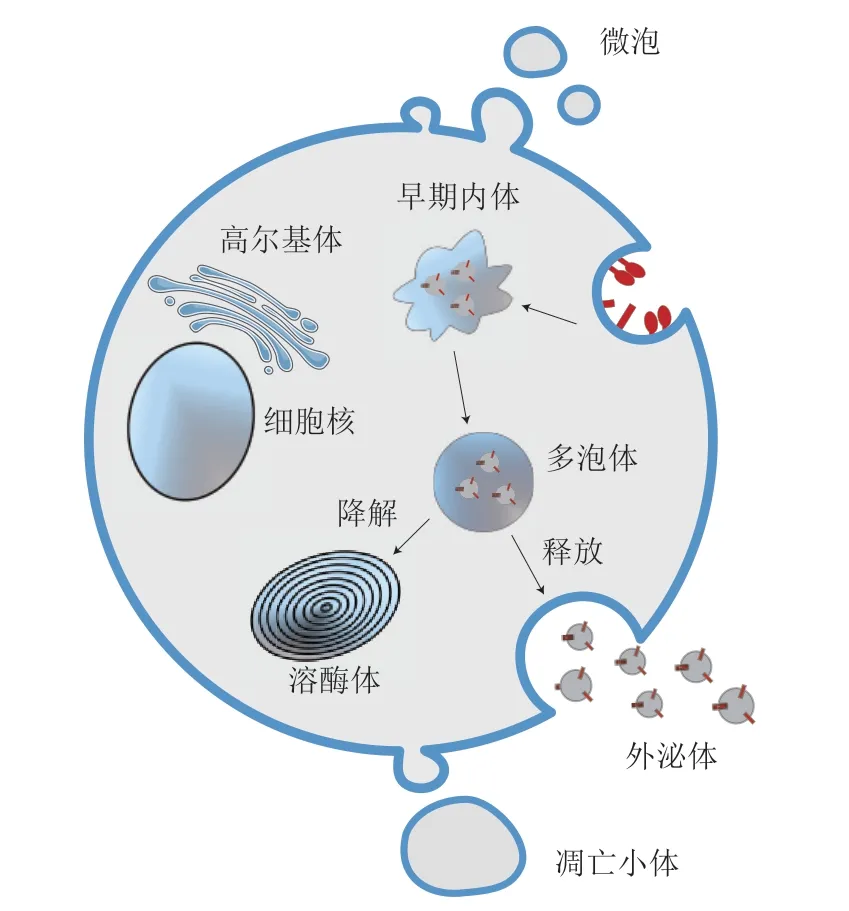
图 1 外泌体的形成及释放过程[7]Fig. 1 Formation and release of exosomes[7]
2 果蔬中ELNs的分离及表征方法
2.1 果蔬中ELNs的分离方法
目前,动物来源的外泌体通常采用离心法[8]、超滤法[9]、 排阻色谱法[10]、免疫亲和法[11]、聚合物沉淀法[12]以及微流控技术[13-14]等方法分离。离心法是根据外泌体的密度和尺寸进行分离的一种方法,目前最为常用,该方法不受样本容量的限制,提取得到的外泌体纯度较高,但操作复杂、费时费力[8]。超滤法和排阻色谱法都是基于外泌体尺寸的分离方法,其中超滤法可以在较低的速度下完成分离,但是大量的囊泡和蛋白质可能会堵塞滤膜,降低提取效率[9];排阻色谱法由于不受剪切力的影响,得到的纳米颗粒形态较为完整,但是因为凝胶柱对样品体积有严格的限制,该方法只适用于体积较小的样品[10]。免疫亲和法是基于抗原、抗体特异性结合的原理,利用外泌体表面特有的蛋白质实现对外泌体的分离[11],但由于基质的非特异性吸附会使外泌体中含有较多的杂蛋白,导致提取得到的外泌体不纯。一般认为,聚合物沉淀外泌体的机理是聚合物通过“劫持”水分子,降低外泌体的溶解度,然后在低速离心下使外泌体沉淀,该法在试剂盒中应用广泛[12],目前常用的聚合物是聚乙二醇,然而该方法沉降外泌体的同时也会将蛋白质沉降下来,影响外泌体的纯度,同时聚合物也难以除去,影响下游分析。基于微流体的外泌体分离技术主要分为基于外泌体物理特性(粒径、密度、表面电荷)和基于生物标记的方法[13],该技术成本低、产品纯度高、操作时间短。不同的分离方法对原料要求不同,且对外泌体产物的形态和纯度等有一定的影响。因此,实际工作中通常根据外泌体的来源及研究分析的需求而选用不同的分离方法。果蔬中ELNs的分离可以借鉴动物组织中外泌体的分离方法,但鉴于果蔬的来源广泛、成本低廉,多选用离心法对其中的ELNs进行分离和纯化。与其他方法相比,离心法可以分离得到纯度更高、形态更好的ELNs,且适合于稍大规模的制备。迄今为止,尚未见到超滤法、排阻色谱法、免疫亲和法、聚合物沉淀法以及微流控技术应用于果蔬中ELNs的制备和纯化的相关报道。
离心法包括差速离心法和密度梯度离心法。差速离心法是通过逐步提高离心速度,依次去除较大的颗粒,最终通过超高的离心速度得到ELNs[15-16]。目前,差速离心法已被用于生姜、蓝莓、椰子、葡萄柚、哈密瓜、奇异果、橙子、梨、番茄、豌豆等果蔬中ELNs的分离和纯化(表1)。通常,椰子等可以直接取汁;汁液丰富的果蔬,如蓝莓、葡萄柚、橙子、梨等,可直接去皮榨汁;而对汁液含量较少的果蔬,如哈密瓜、奇异果、番茄、豌豆、生姜等,可在去皮后与磷酸盐缓冲液(phosphate buffered saline,PBS)混合研磨取汁。 收集到的果蔬汁通常先在4 ℃下依次差速离心,如1200×g离心20 min、3000×g离心20 min、10000×g离心60 min,每次离心后收集上清液,去除含有大量纤维颗粒的沉淀物,然后将上清液在4 ℃、150000×g的条件下超速离心90 min,收集沉淀,并将沉淀重悬于PBS中得到ELNs[17]。如果需要进一步纯化,可在差速离心基础上对得到的ELNs再次进行密度梯度离心。如Mu Jingyao等[18]首先采用差速离心法从葡萄、葡萄柚、生姜、胡萝卜4 种果蔬中提取得到了ELNs的粗提物,然后将其重悬后转移至不同质量分数的不连续蔗糖介质中(8%、15%、30%、45%和60%),在4 ℃、150000×g条件下超速离心2 h,收集8%与15%、15%与30%、30%与45%蔗糖梯度层之间的条带,经PBS稀释后于4 ℃、150000×g条件下再次超速离心2 h,洗去蔗糖溶液,最终将得到的沉淀重悬于PBS中得到高纯度的ELNs。
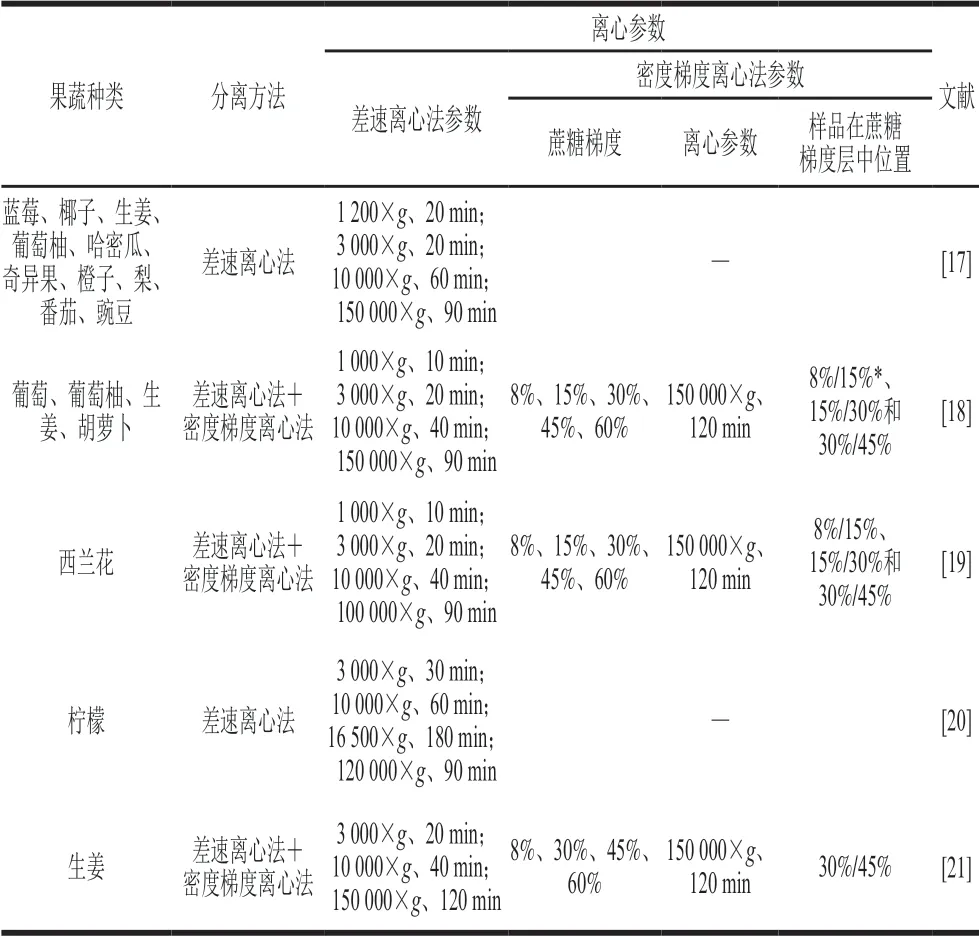
表 1 不同果蔬中ELNs的分离纯化方法Table 1 Existing methods for separation and purification of ELNs from different fruits and vegetables
2.2 果蔬中ELNs的表征方法
果蔬中ELNs的超微结构和粒径的表征可以借鉴动物来源外泌体的表征方法。图2列出了6 种果蔬中ELNs的超微结构表征[18-20]。ELNs的超微结构通常借助于透射电子显微镜(transmission electron microscope,TEM)、扫描电子显微镜(scanning electron microscope,SEM)或原子力显微镜(atomic force microscopy,AFM)等手段进行表征,如采用AFM对蓝莓、椰子、番茄等果蔬中的ELNs进行观察,发现这些果蔬中的ELNs主要呈圆形或椭圆形的囊泡结构[17],与动物来源外泌体的超微结构类似;采用TEM对从葡萄柚、葡萄、生姜、胡萝卜中分离得到的ELNs经负染后观察,发现视野中有大量 30~200 nm的囊泡,并呈现典型的茶托型或一侧凹陷的半球形结构[18]。外泌体的粒径通常采用动态光散射(dynamic light scattering,DLS)或纳米粒径跟踪分析仪(nanoparticle tracking analysis,NTA)进行表征。这两种方法都是利用光学手段来分析囊泡的粒径分布,但DLS是通过检测散射光强度反映纳米粒子的粒径[22],而NTA是通过跟踪单个纳米粒子的运动轨迹反映其粒径和浓度等信息[23]。比如,DLS分析显示西兰花来源的ELNs的粒径分布在18.3~118.2 nm之间,平均为32.4 nm,Zeta电位为-39.2~-2.62 mV,平均为-17.1 mV[19];柠檬来源的ELNs粒径分布范围为10~300 nm[20];胡萝卜来源的ELNs粒径分布于两个不同的范围,即90~150 nm和800~1200 nm之间[18];蓝莓、椰子、葡萄、葡萄柚、哈密瓜、奇异果、橙子、梨、番茄、豌豆和生姜等果蔬来源的ELNs粒径分布范围相似,多在100~1000 nm之间[17-18]。 由于目前的分离方法尚不能将EVs分离到某一具体的亚群,因此得到的ELNs中也会含有其他囊泡,且由于来源不同,从不同果蔬中提取得到的ELNs也显示出显著的超微结构和粒径的差异。
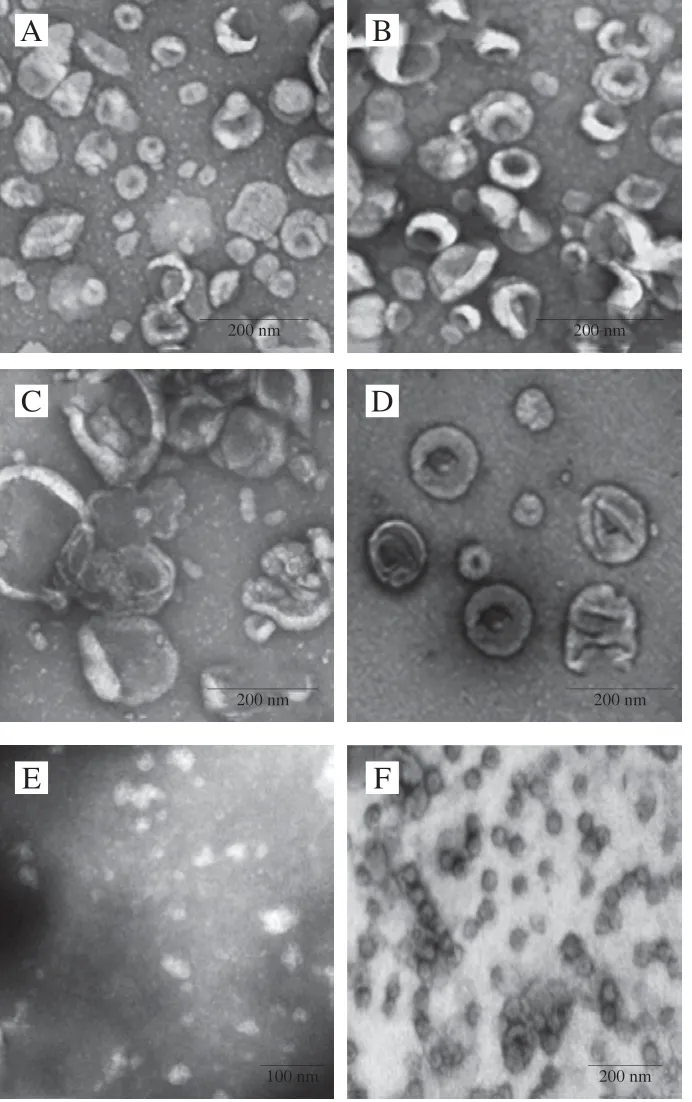
图 2 葡萄(A)、葡萄柚(B)、生姜(C)、胡萝卜(D)、 西兰花(E)、柠檬(F)中ELNs的超微结构表征[18-20]Fig. 2 Ultrastructural characterization of ELNs in grape (A), grapefruit (B), ginger (C), carrot (D), broccoli (E), and lemon (F)[18-20]
3 果蔬来源ELNs的化学组成
不同来源的ELNs中既包含与细胞形成、结构和物质转运相关的共有成分,也包含与来源细胞的生物功能 相关的特异分子。果蔬来源的ELNs和动物来源的外泌体在脂质、蛋白质和核酸等化学组成上均存在差异。
3.1 脂质
脂质是构成囊泡磷脂双分子层的重要成分,是果蔬来源的ELNs和动物来源的外泌体中均不可或缺的组分。动物来源的外泌体中富含鞘磷脂、胆固醇和少量的磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)等,这使其具有一定的刚性,从而保证了外泌体在体内的稳定性[24-25]。 果蔬来源的ELNs富含磷脂酸(phosphatidic acid,PA)、PE、磷脂酰肌醇(phosphatidylinositol,PI)、二酰基甘油(diacyl glycerol,DAG)、三酰基甘油(triacyl glycerols,TAG)、二半乳糖基二酰基甘油(digalactosyldiacylglycerol,DGDG)和单半乳糖基二酰基甘油(monogalactosyldiacylglycerol,MGDG)等。其中,PA是重要的脂质信号分子,能够通过不同的作用模式调节细胞进程;DGDG和MGDG是重要的糖脂,可以在冻融冻干过程中稳定ELNs。果蔬来源的ELNs中未发现胆固醇,与动物中外泌体显著不同。
研究表明,果蔬等植物组织中最典型的脂质是磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰甘油(phosphatidylglycerol,PG)、PE、PI和少量的PA[26-27],这与果蔬来源的ELNs中脂质的组成有所差异,说明果蔬在ELNs的形成过程中对其脂质进行了精确分选。生姜来源的ELNs中脂质含量最丰富的是PA,占总脂质的47%,其次为DGDG和MGDG[21];葡萄来源的ELNs中脂质也以PA为主,占总脂质的53.2%,其次为PE,几乎不含有DGDG和MGDG[3];葡萄柚来源的ELNs中脂质则以PE居多,占总脂质的24%,其次为PC,而PA含量仅为总脂质1%[28],这与葡萄和生姜显著不同(图3)。因此,果蔬来源的ELNs中脂质的种类和相对含量与果蔬本身有很大的关系。
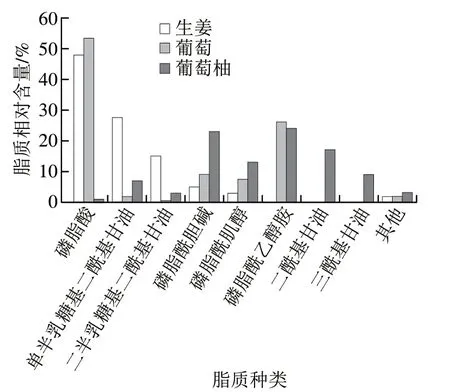
图 3 不同果蔬ELNs中脂质含量对比[3,26-27]Fig. 3 Lipid contents in ELNs from different fruits and vegetables[3,26-27]
3.2 蛋白质
动物外泌体中含有1000多种蛋白质,但这些蛋白质的组成与细胞质膜的蛋白质组成不同[29]。研究表明,动物的外泌体中含有大量的四次穿膜蛋白[30](如CD9、CD63、CD82和CD82等)、热休克蛋白 (heat shock protein,HSP)(如HSP70和HSP90)、与细胞内转运和融合相关的蛋白[31-32](如鸟苷三磷酸酶(guanosine triphosphatease,GTPases)和浮舰蛋白(flotilin)),以及胞质蛋白和膜联蛋白[33](如Rab11、Rab7、Rap1B)等。与动物外泌体的蛋白质组成相比,果蔬来源的ELNs中所含蛋白质的种类较少,含量较低,现已鉴定出的主要种类有调节糖脂代谢的蛋白质(包括肌动蛋白和各类酶在内的胞质蛋白)、GTPases(Rab蛋白质家族)、与膜和囊泡相关的蛋白质(如内体分拣转运复合体(endosomal sorting complex required for transport,ESCRT)相关蛋白CHMP1、VAMP711)等[34-35]。从葡萄、葡萄柚、生姜、柠檬中得到的ELNs中蛋白质种类和主要高丰度蛋白的种类如表2所示。其中,葡萄衍生的ELNs中鉴定出96 种植物蛋白,含量较多的是酶(13 种)、GTPases(12 种)和与MVB形成过程相关的蛋白[34],说明葡萄中的ELNs也是通过MVB形成的,这一过程与动物相似。与葡萄的ELNs中的蛋白质组成类似,葡萄柚来源的ELNs中的蛋白质也含有较多的酶[36]。生姜来源的ELNs中鉴定得到的蛋白种类较少,主要包括肌动蛋白和蛋白水解酶等胞质蛋白,以及水通道蛋白和氯通道蛋白等膜蛋白[37]。相较于葡萄、葡萄柚和生姜,柠檬ELNs中蛋白种类更为丰富,已鉴定出580 种,其中56.7%与动物外泌体含有的蛋白质相重合[20],提示这些蛋白质可能是与外泌体形成相关的特征性蛋白。目前,更多的研究正致力于从不同果蔬来源的ELNs中鉴定更多种类的蛋白质,但由于ELNs制备方法、所得ELNs的纯度和所用蛋白质鉴定技术的不同,最终鉴定得到的蛋白质种类尚存在较大差异。同时,动物来源的外泌体多以四次穿膜蛋白(如CD63、CD9、CD81)和肿瘤易感基因101蛋白为标志性检测指标[38-39],而对于果蔬来源的ELNs,其标志性蛋白尚未确定。

表 2 不同果蔬ELNs中的蛋白质种类对比Table 2 Protein profiles in ELNs from different fruits and vegetables
3.3 核酸
动物外泌体中含有丰富的信使RNA、微RNA(microRNA,miRNA)和长链非编码RNA。果蔬ELNs中也含有大量的RNA,主要为miRNA,但miRNA种类明显少于动物外泌体[40]。对生姜、椰子、哈密瓜、梨、奇异果、番茄等果蔬ELNs的研究表明,这些果蔬的ELNs中含有32~118 种短于25 nt的miRNA(表3),生姜中最少,为32 种,番茄中较多,有118 种[17]。但由于分离和鉴定方法的差异,对同一种果蔬,不同团队鉴定出的miRNA种类也存在显著不同,如Teng Yun等[41]从生姜ELNs中鉴定出的miRNA种类高达125 种。同时,每种果蔬ELNs中会含有一些特有的miRNA序列,且表达水平位于该果蔬前20 位。果蔬ELNs中的miRNA在ELNs的介导下可以进入细胞或细菌内,靶向并调控动物细胞或细菌的基因表达,如大豆ELNs中的MIR-5781可以直接靶向作用在炎症反应中有重要功能的白细胞介素17A(interleukin 17A, IL-17A)[17],生姜ELNs中某些miRNAs可以靶向鼠李糖乳杆菌从而促进吲哚-3-甲醛的产生[41]。

表 3 不同果蔬ELNs中miRNAs的差异[17]Table 3 miRNA profiles in ELNs from different fruits and vegetables[17]
4 果蔬ELNs的应用
4.1 疾病干预功能
动物来源的外泌体在细胞间通讯中扮演着重要角色,具有调控基因表达和调节细胞代谢的功能, 在炎症发生和免疫调节等多个生理过程中发挥着重要的 作用[42-43]。如表4所示,与动物来源的外泌体类似,果蔬来源的ELNs中也含有特定的脂质、蛋白、核酸等成分,每种成分都可能通过某种特殊的机制发挥相应的生物学功能,从而对疾病的发生、发展起到一定的作用。
葡萄、西兰花和生姜来源的ELNs在维持肠道稳态、预防结肠炎发生中具有潜在的干预作用,可以在一定程度上预防由葡聚糖硫酸钠(dextran sodium sulfate,DSS)引发的小鼠结肠炎。肠干细胞在维持肠道组织的稳定性中具有重要作用,葡萄来源的ELNs可以穿过 肠道黏液进而被小鼠肠干细胞吸收,并通过Wnt/β-catenin途径诱导Lgr5hi肠道干细胞增殖,从而加速肠黏膜上皮的恢复,避免由DSS引起的结肠炎[3]。西兰花来源的ELNs可以靶向树突状细胞(dendritic cell,DC),激活DC中腺苷单磷酸激活的蛋白激酶(AMP-activated protein kinase,AMPK),从而减少细胞因子干扰素γ(interferon γ,IFN-γ)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的释放,并提高抗炎因子的表达,防止肠道DC的激活,进而诱导形成耐受性DC[19],使DSS引发的小鼠结肠炎症状得到改善。生姜来源的ELNs可以通过其中的miRNAs调节小鼠肠道中乳杆菌的基因表达,在促进乳杆菌繁殖的同时,产生更多具有保护肠道作用的芳烃受体的配体,如吲哚-3-甲醛等,进而诱导肠组织产生更多的白细胞介素-22,有助于维持肠道稳态,改善结肠炎[41-44]。此外,生姜来源的ELNs在预防和治疗慢性牙周炎[45]以及保护酒精引起的肝损伤方面也具有潜在的干预作用[46]。

表 4 果蔬来源的ELNs和动物来源的外泌体的化学组成Table 4 Chemical compositions of ELNs derived from fruits and vegetables and exosomes derived from animals
果蔬来源的ELNs在抗肿瘤方面也具有潜在的应用价值,如柠檬来源的ELNs可以诱导肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)的表达,增加促凋亡基因Bad和Bax的表达,降低抗凋亡基因Survivin和Bcl-xl表达;同时,还可以引起血管内皮生长因子(vascular endothelial growth factor A,VEGF-A)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-8(interleukin-8,IL-8)的表达下调,从而抑制血管的生成[20]。这表明,柠檬ELNs能够通过促进TRAIL介导的细胞凋亡和抑制VEGF-A、IL-6和IL-8的分泌来抑制癌细胞的增殖。
4.2 载体功能
甲氨蝶呤(methotrexate,MTX)、阿霉素(doxorubicin,DOX)、紫杉醇等药物和姜黄素等食品营养因子往往存在水溶性差、易被人体快速清除和生物相容性差等缺点,这在一定程度上限制了它们的应用。为此,科学家尝试将这些难溶性小分子化合物包封于脂质体或高分子纳米载体中,从而提高其溶解度和分散性,但这些纳米颗粒穿透生物屏障的能力依然较弱,其稳定性、生物相容性和毒性问题也未能有效解决[47-48]。外泌体作为一种天然的纳米级囊泡结构,具有良好的生物相容性和口服安全性,并可以跨越生物学屏障[49], 是一种潜在的高效载体材料。目前,动物来源的外泌体用作药物载体的研究报道较多,如利用巨噬细胞或牛乳来源的外泌体装载紫杉醇可显著提高紫杉醇的利用度,增强其对肿瘤细胞的抑制作用,显著抑制肿瘤的 生长[50-51]。果蔬来源的ELNs已被尝试用作药物的递送系统,如利用从葡萄柚中制备的ELNs作为载体包封MTX后,可以将MTX靶向递送至肠道细胞,并通过减少细胞因子TNF-α、白细胞介素1β(interleukin-1β,IL-1β)和IL-6的产生而缓解由DSS诱导的结肠炎[36];利用从生姜中分离的ELNs为载体,采用超声的方法装载DOX,其装载效率可达(95.90±0.28)%,通过叶酸配体进行靶向修饰后,可以高效靶向并显著抑制异种移植的Colon-26肿瘤细胞的生长[21]。除用于装载小分子药物外,果蔬来源的ELNs还被尝试用于装载miRNA,如利用从番茄中制备的ELNs,采用电穿孔法包裹模型药物细胞膜红色荧光探针DiI和5-羧基荧光素标记的反义EBV-miR-BART7-3p, 结果发现两者均可以高效进入细胞的胞浆,且以ELNs为载体的基因沉默效果优于阳离子脂质体[52]。因此,果蔬来源的ELNs作为小分子药物和miRNA的载体,具有广阔的应用前景。
5 结 语
随着不同果蔬来源ELNs结构特征、化学组成以及生理活性研究的相继展开,人们对于这种囊泡结构的认识也不断提升,对于ELNs的功能、干预疾病潜力的研究日益增多。ELNs以某种特定成分在疾病的发生和治疗中发挥着重要作用,同时在递送不同生物活性的药物方面存在巨大潜力,作为药物载体,ELNs具有独特的结构和理化活性,被细胞高效内化,低毒性以及内在的靶向能力等一系列优势。但是,相较于动物中的外泌体,果蔬中ELNs的相关研究尚处于初始阶段,既缺乏从果蔬中快速、高效、规模化提取制备ELNs的技术体系,也缺乏对不同果蔬中ELNs化学成分的系统组学分析,更缺乏对特征组分生理活性的挖掘和作用机制的探究。可以预见,果蔬中ELNs的研究将很快成为一个新的研究热点,而随着这些研究的不断深入,ELNs以其来源广泛、生物安全性高的优点必将在食品、保健食品和医学等领域得到更为广泛的应用。

