应用Illumina NovaSeq测序技术比较3 种杂粮 对大鼠肠道菌群的影响
王 勇,宋 歌,庞邵杰,綦文涛*
(国家粮食和物资储备局科学研究院,北京 100037)
我国杂粮种类和产量位居世界第一,杂粮产量约占世界杂粮总产量的17%,占国内粮食总产量的10%。越来越多证据表明膳食燕麦、荞麦、小米等杂粮对降低人体慢性疾病发病风险具有重要作用,可调节血糖、降低血脂、降低血压、预防冠心病及结肠癌等疾病[1-2]。肠道菌群失调可导致多种疾病,如肥胖、肝脏疾病和炎症性肠道疾病[3]。饮食习惯是影响人体肠道菌群多样性的主要因素,研究表明,非洲农村儿童因食用小米、高粱等杂粮,较欧洲儿童肠道菌群多样性和肠道短链脂肪酸含量更高[4]。从肠道菌群角度探索杂粮/全谷物的健康功能机制已成为近年来食品营养学领域研究的新热点[5-6],相关基础研究对指导国民健康膳食尤为重要。
燕麦、荞麦等杂粮富含的膳食纤维和多酚可提高肠道菌群多样性,促进肠道特定产短链脂肪酸(short-chain fatty acids,SCFAs)菌的生长,维持肠道结构完整性,调节脂类代谢,从而缓解肥胖和2型糖尿病症状[7-8]。β-葡聚糖为燕麦中主要益生元,进入结肠后可被肠道菌群利用,其作为常见膳食纤维具有降低胆固醇和餐后血糖、减轻胰岛素抵抗和代谢综合征等作用[9]。苦荞中富含的抗性淀粉,具有提高肠道益生菌丰度、降低血液胆固醇和甘油三酯浓度的功效[10]。值得注意的是,纯化的膳食纤维不具有全谷物增加肠道菌群多样性的活性,可能是由于全谷物中的多种营养素间的协同作用发挥功效[11]。除了膳食纤维,杂粮富含黄酮、酚酸等多酚类物质,多酚作为重要的益生元,与肠道菌群的互作机制及对肠道健康的影响也受到越来越多的关注[12-13]。
升级后的Illumina NovaSeq测序平台可实现双端测序的PE250策略,测序通量高、深度大,成为更适用于16S扩增子测序的新平台。本研究通过分析饲喂含不同杂粮饲料的大鼠体质量、摄食量、能量摄入、肝脏和结肠结构差异等,检测结肠内容物中SCFAs含量,通过Illumina NovaSeq高通量测序平台对大鼠结肠细菌16S rRNA V4区进行定性分析,从操作分类单元(operational taxonomic unit,OTU)、不同水平物种组成分析、主坐标分析(principal co-ordinates analysis,PCoA)、线性判别分析(linear discriminant analysis effect size,LEfSe)等方面系统阐释摄食熟化后的燕麦、荞麦和小米对大鼠结肠菌群的影响。
1 材料与方法
1.1 动物、材料与试剂
5 周龄SPF级雄性SD大鼠,体质量180~200 g,购于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。
燕麦(裸燕麦,‘坝莜1号’)购自河北省张家口张北县;荞麦(苦荞,‘川荞1号’)购自四川省凉山彝族自治州;小米(‘晋谷21号’)购自山西省吕梁兴县;AIN-93G标准维持饲料购自北京科澳协力饲料有限公司;含燕麦、荞麦和小米饲料订制于南通特洛菲饲料科技有限公司。燕麦、荞麦和小米均经蒸煮、烘干后添加至饲料,饲料配方和热量密度如表1所示。

表 1 饲料配方和热量密度Table 1 Compositions and energy density of the diets employed in this study g/100 g
甲醇、甲酸(色谱纯) 美国Thermo-Fisher Scientific公司;3-硝基苯肼、2,6-二叔丁基对甲酚 (色谱纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
ACQUITY UPLC I-CLASS高效液相色谱仪、C18BEH色谱柱(100 mm×2.1 mm,1.7 μm)、Xevo TQ-S Micro质谱检测仪 美国Waters公司;ML4002电子天平 瑞士Mettler Toledo公司;DW-86L338型-80 ℃超低温 冰箱 青岛海尔集团;3-30K高速冷冻离心机 德国希格玛实验室离心机公司。
1.3 方法
1.3.1 分组及饲养
48 只SPF级雄性SD大鼠,用AIN-93G标准维持饲料预饲1 周后,按体质量随机分为4 组,每组12 只:空白对照组(饲喂标准维持饲料)、燕麦组(饲喂含22%(质量分数,下同)燕麦的饲料)、荞麦组(饲喂含22%荞麦的饲料)、小米组(饲喂含22%小米的饲料)。大鼠饲养于国家粮食和物资储备局科学研究院昌平实验基地SPF级动物房,实验周期为12 周,饲养期间自由采食和饮水,维持室内温度(23±2)℃、相对湿度60%、12 h昼夜循环采光。每周称量并记录体质量,每两天记录摄食量,每隔2~3 d更换一次垫料。
1.3.2 标本采集及处理
饲养12 周后称量大鼠体质量,CO2麻醉后,心脏取血。断颈处死大鼠,将大鼠转移至超净工作台内,使用体积分数75%的乙醇溶液擦拭大鼠腹部,使用消毒后的手术剪打开大鼠腹腔,迅速将肝脏、肠道完整分离出来,取部分肝脏和结肠组织用于病理检测,其余部分保存于 -80 ℃待测。结肠内容物保存于灭菌后的EP管中,液氮速冻后在-80 ℃冰箱中保存,用于提取肠道菌群DNA。
1.3.3 组织学观察
1.3.3.1 肝脏组织学观察
苏木精-伊红(hematoxylin-eosin,HE)染色:分离1 cm×1 cm肝脏右叶浸泡于质量分数10%甲醛溶液中,石蜡包埋后进行组织切片制备和HE染色。光学显微镜下观察脂肪空泡、肝细胞基本结构及炎细胞浸润情况等。
油红O染色:分离1 cm×1 cm肝脏右叶,液氮冷冻制作切片,进行油红O溶液染色(0.5 g/100 mL,溶解于异丙醇中)。将切片置于光学显微镜下观察组织形态变化,参照中华肝病学会脂肪肝病诊断标准进行切片评分。
1.3.3.2 结肠组织学观察
部分结肠组织经体积分数10%甲醛溶液浸泡后进行石蜡包埋、切片制备与HE染色。光学显微镜下观察结肠组织形态。
1.3.4 大鼠肠道菌群分析
1.3.4.1 大鼠结肠内容物高通量测序分析
大鼠结肠内容物样品(每组随机取8 个)从-80 ℃冰箱取出后立刻放入干冰,送至北京诺禾致源生物信息科技有限公司,采用Illumina NovaSeq 6000测序平台,通过扩增细菌16S rRNA基因的V4区域基因序列分析大鼠结肠菌群多样性。
1.3.4.2 生物学信息分析
基于有效数据进行OTU聚类和物种分类分析,根据OTUs聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。同时,对OTUs进行丰度、Alpha多样性计算、韦恩图分析,以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs信息等。另一方面,对OTUs进行多序列比对并构建系统发生树,进一步得到不同样品和分组的群落结构差异,通过PCoA降维图和样品聚类树进行分析,并选用LEfSe方法对分组样品的物种组成和群落结果进行差异显著性检验。
1.3.5 大鼠结肠内容物SCFAs含量的测定
称取样本约80 mg,加入250 μL水、250 μL甲醇,漩涡提取30 min。13200 r/min离心取上清液50 μL,加入50 μL内标(质量浓度5 μg/mL同位素标记的丙酸)、50 μL衍生试剂(200 μmol/L 3-硝基苯肼),常温衍生30 min,加入50 μL质量浓度2 μg/mL抗氧化剂2,6-二叔丁基对甲酚,漩涡10 s。13200 r/min离心10 min,取上清液检测,采用液相色谱-质谱联用外标法进行检测和定量。
流动相A:含体积分数0.1%甲酸的去离子水;流动相B:甲醇。梯度洗脱:0~2 min,90%~80% A;2~9 min,80%~40% A;9~10 min,40%~5% A;10~11 min,5%~0%;11~11.1 min,0~90%;11.1~13 min,90%。检测条件:流速0.3 mL/min,进样量5 μL,柱温45 ℃。
质谱条件:毛细管电压2.7 kV、锥孔电压30 V、锥孔流速20 L/h、离子源温度150 ℃、离子化温度450 ℃、离子化气流流速1000 L/h。
1.4 数据统计与分析
使用Graphpad Prism 6.0软件进行统计分析,采用One-way ANOVA和Duncan’s test分析差异显著性,P<0.05时被认为差异具有统计学意义,统计结果采用平均值±标准差表示。
2 结果与分析
2.1 燕麦、荞麦和小米特征功能活性成分检测结果
杂粮的健康作用与其含量丰富的功能活性物质密切相关。本研究所选取的燕麦中β-葡聚糖质量分数为(4.19±0.42)%。荞麦中总黄酮质量分数为(1.76±0.06)%(以芦丁计),抗性淀粉质量分数为(0.39±0.01)%。小米中VB1含量为(0.27±0.04)mg/100 g, 总膳食纤维质量分数为(2.16±0.02)%,粗脂肪质量分数为(4.40±0.36)%。与前期报道的3 种杂粮特征功能活性成分含量[14-16]基本一致,因此,本研究所选取杂粮品种具有代表性。
2.2 燕麦、荞麦和小米对大鼠体质量、摄食量和能量 摄入的影响
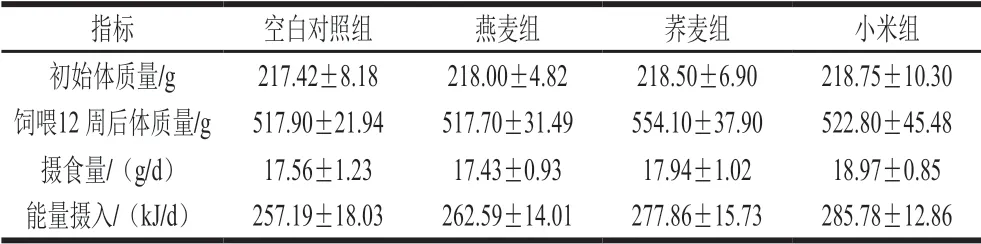
表 2 大鼠体质量、摄食量和能量摄入Table 2 Body mass, food intake and energy intake of rats
如表2所示,空白对照组、燕麦组、荞麦组和小米组大鼠初始体质量基本相同(P>0.05)。处死前第12周时,荞麦组大鼠的体质量最大,与空白对照组相比增长6.99%,但无显著性差异(P>0.05),与Peng Lianxin等[17]研究结果一致,饲喂荞麦可增加高脂饮食大鼠体质量。燕麦组、荞麦组和小米组摄食量及能量摄入均与空白对照组无显著性差异(P>0.05)。表明添加3 种杂粮均未影响大鼠的正常生长。
2.3 燕麦、荞麦和小米对大鼠肝脏结构影响
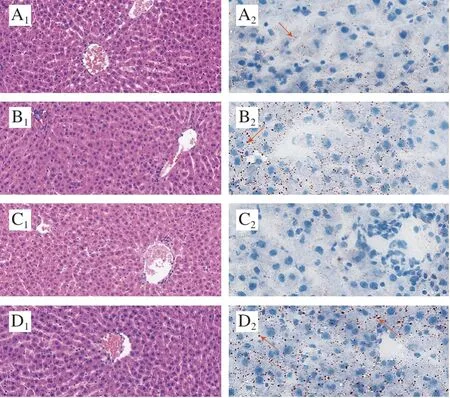
图 1 饲喂燕麦、荞麦和小米对正常大鼠肝脏组织的影响Fig. 1 Effects of oats, tartary buckwheat and foxtail millet supplementation on liver histology in normal rats
如图1所示,空白对照组、燕麦组和小米组大鼠肝小叶结构存在,肝小叶内肝细胞无水肿,10%肝细胞微泡性脂肪变性,偶见点状肝细胞坏死和很少量单核淋巴细胞灶状浸润,未见肝细胞嗜酸性变,肝血窦轻度淤血,未见肝Kupffer细胞增生,汇管区未见炎细胞浸润;油红O染色显示空白对照组、燕麦组和小米组10%的肝细胞内可见红染的细小脂滴。荞麦组大鼠未见肝细胞脂肪变性,油红O染色显示肝细胞内未见红染的脂滴,表明膳食荞麦具有一定预防肝细胞脂肪变性的作用。
2.4 燕麦、荞麦和小米对大鼠结肠组织结构的影响

图 2 饲喂燕麦、荞麦、小米对正常大鼠结肠组织的影响Fig. 2 Effects of oats, tartary buckwheat and foxtail millet supplementation on colon histology in normal rats
如图2所示,空白对照组大鼠结肠黏膜无损伤,未见隐窝脓肿,杯状细胞无减少,肠壁内未见炎细胞浸润。燕麦组大鼠结肠黏膜无损伤,未见隐窝脓肿,杯状细胞无减少,黏膜层内很少量单核淋巴细胞散在浸润。荞麦组大鼠结肠黏膜无损伤,未见隐窝脓肿,杯状细胞无减少,黏膜层和黏膜下层可见中等量单核淋巴细胞灶状浸润。小米组大鼠结肠黏膜无损伤,未见隐窝脓肿,杯状细胞轻微减少,肠壁全层中等量单核淋巴细胞灶状浸润。综上,饲料中添加3 种杂粮后,大鼠结肠结构保持正常的形态,未出现明显病变。
2.5 燕麦、荞麦和小米对大鼠结肠菌群的影响
2.5.1 结肠菌群OTU数量
韦恩图可用于统计多组或多个样本中所共有和独有的物种(如OTU)数目,由图3可知,4 组大鼠结肠内容物样本共产生724 个OTU,燕麦组的OTU数量最多(559 个),荞麦组的OTU数量其次(540 个),空白对照组和小米组的OTU数量均为508 个,4 组样品的共有物种为390 个,燕麦组特有物种数量最多(59 个)。由此可见,饲喂燕麦后大鼠结肠菌群会增加新的物种,结肠菌群的多样性得到提升。

图 3 大鼠结肠菌群OTU的韦恩图Fig. 3 Venn diagram showing unique and shared colonic flora in normal rats supplemented with different kinds of coarse cereals
2.5.2 基于门分类水平分析结果
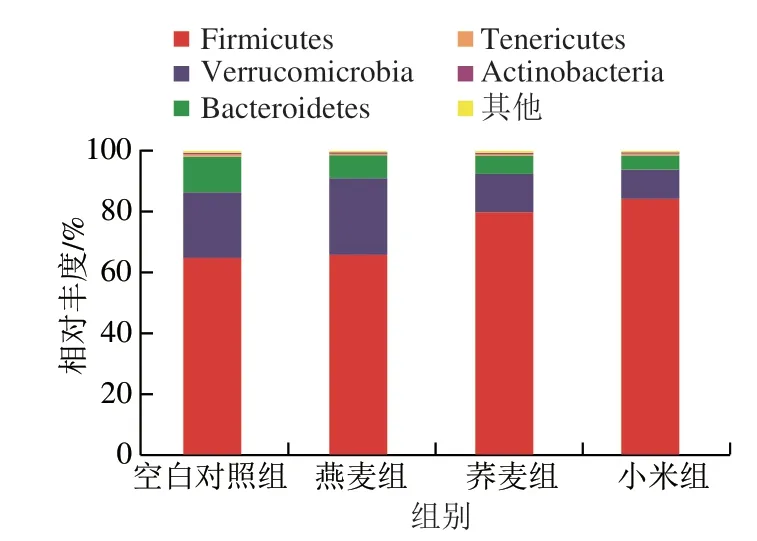
图 4 大鼠结肠菌群门水平物种组成分析Fig. 4 Analysis of colonic microbiota composition at the phylum level in normal rats
本实验通过Illumina NovaSeq测序技术分析了大鼠结肠内容物的菌群,重点分析饲喂燕麦、荞麦和小米对门水平和属水平上大鼠结肠菌群组成的影响。由图4可知,各组样本生成的OTU主要由5 个菌门构成:厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)和放线菌门(Actinobacteria),其中厚壁菌门、疣微菌门和拟杆菌门占绝对主导地位。燕麦组厚壁菌门相对丰度与对照组无显著差异(P>0.05),荞麦组和小米组使厚壁菌门相对丰度分别提高23.29%和30.03%,使疣微菌门相对丰度分别下降41.05%和55.48%,使拟杆菌门相对丰度分别下降49.87%和58.58%。据报道2型糖尿病患者粪便菌群中厚壁菌门/拟杆菌门比值下降,这是肠道菌群失调的重要标志之一[18]。Martínez等[19]研究发现,28 个健康受试者每天食用60 g全谷物大麦、糙米、大麦与糙米复合物(质量比1∶1),4 周后3 组受试者粪便中菌群多样性显著增加,厚壁菌门/拟杆菌门比值增加。
2.5.3 基于属分类水平的分析结果
由图5可知,在属水平上,各组优势菌群主要有阿克曼氏菌属、瘤胃菌科未定属(unidentified_Ruminococcaceae)、布劳特氏菌属(Blautia)、拟杆菌属、乳杆菌属(Lactobacillus)和罗姆布茨菌属(Romboutsia)等。饲喂燕麦、荞麦和小米会影响大鼠结肠菌群属水平上的组成,结果分析表明摄食燕麦显著增加乳杆菌属和阿克曼氏菌属相对丰度,摄食荞麦和小米显著降低阿克曼氏菌属相对丰度,摄食小米显著增加布劳特氏菌属丰度。膳食全谷物人群肠道厚壁菌门中布劳特氏菌属、乳杆菌属和放线菌门中柯林斯菌属(Collinsella)丰度增加[20]。乳杆菌属不同菌种具有显著的益生效果,包括抑制致病菌,改善肠道菌群结构,促进肠上皮细胞增殖,增强机体免疫功能,改善血脂,抗氧化等功效[21]。燕麦组和小米组使乳杆菌属相对丰度分别提高196.40%和48.65%。大量研究表明肠道中嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)的丰度与宿主患肥胖、2型糖尿病、炎症性肠病等呈负相关,嗜黏蛋白阿克曼氏菌在代谢炎症、屏障功能和脂肪储存中起关键作用,其定植情况是反映机体健康水平的标志之一[22-23]。拟杆菌属丰度升高与结肠直肠癌、肝病等多种疾病相关,本实验中摄食燕麦、荞麦和小米分别使拟杆菌属相对丰度下降38.53%、51.98%和57.29%。针对中国健康年轻人群的肠道菌群结构特征分析研究表明,布劳特氏菌属具有在人体肠道内发酵产生SCFAs的能力,其主要参与丁酸盐的产生[24]。因此,本实验结果表明燕麦、荞麦和小米摄入可促进肠道益生菌的繁殖,并抑制肠道有害菌的生长。通过体外模型研究燕麦和荞麦对人肠道菌群的影响,发现燕麦和荞麦对有益菌(双歧杆菌属(Bifidobacterium)和乳杆菌属)具有一定的增殖作用,同时对有害菌(肠球菌和大肠杆菌)的生长具有一定的抑制作用[10,25]。此外,荞麦壳提取物因富含多酚类化合物,可改善糖尿病大鼠的肠道菌群结构,提高肠道内乳杆菌属、布劳特氏菌属和普氏菌属(Prevotella)等菌属丰度[26]。
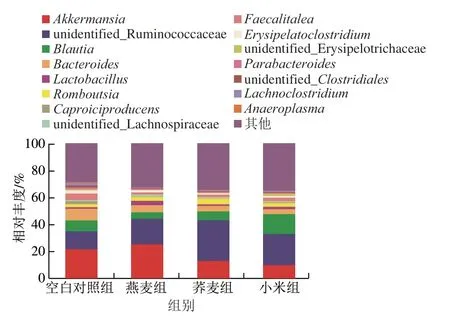
图 5 大鼠结肠菌群属水平物种组成分析Fig. 5 Analysis of colonic microbiota composition at the genus level in normal rats
2.5.4 菌群PCoA结果
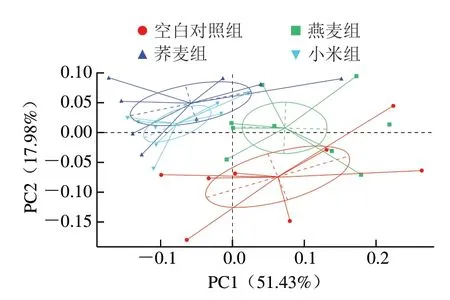
图 6 大鼠结肠菌群PCoA图Fig. 6 Principal co-ordinate analysis of colonic microbiota in normal rats
利用每个样品OTU的丰度信息进行PCoA,结果表明,空白对照组、燕麦组、荞麦组和小米组大鼠肠道内菌群多样性均有明显的聚类现象(图6),说明饲喂3 种杂粮对大鼠结肠菌群结构的影响显著,且荞麦和小米对结肠菌群的影响相似度较高。
2.5.5 LEfSe菌群差异分析结果

图 7 大鼠结肠菌群差异分析Fig. 7 LEfSe analysis of differences in colonic microbiota in normal rats supplemented with different kinds of coarse cereals
图7A显示了不同组中丰度差异显著的物种,柱状图的长度代表摄食3 种杂粮对大鼠肠道内差异物种的影响,通过将差异映射到已知层级结构的分类树上的方式得到进化分支图(图7B)。利用LEfSe软件分析大鼠结肠菌群差异,先对4 组样品进行Kruskal-Wallis秩和检验,将筛选出的差异再通过Wilcoxon秩和检验进行两两组间比较。筛选P<0.05、线性判别分析(linear discriminant analysis,LDA)值大于4的菌群进行展示和比较,如图7A所示,相对于其他3 组,饲喂燕麦后大鼠结肠中疣微菌门丰度增加,阿克曼氏菌属丰度增加; 饲喂荞麦后大鼠结肠中瘤胃菌科未定属丰度增加;饲喂小米后大鼠结肠中厚壁菌门丰度增加,布劳特氏菌属和阎氏菌属(Yaniella)丰度增加。
2.6 燕麦、荞麦和小米对大鼠结肠SCFAs含量的影响
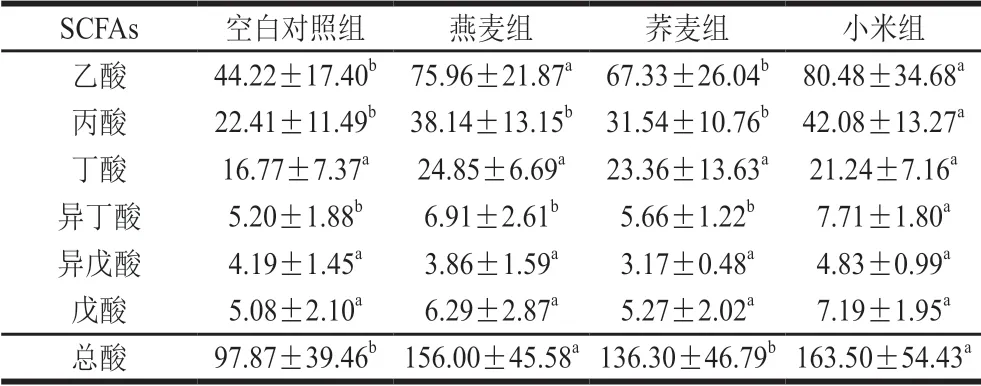
表 3 结肠内容物SCFAs含量Table 3 SCFA concentrations in colonic contents of rats μg/g
如表3所示,饲喂燕麦和小米后,大鼠结肠中乙酸和总SCFAs含量显著高于对照组(P<0.05),小米组丙酸和异丁酸含量显著高于对照组(P<0.05)。肠道内的SCFAs主要来自食物中不能被人体直接消化的碳水化合物,如纤维素、半纤维素、抗性淀粉和低聚糖等,被肠道微生物发酵形成有益代谢终产物SCFAs等,SCFAs在调节宿主代谢、降低结肠pH值、改善肠道屏障功能、降低胆固醇水平等方面具有关键作用[27-28]。全谷物膳食人群较精制谷物膳食人群粪便中乙酸和丁酸含量高[29]。Dong Jilin等[14]研究发现3 种燕麦产品(燕麦片、去皮燕麦面粉、精制燕麦麸)饲喂的高脂饮食大鼠的结肠中总SCFAs含量增加,燕麦产品可通过增加乳杆菌属和双歧杆菌属数量,改变肠道菌群结构而影响机体能量和脂肪代谢。近期研究表明高脂饮食模式下,小米可提高大鼠盲肠中乙酸、丙酸和丁酸含量[30]。本实验中摄食小米显著增加布劳特氏菌属丰度,该菌属具有发酵产生SCFAs的能力,因此推测布劳特氏菌属丰度的增加可能为小米提高肠道SCFAs含量的机制之一。
本研究评价熟化形式杂粮对体内肠道健康的影响,杂粮的健康作用与其含量丰富的营养物质、功能活性成分密切相关,杂粮富含膳食纤维和抗性淀粉,进入肠道后经细菌发酵,促进肠道有益菌的增殖,改善肠道微生态环境,对多种代谢性疾病具有干预作用[8]。Knudsen等[31]研究表明,燕麦中可溶性膳食纤维β-葡聚糖可调整大鼠肠道菌群结构,促进益生菌在肠道内定植,减少肠道有害菌的黏附;Peng Lianxin等[17]研究发现荞麦中黄酮类抗氧化物质(如芦丁)具有改善高脂饮食大鼠肠道菌群的功效,但是荞麦和芦丁对SCFAs的产生均无明显作用;Yang Ruipeng等[32]研究发现小米谷糠内壳的结合态多酚可显著增加小鼠粪便中厚壁菌门丰度,降低拟杆菌门丰度,以上研究结果均与本实验结果一致。
3 结 论
本实验应用Illumina NovaSeq高通量测序技术探究熟化后燕麦、荞麦和小米对正常大鼠的肠道菌群影响,并比较3 种杂粮对肠道有益代谢产物、肠道结构等方面的作用。主要结论如下:1)摄食燕麦可增加大鼠肠道菌群多样性,显著增加益生菌乳杆菌属和阿克曼氏菌属丰度,对肠道菌群具有一定的改善作用。2)荞麦和小米可增加结肠中厚壁菌门相对丰度,降低疣微菌门和拟杆菌门相对丰度,荞麦和小米对结肠菌群的影响相似度较高。 3)燕麦和小米可提高大鼠结肠内乙酸和总SCFAs含量,小米还可增加结肠内丙酸和异丁酸含量。本研究通过系统比较3 种杂粮对肠道菌群的影响,为谷物功能食品的开发提供科学依据。

