花椒精油对链脲佐菌素诱导的糖尿病 小鼠糖代谢的影响
陆敏涛,任廷远,2,3,*,杨 建,陆龙发,秦礼康
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农业生物工程重点实验室,贵州 贵阳 550025; 3.贵州省农业科学院,农业农村部植物新品种测试贵阳分中心,贵州 贵阳 550006;4.贵州玄德生物科技股份有限公司,贵州 贵阳 550016)
糖尿病是一种以高血糖为特征的代谢紊乱性疾病群[1]。 随着生活水平的提高,糖尿病的发病机率越来越高,据估计,2045年,将有近7亿糖尿病患者,长期高血糖可对人体机能造成巨大的损害,因此糖尿病的防治迫在眉睫[2]。目前对于糖尿病的治疗措施一般采用注射胰岛素同时口服合成药的方法,常用的降糖药物虽然具有较好的效果,但是,长期使用药物会对身体的正常生理功能产生严重的不良影响[3]。因此,研究预防糖尿病的新型药物或辅料很有必要,来源于食品或药物食物中的天然活性成分因其健康、安全、作用温和等特点而备受人们的青睐。
花椒是指植物花椒树(Zanthoxylum bungeanumMaxim.)的成熟果皮,花椒树属芸香科(Rutaceae)花椒属(Zanthoxylum)[4],主要分布于我国四川、重庆、河北、湖南、吉林省以及东南亚一些国家。据《诗经》记载,我们的祖先早在两千多年就已经开始使用花椒[5],目前全世界花椒种类大约有250余种,而我国花椒种类高达50余种,约占全世界的五分之一,从种植面积和数量来看,我国是花椒产业的大国[6]。花椒是我国传统调味品之一,含挥发油等多种成分[7],具杀菌、消炎、抗肿瘤、抗氧化、抗溃疡、驱虫抗寒等多种功能[8],是医药和食品的原料[9-10],具有极高的药理性能和广泛的应用范围。
目前,关于花椒对糖尿病的治疗,人们主要对花椒麻素的降糖降脂方面进行了大量研究,花椒麻素是产生麻味风味的主要来源[11-12],You Yuming等[13]研究表明,花椒麻素的降糖作用可能是通过上调肝脏中磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPCK)、葡萄糖激酶(glucokinase,GK)和葡萄糖-6-磷 酸酶(gucose-6-phosphatase,G6Pase)的表达量以及修复受损的胰腺β细胞从而上调胰腺中胰十二指肠同源盒1 (pancreatic-duodenal homeobox 1,PDX-1)、GK和葡糖转运蛋白(glucose transporter,GLUT)2的mRNA水平和蛋白表达量而实现的。Ren Tingyuan等[14]研究表明,花椒麻素对糖尿病大鼠的降糖机制是激活腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)信号通路,介导GLUT4从细胞质快速转运到细胞膜,达到降糖效果[15]。陈朝军[16]研究表明,花椒素和辣椒素能使大鼠体质量增加速率减慢,减轻大鼠的脂肪肝症状,对胆固醇代谢循环紊乱有一定的改善作用。游玉明等[17]研究发现花椒麻素有改善糖尿病导致的肠道菌群紊乱的作用,灌胃花椒麻素后,盲肠内容物中某些益生菌数量显著增加,而某些条件致病菌数量显著降低。现阶段对于花椒的研究甚多,但鲜见花椒精油治疗糖尿病的 报道。然而,国内花椒的销售主要以鲜椒、干椒和低麻度花椒油等初级产品为主,而花椒的精深加工产品非常匮乏,这将阻碍花椒产业的可持续发展。因此,挖掘花椒的附加值以提高其经济效益、增加椒农收入,是企业、政府和相关科技人员急需解决的一大难题,而开展花椒精油的功能性评价,是解决花椒向精细化加工的又一条有效途径。
目前,花椒功能的探究仍处于初步探索阶段,本实验选用不同浓度的花椒精油对链脲佐菌素(streptozotocin,STZ)诱导的1型糖尿病小鼠模型进行灌胃实验,旨在探讨花椒精油对1型糖尿病小鼠糖代谢的影响及可能机制,有助于促进对花椒精油的认识,为花椒精油的开发和利用提供科学依据。
1 材料与方法
1.1 材料、动物与试剂
红花椒精油(由陕西韩城产大红袍花椒经超临界CO2萃取后,用分子蒸馏分离而得)由贵州玄德生物科技股份有限公司提供。
昆明种雄性小鼠50 只(SPF级,体质量22~24 g,生产许可证号:SCXK(渝)20120008)由重庆腾鑫生物技术有限公司提供。
STZ 美国Sigma公司;DNA凝胶回收试剂盒 德国Qiagen公司;总RNA提取试剂盒、粪便DNA提取试剂盒天根生化科技有限公司;荧光定量试剂盒、糖化血清蛋白(glycosylated serum protein,GSP)试剂盒、糖化血红蛋白(glycosylated hemoglobin,GHb)试剂盒、胰岛素酶联免疫分析试剂盒、肝糖原试剂盒 南京建成生物科技有限公司;抗体 英国Abcam公司。
1.2 仪器与设备
L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;SpectraMax190连续波长多功能酶标仪 美国 Molecular Devices公司;H1-16KR高速冷冻离心机 湖南可成仪器设备有限公司;YH-A5003电子天平 合肥 五星衡器有限公司;血糖仪与配套血糖试纸 江苏鱼跃医疗设备股份有限公司;S1000梯度聚合酶链式反应(polymerase chain reaction,PCR)仪、Powerpac蛋白电泳仪、Gel Doc XR凝胶成像系统、Trans-Blot Turbo蛋白转膜仪 美国BIO-RAD公司;Nano Drop 1000微量紫外分光光度计 美国Thermo公司;Light Cycler Nano荧光定量PCR仪 美国罗氏公司。
1.3 方法
1.3.1 动物饲养与样品采集
动物实验过程严格遵循现行的贵州医科技大学实验动物伦理委员会批准的相关法律法规进行,将50 只雄性昆明小鼠50只分为空白组(n=10)和模型组 (n=40)。小鼠经过12 h禁食,不禁水,一次性注射 150 mg/kgmbSTZ造模,造模期间自由摄食、饮水。造模后第3天,禁食10 h,然后尾尖采集血样,血糖仪测定空腹血糖浓度。当空腹血糖浓度高于11.10 mmol/L时,则造模成功[18],并筛除造模失败的小鼠。把40 只建模成功的小鼠分为4 组(n=10),即花椒精油高剂量 15 mg/(kgmb·d)、中剂量9 mg/(kgmb·d)、低剂量3 mg/(kgmb·d)和模型组,模型组和空白组灌胃等剂量的大豆油。饲养期间均自由摄食,自由饮水,每隔7 d称量体质量、摄食量、饮水量,根据体质量 (0.1 mL/kg)调整灌胃剂量。
各组小鼠连续灌胃28 d后禁食不禁水12 h,摘掉眼球取血完毕,断颈处死,小鼠在冰上迅速被解剖取其肝脏,并用预冷的质量分数0.9%生理盐水(预先配好灭菌后置于4 ℃冰箱)漂洗干净,使用吸水纸将肝脏表面的水分擦干,放入-80℃冰箱保存备用,测定时取出样品,解冻后进行部分指标检测[19]。
1.3.2 花椒精油的处理
为保证每只小鼠为等剂量灌胃(40 g体质量小鼠灌胃0.2 mL剂量)。准确称取1.2 g红花椒精油,加入400 mL大豆油后,充分混匀,配制成3 mg/mL 花椒精油溶液,再取少量分别用大豆油稀释成1.8 mg/mL和0.6 mg/mL的花椒精油溶液,分别作为高 (15 mg/(kgmb·d))、中(9 mg/(kgmb·d))、低(3 mg/(kgmb·d))剂量组的灌胃质量浓度,空白组和模型组灌胃等剂量大豆油,每3 d配一次,于4 ℃保存。
1.3.3 指标测定
1.3.3.1 空腹血糖浓度的测定
在灌胃试剂后的第0、7、14、21、28天,禁食不禁水6 h,剪尾采血使用血糖仪测定空腹血糖浓度[20]。
1.3.3.2 口服糖耐量测定
连续灌胃28 d,禁食不禁水12 h,根据2.00 g/kgmb灌胃葡萄糖溶液,通过剪尾取血测定0、0.5、1 h和2 h时的血糖水平[21],观察各组小鼠血糖浓度的变化情况。血糖曲线下面积(area under the cure,AUC)根据公式(1)计算[22]。式中:cA、cB、cC和cD是灌胃葡萄糖溶液后0、0.5、 1 h和2 h的血糖浓度/(mmol/L)。
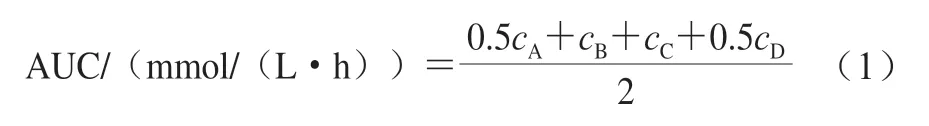
1.3.3.3 小鼠脏器指数的测定
小鼠脏器指数按公式(2)[23]计算。
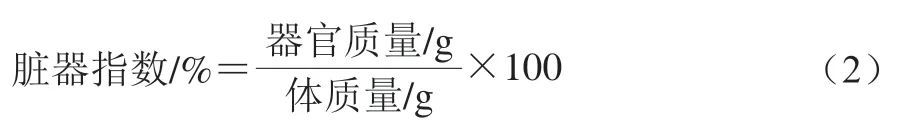
1.3.3.4 血清理化指标测定
血清GHb、GSP、胰岛素,肝脏肝糖原,左腿肌肌糖原水平测定操作步骤按试剂盒说明书进行。
1.3.3.5 肝脏及骨骼肌mRNA和蛋白表达量检测
使用试剂盒从组织样品中提取总RNA,并反转录得cDNA,使用紫外分光光度计测定RNA浓度。应用PCR检测相关基因的表达,以β-actin为内参基因,并采用2-ΔΔCt法计算各基因相对表达量,操作步骤如下:总RNA提取→反转录及cDNA的合成与检测→荧光定量PCR检测[24]。各基因的引物序列见表1。蛋白表达量检测参考Ren Tingyuan等[14]的方法进行。
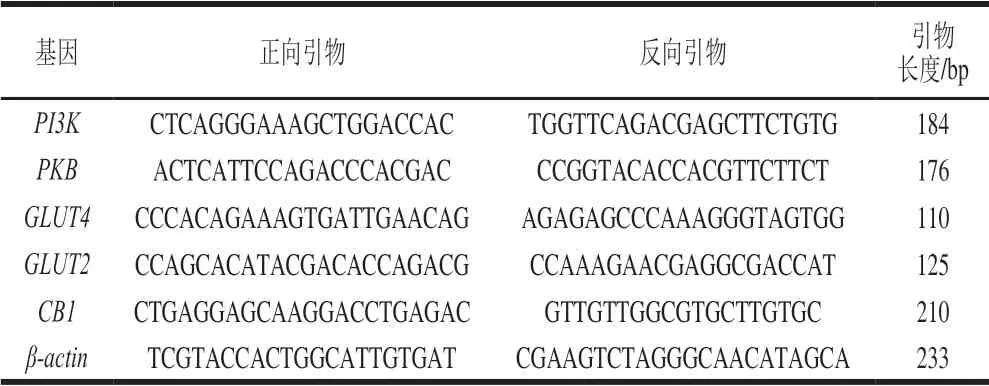
表 1 用于荧光定量PCR的引物序列和片段长度Table 1 Primer sequences used for qRT-PCR and product sizes
1.4 数据统计与分析
采用SPSS 22.0和Origin 9.0软件进行统计分析,结果以平均值±标准差表示,采用单因素方差分析进行Duncan检验,差异显著水平是0.05。
2 结果与分析
2.1 花椒精油对糖尿病小鼠摄食量、饮水量及体质量的影响
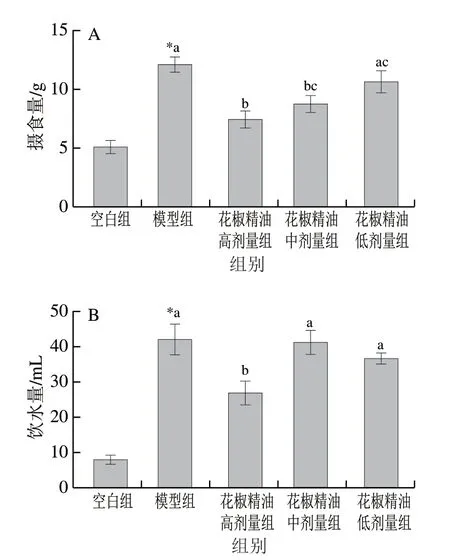
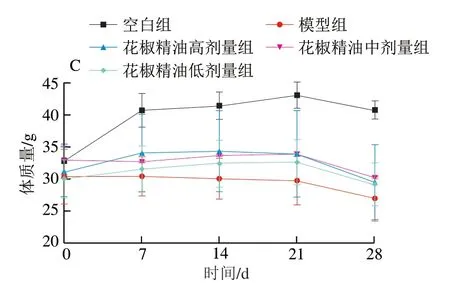
图 1 小鼠摄食量(A)、饮水量(B)及体质量(C)的变化Fig. 1 Changes in food intake (A), water intake (B) and body mass (C) in mice
2.2 花椒精油对糖尿病小鼠脏器指数的影响
脏器指数是衡量机体健康生长的重要指标,灌胃花椒精油28 d后断颈处死,迅速于冰上解剖取各组织器官精确称质量,计算各组小鼠的脏器指数,结果如表2所示。各组小鼠的心脏、脾脏指数无显著差异(P>0.05)。与空白组相比,模型组肝脏指数、肾脏指数分别显著升高了15.60%、42.55%(P<0.05),各剂量组比模型组均有降低,但无显著性差异,这与陈小敏等[26]的研究结果一致。
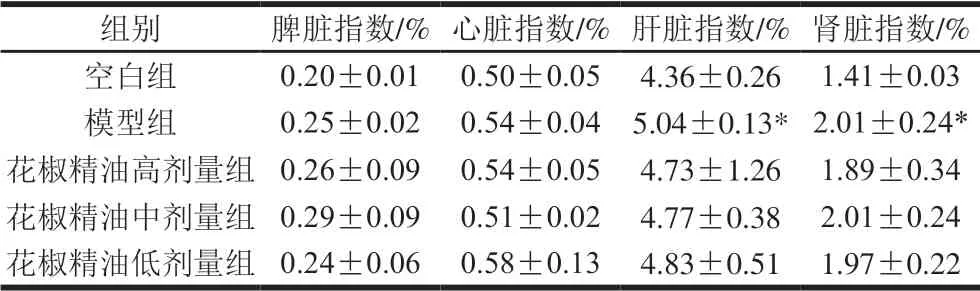
表 2 花椒精油对糖尿病小鼠脏器指数的影响(n=10)Table 2 Effect of the essential oil from the ripe fruit percicarp of Zanthoxylum bungeanum Maxim. on viscreal indexes of diabetic mice (n= 10)
2.3 花椒精油对糖尿病小鼠空腹血糖浓度的影响
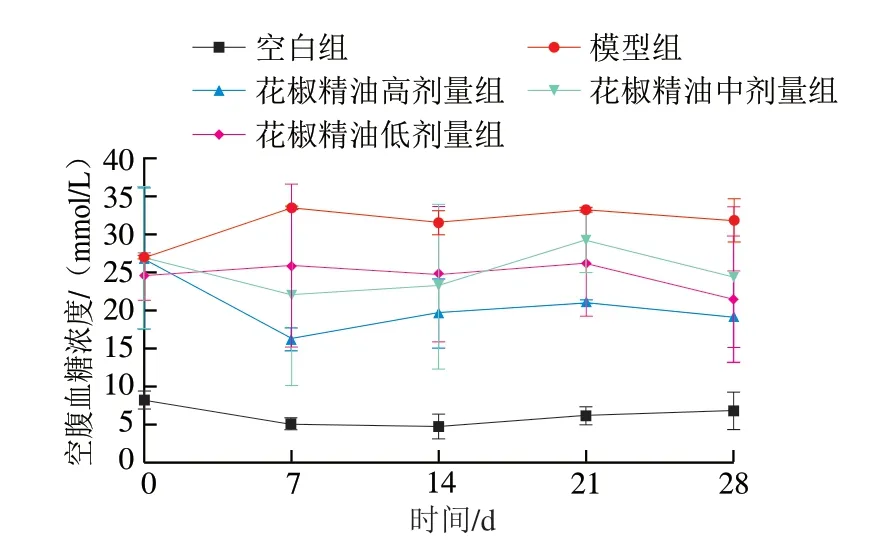
图 2 糖尿病小鼠空腹血糖浓度的变化(n=10)Fig. 2 Changes in fasting blood glucose concentration in diabetic mice (n = 10)
如图2所示,空白组空腹血糖浓度一直在正常范围内波动,而模型组空腹血糖浓度较高,最高达到33.07 mmol/L,说明模型组小鼠糖尿病严重;3 个花椒精油剂量组与模型组相比,空腹血糖浓度明显下降。经过28 d治疗给药,花椒精油高、中、低剂量组空腹血糖浓度分别下降了28.60%、9.81%、12.57%,虽未能降到正常血糖水平,但有明显的改善作用。
2.4 花椒精油对糖尿病小鼠口服糖耐量及曲线下面积的影响
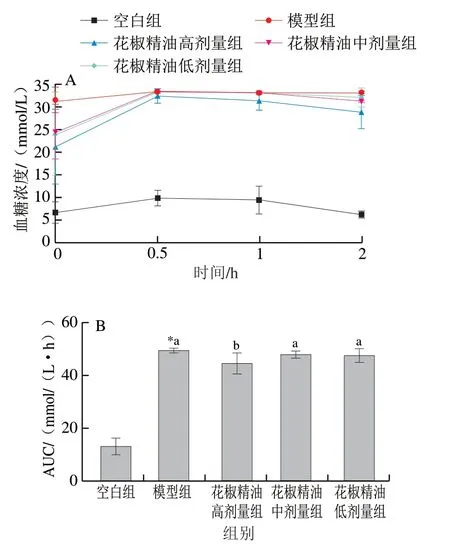
图 3 糖尿病小鼠血糖浓度(A)及AUC(B)的变化(n=10)Fig. 3 Changes in glucose tolerance (A) and area under curve (B) in diabetic mice (n = 10)
各组小鼠饲养28 d禁食不禁水12 h,并且根据2.00 g/kgmb灌胃小鼠葡萄糖溶液,0、0.5、1、2 h血糖浓度变化如 图3A所示,空白组的血糖水平在给葡萄糖溶液后升高,在0.5 h达到最高,并且在体内调节2 h后降至正常水平。然而,模型组的血糖水平在给葡萄糖溶液后0.5 h达到最高值,随后一直维持在高水平,证明造模成功。花椒精油中、低剂量组在0.5 h后缓慢下降,但都未回到初始血糖浓度。图3B显示,模型组AUC显著高于空白组,与模型组相比,花椒精油中、低剂量组AUC降低但差异不显著(P>0.05),高剂量组显著降低(P<0.05)。实验结果表明,不同剂量的花椒精油可以在一定程度上提高1型糖尿病小鼠的糖耐量,且高剂量效果更明显。
2.5 花椒精油对糖尿病小鼠血清GHb与GSP水平的影响
图4A显示,模型组与空白组血清GHb与GSP水平有显著性差异(P<0.05),模型组GHb质量浓度比空白组显著增加443.95%(P<0.05),花椒精油高、中、低剂量组比模型组GHb质量浓度分别下降30.76%、13.32%、3.31%,但差异不显著;模型组GSP浓度比空白组 增加138.78%(P<0.05),花椒精油高、中、低剂量组GSP质量浓度与模型组相比分别下降37.29%、22.49%、16.65%,其中花椒精油高剂量组与模型组差异达到显著性水平。
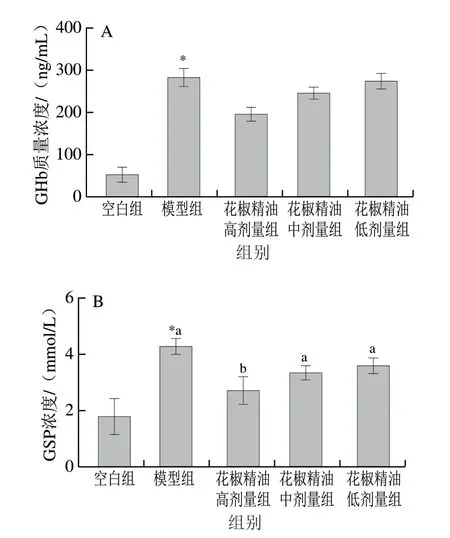
图 4 糖尿病小鼠GHb(A)与GSP(B)水平的变化(n=10)Fig. 4 Changes in GHb (A) and GSP (B) levels in diabetic mice (n = 10)
2.6 花椒精油对糖尿病小鼠血清胰岛素含量的影响
体内能起到降糖作用的物质只有胰岛素,其分泌状况和受体功能与糖尿病密切相关[27]。图5显示,模型组的胰岛素含量比空白组显著下降16.5%(P<0.05),表明模型建立成功后破坏了胰岛细胞,使其分泌功能受到了抑制;而花椒精油高、中、低剂量组分别比模型组增加了10.29%、22.56%、13.97%。

图 5 小鼠胰岛素含量的变化Fig. 5 Changes in insulin concentration in mice
2.7 花椒精油对糖尿病小鼠肝糖原与肌糖原含量的影响
正常人体血糖水平过高时,会诱导胰岛素产生,合成肝糖原和肌糖原,降低血糖水平。由图6可知,模型组的肝糖原和肌糖原含量分别比空白组降低了37.22%和75.00%,花椒精油3 个剂量组的肝糖原和肌糖原含量较模型组均有提高,其中高剂量组提高最为显著,其肝糖原与肌糖原含量分别提高了23.61%、 149.75%(P<0.05)。

图 6 糖尿病小鼠肝糖原与肌糖原含量的变化Fig. 6 Changes in liver glycogen and muscle glycogen contents in diabetic mice
2.8 花椒精油对糖尿病小鼠肝脏和骨骼肌相关基因与蛋白 相对表达量的影响
连续灌胃花椒精油28 d后,解剖小鼠取肝脏与骨骼肌,采用实时荧光定量PCR测定肝脏PI3K、PKB、GLUT2和骨骼肌GLUT4mRNA的相对表达量,Western blot检测肝脏PI3K(p110)、PKB和p-PKB(Ser473)的蛋白相对表达量(图7A)。
由图7B可知,PI3K(p110)和p-PKB(Ser473)蛋白相对表达量显著提高,其中花椒精油高、中、低剂量组PI3K(p110)蛋白相对表达量分别上调了319.53%、251.21%和167.43%,p-PKB(Ser473)的蛋白相对表达量分别上调了7.64、6.12 倍和2.73 倍,PKB蛋白表达量变化不显著。
图7C显示,与空白组对比,模型组PI3KmRNA和PKBmRNA相对表达量均显著下调(P<0.05)。给药28 d后,与模型组相比,花椒精油高、中、低剂量组的PI3KmRNA表达量分别上调87.5%、54.7%、36.9%,PKBmRNA表达量分别上调53.4%、52.8%、27.7%;模型组的GLUT2和GLUT4mRNA相对表达分别比空白组下降了50.4%、63.4%,而花椒精油高、中、低3 个剂量组GLUT2和GLUT4mRNA表达量分别比模型组高77.05%、76.35%、49.22%和133.3%、110.8%、94.9%。
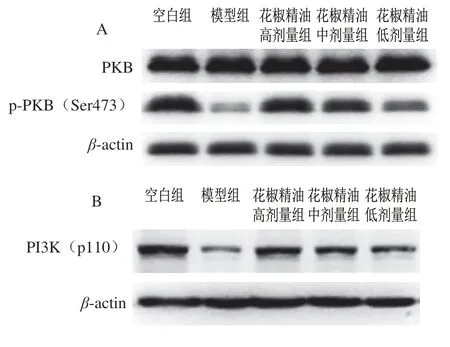
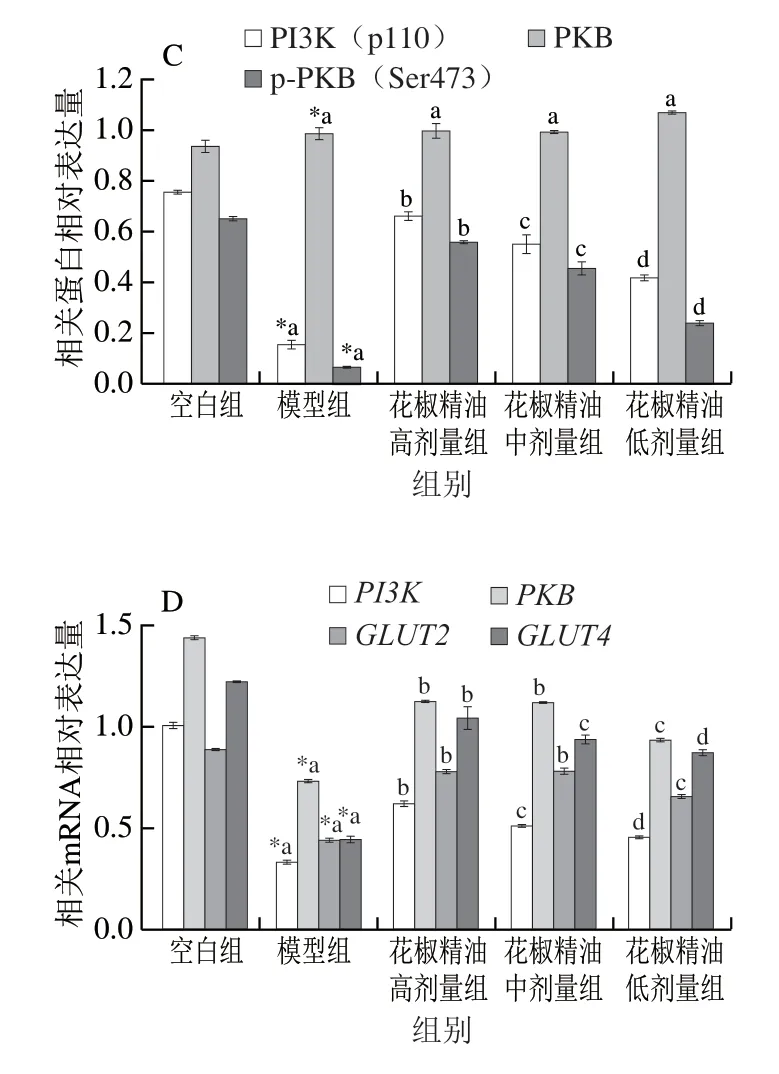
图 7 糖尿病小鼠肝脏和骨骼肌相关蛋白条带(A、B)、蛋白相对 表达量(C)和mRNA相对表达量(D)Fig. 7 Western blot patterns (A, B), and relative protein expression (C) and relative mRNA expression (D) of liver and skeletal muscle proteins in diabetic mice
3 讨 论
有研究表明,STZ对雄性鼠胰岛组织损伤程度强于雌性鼠,雄性动物对STZ较雌性更为敏感,造模成功率较高[28],因此本实验采用KM种雄性小鼠进行实验。STZ是一种从链霉菌中提取的抗生素,可特异性破坏胰岛β细胞,引发胰岛的自身免疫性炎症损伤和凋亡,胰岛β细胞受损导致胰岛素分泌迅速减少而血糖大幅度升高,出现糖尿病的症状[29]。
多饮、多尿、多食和体质量减轻的“三多一少”症状及高血糖是糖尿病患者最直观的症状,花椒精油对糖尿病小鼠的摄食量、饮水量及低体质量等症状具有明显的改善作用,这与王祖哲等[30]的结果相一致。空腹血糖浓度主要反映机体胰岛素分泌能力,是判断糖尿病的主要依据[31],根据国际通用的糖尿病诊断标准,正常人空腹血糖浓度应在3.3~6.1 mmo1/L,高于11.1 mmol/L则被诊断为糖尿病[32]。实验发现,花椒精油可降低空腹血糖浓度;糖耐量是指机体对葡萄糖的耐受能力,测定糖耐量可判断出胰岛素的分泌情况[33],实验结果显示花椒精油能提高糖尿病小鼠的糖耐量,降低AUC;这与钟礼云等[34]的研究结果一致。
GHb和GSP水平与血糖浓度成正比,主要表示过去4~8 周的平均血糖浓度控制水平,糖尿病患者的GHb和GSP水平均高于正常人[27],花椒精油可降低糖尿病小鼠的GHb、GSP水平。刘红芹等[35]发现葛根、桑叶、苦瓜、苦荞配方可降低糖化GHb和GSP水平,而本次实验结果也显示,3 个剂量组的GHb和GSP水平较模型组均有降低。胰岛素是体内唯一的降糖物质,缺乏胰岛素就会使血糖水平升高,血清胰岛素含量是糖尿病患者的重要检测指标[36],沈玖君[37]研究4 种食源性植物配方对糖尿病小鼠的降糖机制表明,与模型组相比,植物配方根叶组、全叶组、混合粉小鼠血清胰岛素水平分别升高了35.59%、23.60%和28.19%。本次实验结果也显示花椒精油可促进胰岛素的分泌。可初步推断花椒精油对1型糖尿病小鼠具有降糖效果。
现有研究表明,许多药物和植物可以影响胰岛素相关基因的表达从而降低血糖[38-39]。胰岛素通路有PI3K/PKB 和Ras-MAPK途径,其PI3K/PKB是胰岛素信号通路的主要途径[40-41]。GLUT2/4是细胞吸收葡萄糖的载体,GLUT2在肝脏中高度表达,形成葡萄糖分子通道,促进肝脏吸收葡萄糖合成肝糖原,肝细胞吸收7%的葡萄糖;而GLUT4在肌肉和脂肪中具有高表达量,形成分子通道,使肌肉细胞能够吸收葡萄糖并合成肌肉糖原,肌肉细胞吸收约70%葡萄糖,脂肪组织细胞吸收约7%[42-44]。当体内血糖浓度升高时,胰岛β细胞产生的胰岛素与其受体底物结合,PI3K蛋白被激活并大量表达,激活后的PI3K又介导下游的PKB蛋白高表达并磷酸化,磷酸化的PKB蛋白诱导GLUT2和GLUT4大量表达并由细胞质转位到细胞膜,形成葡萄糖通道促进细胞吸收葡萄糖形成糖原被机体利用从而降低血糖浓度[45-46]。结果显示,经28 d给药治疗,花椒精油3 个剂量组的肝糖原与肌糖原含量较模型组均有提高,其中高剂量组升高显著,这与游玉明[47]的研究结果一致。此外,模型组的PI3K、PKBmRNA表达量与空白组相比显著下调,证实了糖尿病小鼠 PI3K/PKB胰岛素信号通路被抑制而导致高血糖,经给药治疗后,高、中、低剂量的PI3K与PKB的mRNA相对表达量及PI3K(p110)与p-PKB(Ser473)的蛋白相对表达量比模型组分别显著上调且呈现剂量依赖现象。测定肝GLUT2mRNA与骨骼肌GLUT4mRNA相对表达量发现,模型组的GLUT2mRNA和GLUT4mRNA比空白组相比显著下降,而花椒精油3 个剂量组相比模型组显著上升。结果表明,花椒精油对糖尿病小鼠糖代谢基因的相对表达有显著影响。
综上所述,花椒精油对1型糖尿病具有降糖作用,其可能机制是通过激活PI3K/PKB途径,促使GLUT2/4的表达,促进肝细胞和肌细胞吸收葡萄糖,进而降低血糖浓度,达到治疗糖代谢紊乱的效果。此外,本实验仅从GLUT膜转位的胰岛素介导的PI3K途径进行了研究,而对非胰岛素介导的AMPK途径影响需待进一步研究。

