绿原酸对苹果采后灰霉病抗性的影响
王大将,张梦宇,岳正洋,周会玲*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
灰霉病是由一种坏死性和营养性病原性真菌灰葡萄孢(Botrytis cinereaPers.)侵染所导致的病害,是植物中最普遍和最具破坏性的病害之一,可致使500多种植物发生病害,给农业生产造成严重损失[1]。灰葡萄孢主要危害苹果的嫩茎、叶和果实[2],可通过寄生在植物残体内或以菌核的形态在土壤深处度过寒冬等恶劣环境,具有极高的生存能力[3],防治难度极大。目前防治灰霉病主要依靠使用化学杀菌剂,然而化学试剂的大量使用造成越来越多的食品安全和环境破坏等问题,并且由于灰葡萄孢的遗传灵活性和高进化潜力,杀菌剂的效果常常会被大量具有抗药性的田间灰葡萄孢菌株削弱[4-5]。因此,探究苹果自身物质对灰霉病的抗性是苹果灰霉病防治的重要手段。绿原酸(chlorogenic acid,CGA)又称3-O-咖啡酰奎尼酸,是由咖啡酸的1位羧基和奎尼酸的3位羟基缩合成酯的天然产物[6],具有抑菌消毒、活血降压、抗氧化、防衰老等功效[7],广泛应用于多个行业。研究发现,植物中提取的绿原酸对根霉、大肠杆菌、青霉菌均有较强的抑制作用[8]。Jiao Wenxiao等[9]研究发现,水蜜桃果实经绿原酸浸泡处理后接种扩展青霉,其在25 ℃贮藏期间的损伤直径和腐烂指数明显降低,绿原酸处理对果实硬度、可溶性固形物含量、pH值、可滴定酸含量等品质指标也有显著的改善作用。除此之外,Valiñas等[10]研究马铃薯块茎中的绿原酸合成途径时发现,绿原酸及其衍生物可以清除羟自由基和超氧阴离子自由基,减轻细胞膜脂的损伤和延缓细胞的衰老凋亡过程,提高植物的 抗病性[11]。作为苹果中含量较高的酚类化合物,绿原酸能否作为外源诱导因素增强苹果对灰霉病的抗性鲜有报道。本实验以‘富士’苹果为研究对象,以外源绿原酸浸泡处理后损伤接种灰葡萄孢,通过分析苹果发病过程中相关酶活性和物质含量的变化,探讨绿原酸在采后苹果灰霉病抗性中的作用,以期为绿原酸在采后苹果灰霉病的防治提供一定的理论依据。
1 材料与方法
1.1 材料、菌株与试剂
富士苹果(Malus domestica‘FuJi’)采于西北农林科技大学白水苹果试验站,要求大小均匀,成熟度、着色基本一致,且无病虫害和机械损伤。
灰葡萄孢(Botrytis cinereaPer.)分离自感染灰霉病的苹果果实,并进行纯化。将灰葡萄孢接种于PDA培养基中,并在25 ℃恒温避光条件下培养7 d,用含体积分数0.05% Tween-80的无菌水稀释成105个/mL的孢子悬浮液备用。
L-苯丙氨酸、苯甲基磺酰氟化物(phenylmethyl sulfonylfluoride,PMSF)、二硫苏糖醇(dithiothreitol,DTT) 美国Sigma公司;绿原酸(纯度98%) 上海源叶生物公司;聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、乙二胺四乙酸二钠、β-巯基乙醇、Tris-HCl、丙三醇、TritoX-100、磷酸、无水醋酸钠、冰醋酸、盐酸羟胺、亮抑酶肽均为国产分析纯。
1.2 仪器与设备
A11型液氮研磨仪 德国IKA公司;BSM-220.3电子 天平 上海卓精电子科技有限公司;Infinite M200pro全波长多功能酶标仪 瑞士Tecan公司;JXN-26高速冷冻离心机 美国贝克曼库尔特公司;HH-6数显恒温水 浴锅 常州国华电器有限公司。
1.3 方法
1.3.1 接种实验
在含有绿原酸质量浓度分别为0(对照)、100、200、300 µg/mL和500 µg/mL的PDA培养基上,分别接种20 μL 105个/mL灰葡萄孢悬浮液,放入培养箱中(25 ℃、黑暗)进行培养,并观察记录菌落直径,根据菌落直径筛选出合适的抑菌质量浓度,重复3 次。
在离体实验基础上,最终确定300 µg/mL为绿原酸的最佳抑菌质量浓度。苹果果实经体积分数70%乙醇溶液表面消毒后分为两组,每组60 个果实,一组用绿原酸溶液浸泡30 min,另一组(对照组)用清水进行相同处理,浸泡后取出在通风条件下自然风干,然后诱导24 h。用直径3 mm消毒钉在苹果赤道部位阴阳两面均匀刺2 个伤口(3 mm×3 mm),在伤口处分别接种20 µL 105个/mLB. cinerea悬浮液,晾干后覆上聚乙烯塑料薄膜(厚0.01 mm)保湿,贮藏于室温(22±2)℃、相对湿度85%~90%的条件下。对照组和处理组分别固定30 个果实,用于统计病斑直径和发病率,重复3 次。其余果实定期(0、6、12、24、48、72、120、168 h和216 h)取病斑周围1~2 cm内健康果肉组织,用液氮迅速冷冻后磨成粉末,装入锡箔纸袋中于-80 ℃保存,用于测定抗性相关代谢酶活力及活性物质含量。
1.3.2 指标测定
1.3.2.1 发病率和病斑直径测定
病斑直径利用游标卡尺进行十字交叉法测定,结果取平均值。苹果病斑直径不低于3.5 mm确定为发病,发病率按下式进行计算。

1.3.2.2 几丁质酶、β-1,3-葡聚糖酶活力测定
几丁质酶(chitinase,CHI)、β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)活力分别参考袁仲玉[12]、曹建康[13]等的方法测定。称取1 g果肉,加入5 mL pH 5.00.1 mol/L的乙酸-乙酸钠缓冲液(含1 mmol/L乙二胺四乙酸二钠和5 mmol/Lβ-巯基乙醇)冰浴研磨呈匀浆,离心(4 ℃、12000×g)后取上清液,即得到粗酶液。 以每分钟每克鲜果肉中酶分解胶状几丁质产生1×10-9molN-乙酰葡萄糖胺为1 个CHI活力单位(U);以37 ℃下每克鲜果肉每分钟催化底物昆布多糖产生1 nmol的葡萄糖为1 个GLU活力单位(U)。CHI和GLU活力单位均 为U/(min·g)。
1.3.2.3 苯丙氨酸解氨酶活力测定
苯丙氨酸解氨酶(phenylalanine amonialyase,PAL)活力测定参考Han Cong等[14]的方法。称取1.0 g果肉,加入2 mL 0.1 mol/L pH 8.7的硼酸提取缓冲液(含40 g/L PVP、2 mmol/L乙二胺四乙酸二钠、5 mmol/Lβ-巯基乙醇),冰浴条件下研磨成匀浆,4 ℃、12000×g离心30 min,取上清液,即得到粗酶提取液。以每小时每克鲜果肉组织酶促反应体系在290 nm波长处的吸光度增加0.01为1 个PAL活力单位(U),PAL活力单位 为U/(h·g)。
1.3.2.4 肉桂酸-4-羟化酶活力测定
肉桂酸-4-羟化酶(trans-cinnamic acid-4-hydroxylase,C4H)活力测定参考Liu Yaoyao等[15]的方法。称取1.0 g果肉于研钵中,加入3 mL提取液(含50 mmol/L的Tris-HCl、15 mmol/Lβ-巯基乙醇、4 mmol/L MgCl2、5 mmol/L抗坏血酸、10 µmol/L亮抑酶肽、1 mmol/L PMSF、0.5 g/100 g PVP、体积分数10%丙三醇),研磨至匀浆,于4 ℃、12000×g离心20 min,得到上清液(粗酶液)。以每克鲜果肉组织酶促反应体系在340 nm波长处吸光度变化0.01为1 个C4H活力 单位(U),单位为U/(h·g)。
1.3.2.5 4-香豆酰辅酶A连接酶活力测定
4-香豆酰辅酶A连接酶(4-coumarate-CoA ligase,4CL)活力测定参照Takshak等[16]的方法并略有改动。称取1.0 g果肉于研钵中,加入2 mL提取液(含0.2 mol/L Tris-HCl、8 mmol/L MgCl2、2 g/100 mL PVP、5 mmol/L DTT、体积分数0.1% Triton X-100、1 mmol/L PMSF)研磨至匀浆,于4 ℃、12000×g离心20 min,得到上清液(粗酶液)。以每分钟每克鲜果肉组织于333 nm波长处吸光度变化0.01为1 个4CL活力单位(U),单位 为U/(min·g)。
1.3.2.6 总酚和类黄酮含量测定
总酚和类黄酮含量分别参考Toor[17]和González-Aguilar[18]等的方法测定。称取1.0 g果肉,加入4 mL提取液(体积分数为1% HCl-甲醇,4 ℃预冷),研磨至匀浆,转入离心管中,在4 ℃下提取15 min,于4 ℃、12000×g离心30 min。取上清液分别在280 nm和325 nm波长处测定OD值,并以OD280nm和OD325nm分别表征总酚和类黄酮含量。
1.3.2.7 木质素含量测定
按照周会玲等[19]的方法测定木质素含量,以每克鲜果肉在280 nm波长处的OD值表征木质素含量。
1.4 数据处理与分析
所有指标均平行测定3 次。以SPSS 17.0软件进行数据分析,体外抑菌实验数据采用单因素分析进行最小显著性差异(least significance difference,LSD)分析,活体实验数据采用t检验进行差异显著性分析。用Excel 2007软件作图。
2 结果与分析
2.1 绿原酸对灰葡萄孢的体外抑制作用
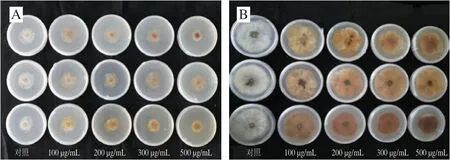
图 1 绿原酸处理对体外接种B. cinerea菌落的影响Fig. 1 Effect of chlorogenic acid treatment on B. cinerea colonies in vitro
菌落是微生物在固体培养基上以母细胞为中心生长形成的肉眼可见子细胞集团,其直径是反映微生物生长状况的最直观指标。如图1所示,以含有0、100、200、300、500 µg/mL绿原酸的PDA培养基接种B. cinerea,接种后72 h,各处理组病斑直径均小于对照组,菌落的颜色变为棕黄色,且随着绿原酸质量浓度增加,菌落颜色加深。接种后120 h各处理组病斑直径也均小于对照组,并且颜色由72 h时的棕黄色变成黄褐色,但不同质量浓度的绿原酸处理均未能完全抑制灰霉菌的生长。可见,绿原酸虽然不能完全抑制B. cinerea的生长,但与对照相比有抑制效果,并且能改变菌落的颜色,这可能是由于绿原酸处理影响了灰葡萄孢的正常生长。

图 2 绿原酸对体外接种B. cinerea菌落直径的影响Fig. 2 Effect of chlorogenic acid treatment on the diameter of B. cinerea colonies in vitro
由图2可知,在PDA培养基中,绿原酸质量浓度在0~300 µg/mL范围内增加时,灰葡萄孢菌落直径显著降低, 但当绿原酸质量浓度继续增加到500 µg/mL时,菌落直径不发生显著变化。因此,确定300 µg/mL为最佳抑菌质量浓度,并将其作为本实验绿原酸的使用质量浓度。
2.2 绿原酸对苹果灰霉病的抑制作用
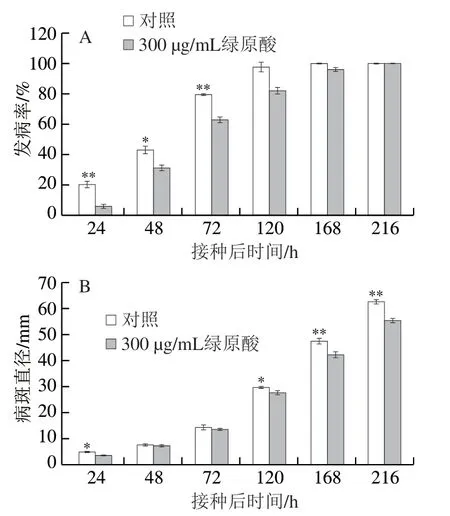
图 3 绿原酸处理对苹果灰霉病发病率(A)和病斑直径(B)的影响Fig. 3 Effect of chlorogenic acid treatment on incidence (A) and lesion diameter (B) of gray mold on ‘Fuji’ apple fruit
发病率和病斑直径是判断发病情况的重要指标。从图3A可以看出,接种后24 h,处理组和对照组果实均有发病,但对照组的发病率为20%,而处理组只有6%,差异极显著(P<0.01)。此后对照组和处理组发病率均先迅速增加再缓慢增加,对照组和处理组分别在120、168 h时的发病率接近100%。由图3B可以看出,对照组和处理组的病斑直径在接种后72 h内均比较低,两组无显著差异,120 h后两组病斑直径均迅速增加,但处理组病斑直径显著低于对照组(P<0.05、P<0.01)。图4为苹果灰霉病发病的外观照片。综上,绿原酸处理能有效抑制灰霉病病斑扩展,从而减缓苹果灰霉病的发生。

图 4 绿原酸处理对苹果灰霉病发病情况的影响Fig. 4 Effect of chlorogenic acid treatment on gray mold incidence on ‘Fuji’ apple fruit
2.3 绿原酸对苹果果实CHI和GLU活力的影响
作为果实中重要的病程相关蛋白,CHI和GLU是受到病原菌侵染、机械损伤或环境胁迫等条件诱导寄主 产生防御反应的重要物质。由图5A可知,接种灰葡萄孢后对照组和处理组CHI活力迅速增加,于48 h达到峰值,但此时处理组CHI活力比对照组高12.7%(P<0.01)。随后对照组和处理组CHI活力有所降低,但整个贮藏期间处理组的CHI活力均高于对照组。由图5B可知,对照组和处理组在贮藏过程中GLU活力总体上都表现出先增加再减小然后又增加的趋势,但处理组GLU活力整体上高于对照组。接种灰葡萄孢后,处理组GLU活力迅速增加,6 h时即达到较高水平,而对照组GLU活力前期增加不明显。两组GLU活力都在72 h达到峰值,但此时处理组GLU活力极显著高于对照组(P<0.01)。由此可见,绿原酸处理可显著提高CHI和GLU活力,从而增强对病原菌的抑制作用,提高果实的抗病力。
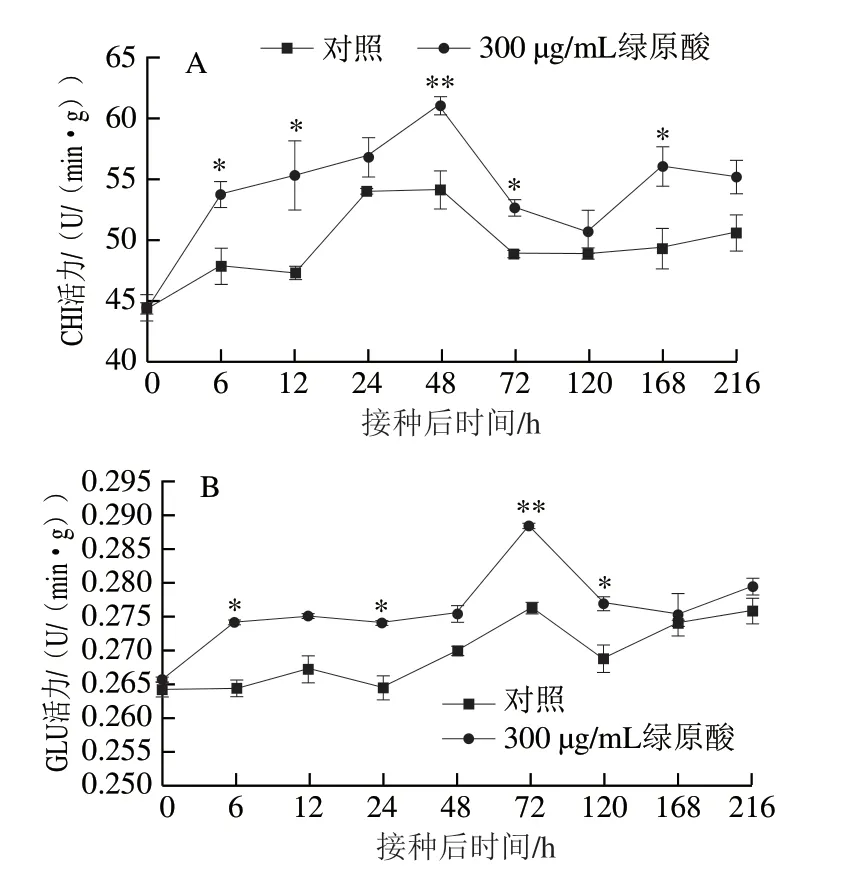
图 5 绿原酸对接种灰葡萄孢后苹果CHI(A)和GLU(B)活力的影响Fig. 5 Effect of chlorogenic acid on the activities of chitinase (A) and β-1,3-glucanase (B) in ‘Fuji’ apple fruit
2.4 绿原酸处理对苯丙烷代谢相关酶活力的影响
PAL与植物体内许多抗菌物质的生成密切相关,其活力是表征植物抗性的重要指标之一。如图6A所示,整个贮藏过程中,处理组果实PAL活力均高于对照组,且两组PAL活力变化总体上都表现为先升高后降低的趋势。接种灰葡萄孢之后,处理组果实PAL活力迅速增加,在24 h即达到峰值,此时处理组PAL活力比对照组高6.7%(P<0.01)。对照组果实PAL活力增长较慢,48 h才达到活力峰值。在贮藏末期,对照组PAL活力仍有升高的趋势,而处理组PAL活力开始降低,但处理组PAL活力高于对照组。
由图6B可知,接种灰葡萄孢之后,对照组和处理组C4H活力总体上都表现出先升高后降低然后再升高的趋势,且处理组C4H活力均高于对照组。两组C4H的活力都在12 h达到峰值,但此时处理组C4H活力比对照组 高15.4%(P<0.01)。显然,C4H在苹果抵御灰霉病的抗性反应中产生了响应,且绿原酸处理对这一过程有促进作用。
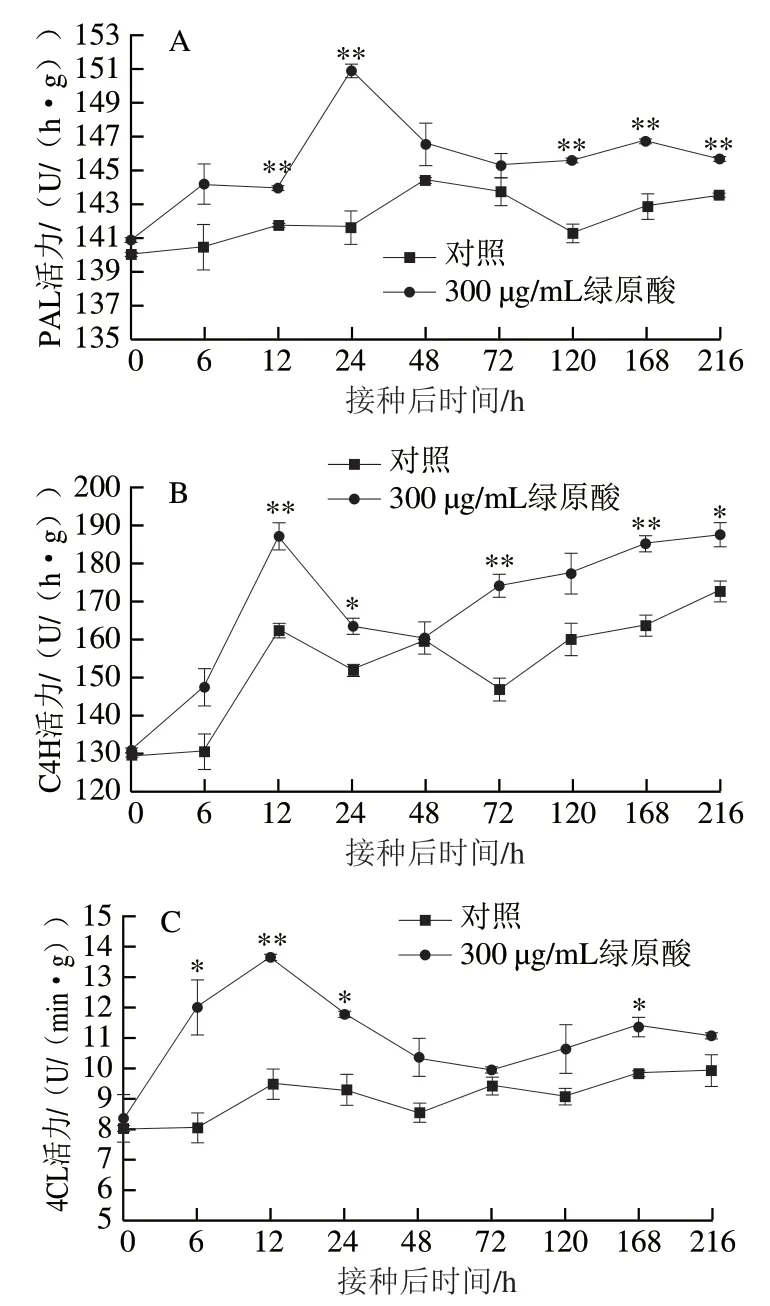
图 6 绿原酸处理对接种灰葡萄孢后苹果抗性相关酶活力的影响Fig. 6 Effect of chlorogenic acid treatment on the activities of gray mold disease resistance-related enzymes in ‘Fuji’ apple fruit
4CL是总酚、类黄酮、木质素等与抗性相关物质合成过程中一种关键性的限速酶,其活力常作为表征植物抗病性的一个重要指标。由图6C可知,整个贮藏期间处理组果实4CL活力出现2 个峰值,而对照组4CL活力则表现出波动的变化趋势,且无明显的活力峰,并且处理组4CL活力始终高于对照组。处理组果实在接种灰葡萄孢后12 h时的4CL活力与对照组差异最大,比对照组高43.2%(P<0.01)。48 h之后两组4CL活力之间的差异虽然不显著,但处理组4CL活力仍高于对照组。由此可见,外源绿原酸处理可以提高4CL活力,且影响作用在接种后初期更为明显。
2.5 绿原酸处理对苯丙烷代谢途径次生物含量的影响
总酚和类黄酮是植物体内的直接抑菌物质,其含量与植物抗病能力密切相关。由图7A可知,整个贮藏过程中,处理组苹果果实总酚含量高于对照组。接种灰葡萄孢后对照组和处理组总酚含量均迅速增加,但贮藏初期两组总酚含量差异并不显著。随着病害的发展,两组 果实中总酚含量差异逐渐增大,到24 h时达到极显著水平(P<0.01),此时处理组总酚含量比对照组高40%。接种24 h后,两组总酚含量都开始缓慢减少,但216 h时但处理组总酚含量仍显著高于对照组(P<0.05)。

图 7 绿原酸处理对苹果灰霉病抗性相关物质含量的影响Fig. 7 Effect of chlorogenic acid treatment on the contents of gray mold resistance-related substances in ‘Fuji’ apple fruit
由图7B可知,整个贮藏过程中,处理组类黄酮含量均高于对照组。接种灰葡萄孢之后处理组类黄酮含量迅速增加,在12 h达到峰值,此时比对照组类黄酮含量高25%(P<0.01)。12 h后处理组类黄酮含量出现一个短暂的降低过程,但随后又开始升高,并且直到贮藏末期,处理组类黄酮含量仍极显著高于对照组 (P<0.01)。可见,与对照组相比,绿原酸处理可以明显提高苹果对灰霉病的抗性反应过程中类黄酮的含量。
木质素可以强固细胞壁和增加抗性,是植物抗性系统的重要组成部分。由图7C可知,接种灰葡萄孢后,处理组木质素含量迅速增加,于72 h达到最高,此后有所降低,而对照组的木质素含量上升比较缓慢,120 h达到最高,之后处于相对稳定状态。但整个过程处理组木质素含量明显高于对照组。可见,与对照组相比,绿原酸处理可以使苹果在抵抗灰霉病的抗性反应过程中积累更多的木质素。
3 讨 论
绿原酸是植物体内普遍存在的一种与抗性密切相关的酚酸类物质[20]。研究表明,抗病性强的苹果品种含有的绿原酸较多,且在受到病原菌侵染后,其绿原酸增加量显著高于抗性低的苹果品种[21]。李珊珊等[22]研究表明,绿原酸对西瓜枯萎病菌有较强的离体抑制作用,且随着浓度的升高,其抑菌活性呈现出增强的趋势。本研究发现,绿原酸处理能明显降低苹果灰霉病发病率,抑制病斑直径,且在接种前期表现较为突出。可能是由于前期用绿原酸浸泡处理导致部分绿原酸渗入果实内部,从而对灰葡萄菌产生直接抑制作用,因此在接种后24 h,处理组的发病率与对照组有极显著差异 (P<0.01),此时处理组病斑直径也显著低于对照组(P<0.05)。随着绿原酸在果实内部被代谢,其浓度逐渐降低,处理组发病率与对照组差异逐渐缩小。发病末期,处理组病斑直径显著低于对照组,可能是由于外源绿原酸处理提高了果实自身抗病能力,从而抑制了病斑扩散情况。
植物体内的CHI和GLU在抵御病原菌侵染的防卫反应中主要起细胞壁水解酶的作用[23]。Schlumbaum等[24]研究发现,菜豆积累的CHI经过提纯后,在体外能够明显抑制绿色木霉(Trichoderm viride)菌丝的生长。正常情况下,CHI和GLU主要分布于植物细胞液泡内,细胞间隙中相对较少[12],且活性很低,当病原菌侵染植物后会对细胞膜造成损害,从而诱导CHI和GLU活性升高[25]。本实验中,接种灰葡萄孢后,处理组CHI和GLU活力迅速增加,且在整个贮藏期间均大于对照组,有效提高了苹果的灰葡萄孢抗性,与袁仲玉[12]、周晓婉[26]等利用1-甲基环丙烯、芦荟粗提物诱导苹果灰霉病抗性的结果一致。
苯丙烷代谢是植物抗病反应中重要的代谢途径之一。PAL是苯丙烷代谢途径中第一个催化产生酚类的酶,可催化苯丙氨酸生成肉桂酸,对酚类、植物抗毒素和木质素的生物合成具有调节作用[27]。C4H可以催化肉桂酸生成4-香豆酸,是苯丙烷代谢途径中重要的节点酶之一[28]。4CL催化对香豆酸形成的对香豆酸辅酶A是多个重要代谢分支的前体物质,可进一步合成绿原酸等酚酸类,也可在查耳酮合成酶的催化下形成查耳酮和根皮苷等类黄酮类[29]。PAL、C4H和4CL作为苯丙烷代谢途径上游的几个关键节点酶,负责催化多种物质的合成[30], 为整个代谢途径的众多下游分支提供前体物质,其活性与植物的抗性密切相关。经外源绿原酸处理的果实在接种灰葡萄孢后,PAL、C4H、4CL活力迅速升高,在很短时间内达到较高水平,可以更快地积累与抗病性相关的次生代谢产物,从而提高果实的抗病性。
作为苯丙烷途径的次生代谢产物,总酚和类黄酮具有杀菌、抗病毒、清除自由基等多种与植物抗病性相关的生物活性[31]。Deng Jianjun[32]和Li Guangjin[33]等研究发现,苯丙烷代谢途径关键酶活性的增加可以促进总酚、类黄酮的积累,从而增强桃、甜瓜对病原菌的抗性。本研究发现,PAL、C4H、4CL活力升高的同时,总酚、类黄酮含量也增加,绿原酸处理组果实中总酚和类黄酮含量明显高于对照组,这与Terry等[34]的研究结果一致。本实验中,接种灰葡萄孢后,绿原酸处理组和对照组木质素含量都明显增加,但处理组木质素含量增加更多。木质素可以与细胞壁多糖、细胞壁蛋白结合,增厚细胞壁形成机械屏障,阻止病原菌侵入及其在植物体内的扩展[35]。
综上,与对照相比,外源绿原酸处理可以明显提高果实中CHI和GLU活性,抑制灰葡萄孢的生长,同时提高苯丙烷代谢途径中PAL、C4H、4CL等关键酶活性,促进次生代谢产物总酚、类黄酮和木质素的积累,从而提高果实的抗病性,有效改善接种果实发病情况。

