噬菌体在控制肉源致病菌中的应用研究进展
杨慧轩,罗 欣,朱立贤,杨啸吟,韩广星,董鹏程,*,张一敏,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家肉牛牦牛产业技术体系临沂站,山东 临沂 276000)
中国作为世界肉类生产和消费大国,肉类产能巨大,2018年全国肉类产量达8624.63万 t[1]。肉类产业作为食品行业发展中的一个重要的经济增长点,其发展前景不可估量[2],但是生鲜肉及其制品在到达消费者餐桌之前,动物屠宰、肉类加工、贮存、运输和分销等环节都易受到各种有害微生物的影响。如近年来相继报道的大肠杆菌(Escherichia coli)O157:H7[3]、李斯特菌(Listeriaspp.)[4]、沙门氏菌(Salmonellaspp.)[5]等微生物污染肉类制品的事件,对肉类产业造成了巨大的经济损失,并严重威胁着消费者的健康安全[6]。因此,在不断创新微生物控制技术,健全食品法律法规的同时,亟需一种高效、安全的致病菌防控技术。
目前,致病菌的防控以使用抗生素为主,但是抗生素的应用容易造成耐药菌株的产生[7]。近年来,噬菌体减菌技术受到越来越多的关注,很多学者将该技术应用于肉类致病菌的防控,并已取得一定的进展。但是噬菌体在不同肉类(如牛肉和鸡肉),甚至是同一畜禽肉的不同加工类型(如肉块和肉糜)中的使用条件和对不同种类致病菌的减菌效果存在很大差异,因此需要对该技术在肉类加工中的应用进行系统的总结,以明确噬菌体在肉源致病菌防控中的应用潜力。本文根据近年来噬菌体在肉源致病菌防控中的研究进展,将噬菌体对几种重要致病菌(包括大肠杆菌、单核增生李斯特菌和沙门氏菌)的防控效果进行了详细综述,以期为噬菌体减菌技术在肉类生产中的应用提供参考。
1 噬菌体的抑菌性质与应用
噬菌体通过侵染细菌并导致其裂解死亡,具有高度的宿主特异性,能够高效侵染和裂解目标菌,并具有保持天然微生物菌群不受干扰的优势[8]。
噬菌体在生物圈中无处不在,每一种细菌与其对应的噬菌体不唯一,这有利于解决细菌会产生耐药性的问题[9]。噬菌体具有高度宿主特异性,噬菌体和细菌在布朗运动过程中二者的特异性位点相互结合[10],除极少数噬菌体外,每一株噬菌体只浸染一种细菌,因此在使用噬菌体控制目标菌群的同时不会干扰其他微生物的正常生长,其相比于常见的有机酸、抗生素等杀菌剂有绝对的优势。此外,噬菌体在控制人类疾病方面有近百年的历史,曾有效防治了炭疽、肺结核、布鲁氏菌病、沙门氏菌病、痢疾等很多细菌和病毒疾病[11], 表明其应用具有一定的安全性。目前。已经出现商用噬菌体制剂,其中10 种制剂被美国食品药品监督管理局评定为公认无害[12]。噬菌体因其具有高度的特异性、基因转导能力和快速的繁殖力,已有学者开发出噬菌体关联应用技术。Tomat等[13]在以浓缩乳清蛋白为基础的可食性薄膜中加入包含6 种噬菌体的混合制剂,组成具有抗菌性能的活性包装材料,其能够使肉中的E.coliDH5α和E.coliO157:H7完全失活;Srinivasan等[14]合成了噬菌体qdv001的内溶素基因(Vplys60),并在毕赤酵母X-33中表达,内溶素在显著抑制副溶血性弧菌(Vibrio parahaemolyticus)生物膜形成的同时,还显著降低了该菌群的数量,这表明噬菌体内溶素可作为有效的生物防治新策略;Colom等[15]采用海藻酸钠/CaCO3将噬菌体微胶囊化,使其免受胃液的破坏,较非包封噬菌体能够更好地控制肉鸡中的沙门氏菌。总体来看,噬菌体是一种来源广泛、特异性高、具有较高安全性的生物抑菌物质,并能够用于多种关联技术的开发。
2 噬菌体在防控肉源致病菌中的应用
2.1 大肠杆菌
E.coli是哺乳动物体内常见的消化道细菌,但是一些产志贺氏素E.coli可能会引发严重的食源性疾病,也可能发展为致命性疾病,如溶血性尿毒综合征。由于噬菌体具有特异性清除细菌的能力,可作为控制食品中主要E.coli的有效手段。表1概述了噬菌体在防控肉源性大肠杆菌中的应用情况,并重点讨论感染复数(multiplicity of infection,MOI)、温度、噬菌体制剂组成对牛肉中E.coli的影响。
2.1.1 感染复数
MOI显著影响噬菌体的抑菌效果,由表1可知,在大部分情况下,接种菌数量一定时,添加的噬菌体数量越多即MOI越高,抑菌效果越明显。Tomat等[19]发现高浓度噬菌体处理组DT1(滴度为1.7×1010PFU/mL)和DT6(滴度为1.4×1010PFU/mL)抑菌效果均优于相同噬菌体处理方式下的滴度较低组分,并且DT6在24 ℃时,高MOI的噬菌体混合液24 h后杀菌效果依然显著,这为噬菌体制剂应用滴度的选择提供了理论参考。Hudson等[20]也发现,在103~107PFU/4 cm2范围添加噬菌体,减菌效果在3.2×107PFU/4 cm2时最好,且在冷却环境下可将牛肉中的E.coliO157:H7降低 2.3(lg(CFU/4 cm2))。该研究也同时表明,高MOI的噬菌体更适用于冷却牛肉中致病菌的防控。但并非所有的噬菌体都随着MOI的升高其作用效果更好,Liu Hongxi等[22]研究噬菌体T5、T4、T1和O1及其混合液抑制肉中E.coli时,发现噬菌体O1在MOI=1000时的 抑菌效果并不优于MOI=10。一般来说,噬菌体的浓度越高,降低目标菌株的数量越显著,较多的噬菌体添加量提升了其与测试菌株的接触机率,理想状态下,目标菌都应该至少和一个噬菌体发生有效接触,因此大部分研究都采用了高MOI进行实验。但是高MOI的有效杀菌水平并不意味着实际应用中要在食品中添加大量的噬菌体,如E.coliO157:H7在食物中引发食源性疾病的细菌数量通常少于1(lg(CFU/g)),而在实验室中模拟疾病爆发所使用致病菌的浓度远高于该水平[17],因此噬菌体在自然污染条件下防控致病菌的最适MOI还需根据具体的污染水平进行确定。
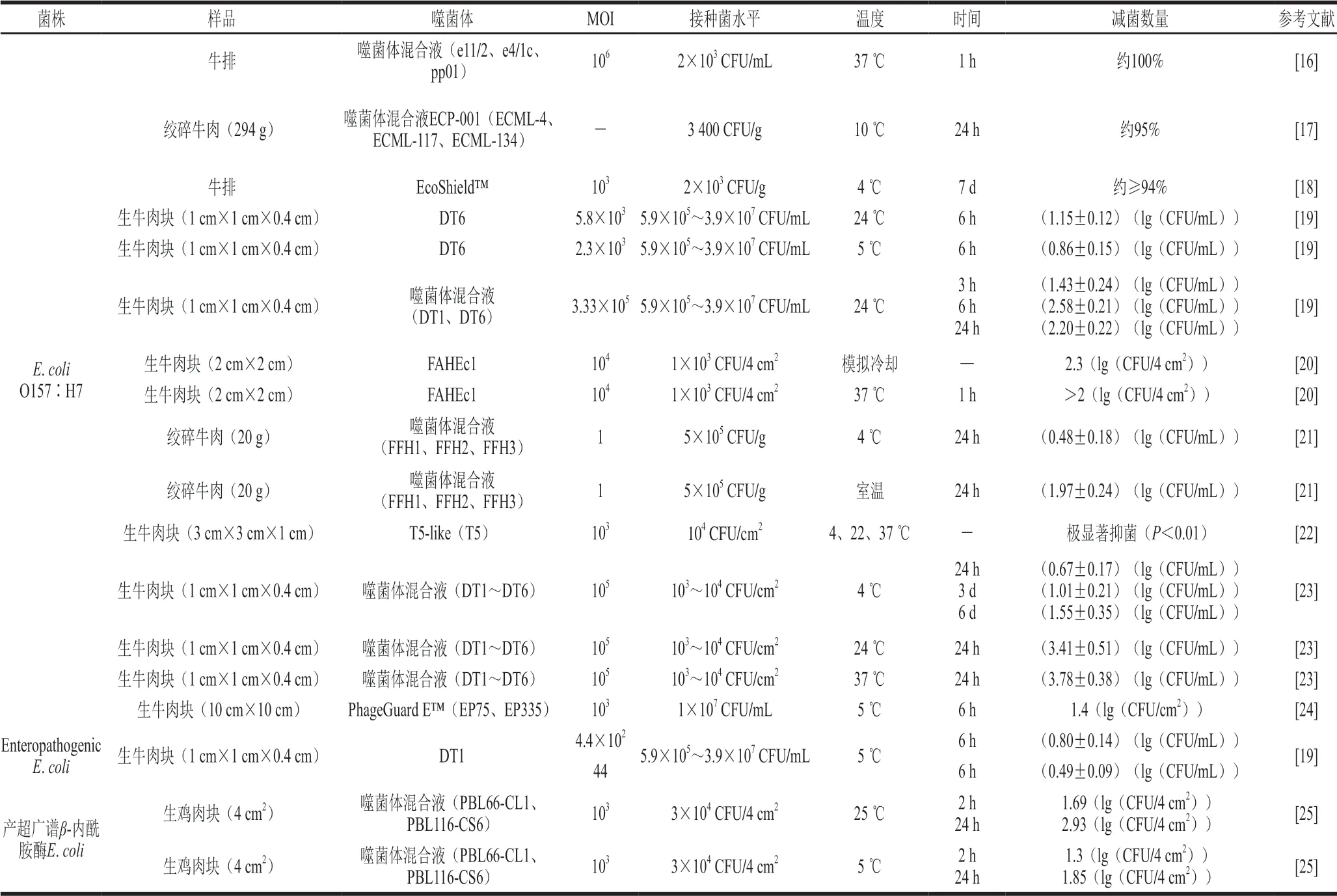
表 1 噬菌体对肉类中大肠杆菌污染的防控效果Table 1 Controlling effect of bacteriophage on E. coli contamination in meat
2.1.2 温度
不同温度条件下噬菌体抑制E.coliO157:H7的效果有所差异。由表1可知,在4~37 ℃的温度条件下,噬菌体都可以显著抑菌,且室温条件下处理的噬菌体短时抑菌效果明显优于冷藏条件。Tomat等[19]发现噬菌体DT6在5 ℃和24 ℃条件下均能够显著降低E.coliO157:H7的数量,且24 ℃明显优于冷藏条件下的杀菌效果。同样,在噬菌体混合液的减菌研究中,Hong等[21]发现室温下噬菌体可降低碎牛肉中(1.97±0.24)(lg(CFU/mL))的E.coliO157:H7,而在4 ℃条件下减菌数量仅为(0.48±0.18)(lg(CFU/mL))。Duc等[25]研究了噬菌体混合液对生鸡肉中产超广谱β-内酰胺酶E.coli的抑制作用,也发现了噬菌体抑菌的温度差异性。在25 ℃和5 ℃贮藏温度下6 h后该菌菌落总数分别降低2.02、 1.67(lg(CFU/4 cm2))。这是由于噬菌体的增殖依赖于细菌的新陈代谢,在宿主菌最佳的生长条件下,噬菌体有最大的增殖速率和释放量[26]。而低温下较低的营养利用效率会延长噬菌体的潜伏期,也会降低噬菌体的释放量[27],因此低温下噬菌体的抑菌效果会受到影响。虽然室温下噬菌体的抑菌效果通常要优于冷藏条件,但是室温下生鲜肉会较快发生腐败,不利于延长肉类的货架期。尽管冷藏温度下噬菌体的杀菌效果弱于室温条件,但其仍是传统杀菌剂的良好替代品。Shebs等[24]将一种商业噬菌体应用于牛肉中E.coliO157:H7的防控,发现在冷藏条件下,其抑菌效果显著优于乳酸和过氧乙酸。低温下,噬菌体由于潜伏期延长而延迟了细菌裂解,但其仍有显著的杀菌效果,并且大多数食源性致病菌在低温下生长延缓,所以噬菌体在冷却肉中仍具有较大的应用潜力。
2.1.3 噬菌体制剂组成
混合噬菌体和单一噬菌体制剂的抑菌效果也有较大的差异,通常噬菌体混合液具有更宽的宿主谱,抑菌效果也要优于单一噬菌体。O’flynn等[16]使用了3 种噬菌体的混合液检测其对E.coliO157:H7的抑制效果,发现其中7 组无E.coliO157:H7检出,另外两组E.coliO157:H7数量均少于10 CFU/mL,Abuladze等[17]使用噬菌体混合制剂得到了相似的杀菌效果,其在24 h后能够降低肉中95%的E.coliO157:H7。Tomat等[23]在牛肉中采用含有6 种噬菌体的混合液来研究其抑菌效果,在4 ℃下贮藏6 d依然有较好的抑菌效果,而贮藏24 h时24 ℃和37 ℃条件下有更高的抑菌效果,且抑菌效果优于单独施用噬菌体。在商业噬菌体中,一般采用噬菌体混合液来制作商业噬菌体制剂。Carter等[18]评价了一种商业噬菌体的杀菌效果,该制剂在4 ℃贮藏条件下杀灭了94%以上的初始菌,E.coliO157:H7数量在贮藏的7 d内持续降低。混合噬菌体往往具有更宽的宿主谱,不敏感菌株较单一噬菌体少,并且还能有效地避免出现细菌抗噬菌体问题[28],因此混合噬菌体具有更好的抑菌效果。但也并非所有噬菌体混合液都比单一噬菌体效果更好,Liu Hongxi等[22]发现T5噬菌体在所有温度下都比噬菌体混合液更有效,这可能是噬菌体之间出现了竞争干扰,此机制还有待进一步明确。
综上所述,较高的MOI增加了E.coli接触噬菌体的机率,选用高MOI会有较好的抑菌效果,但是在实际应用中,并不意味着大量的噬菌体将被添加进肉制品中,应同时考虑到经济成本及肉中实际存在的致病菌数量;噬菌体在冷藏温度下仍有显著的抑菌效果,可以很好地控制冷藏肉制品中的致病菌;噬菌体的高度特异性决定了其在应用时只能作用于致病菌中有限的种类,使用噬菌体混合制剂可以拓宽其作用范围,并且可以解决细菌抗性等问题,但噬菌体制剂的组成,是否会出现噬菌体之间的竞争干扰,均需要在后续研究中进一步明确。
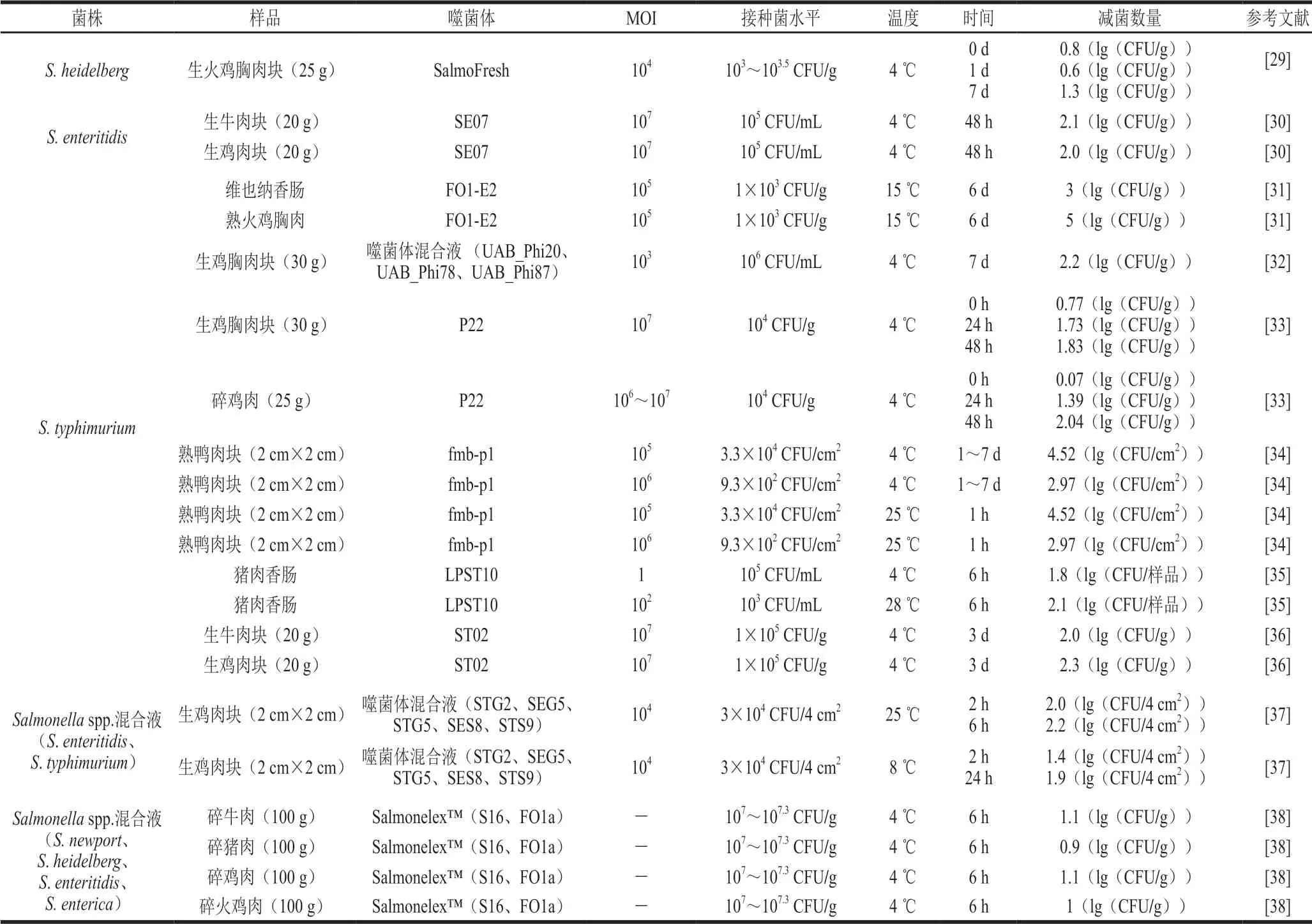
表 2 噬菌体对肉类中沙门氏菌污染的防控效果Table 2 Controlling effect of bacteriophage on Salmonella spp. contamination in meat
2.2 沙门氏菌
Salmonellaspp.是造成腹泻病的主要病原体之一,感染沙门氏菌病的患者通常会发生腹泻、腹痛、恶心、呕吐等。并且一些特殊血清型(如肠炎血清型、鼠伤寒血清型)在人群中传播时,也会引发严重的食源性疾病,甚至危及患者生命。表2概述了噬菌体在防控肉源Salmonellaspp.中的应用情况,并重点讨论了肉类呈现 方式(如块状、肉糜状)和畜禽肉种类(如牛肉、鸡肉)对噬菌体控制肉中常见Salmonellaspp.的影响,此外噬菌体的来源也会影响其抑菌效果。
2.2.1 肉类呈现方式
由表2可知,噬菌体的作用效果会受到生鲜肉呈现方式的影响,一般情况下,在较少切分的肉样中有更好的抑菌效果。Zinno等[33]将噬菌体分别接种在鸡肉块和碎鸡肉中,研究其对S.typhimurium的减菌效果,结果显示在24 h内噬菌体在块状鸡肉样品中的抑菌效果较优,Sharma等[29]在火鸡肉中也发现了类似的现象,噬菌体在切碎的火鸡肉样本中的抑菌效果并不显著,而后者施用的噬菌体MOI远低于前者,这更提高了噬菌体在碎肉中的作用难度。切碎的肉样具有更大的表面积,这意味着需要更多的噬菌体才能提供快速有效的保护。Yeh等[38]在碎肉中接种Salmonellaspp.(107~107.3CFU/g)混合液及噬菌体,滚揉2 min后置于4 ℃下贮藏,结果发现噬菌体6 h内均显著抑菌。该研究表明噬菌体可在滚揉过程中发挥作用,有望成为一种食品栅栏因子并提高肉类安全。但噬菌体易受到食品结构的影响,如在表面积大和干燥的食物表面,都会增加噬菌体扩散并接触到宿主细胞的难度,因此,如何根据不同的肉类呈现方式设计合理的施用方式及MOI,是噬菌体在肉类加工应用中亟待解决的问题。
2.2.2 畜禽肉种类
噬菌体在不同的畜禽肉类食品基质中均有较强的抑菌能力。Thung等[30,36]先后分离出两株噬菌体SE07和ST02,其有效控制了生鲜鸡肉和牛肉中的S.enteritidis以及S.typhimurium的生长,可用来降低在零售期间常见Salmonellaspp.污染的风险。同样地,Yeh等[38]发现同一噬菌体制剂在生鲜碎猪肉、碎牛肉、碎鸡肉和碎火鸡肉中,在相同时间内对测试菌株杀灭效果无明显差异,都降低了约1(lg(CFU/g))的混合Salmonellaspp.。此外,噬菌体在即食食品的相关研究中也表现出较好的 杀菌效果[31,34]。由此可见,噬菌体在生鲜肉和即食产品中均有较大的抑菌潜力。但值得注意的是,上述研究中的研究对象均为固体类的肉类食品,噬菌体喷洒在固体表面不易扩散,相较液体食品往往需要更高的MOI,因此如何让噬菌体在应用对象中更均匀地分散,是提高噬菌体杀菌效率、降低使用成本的关键。
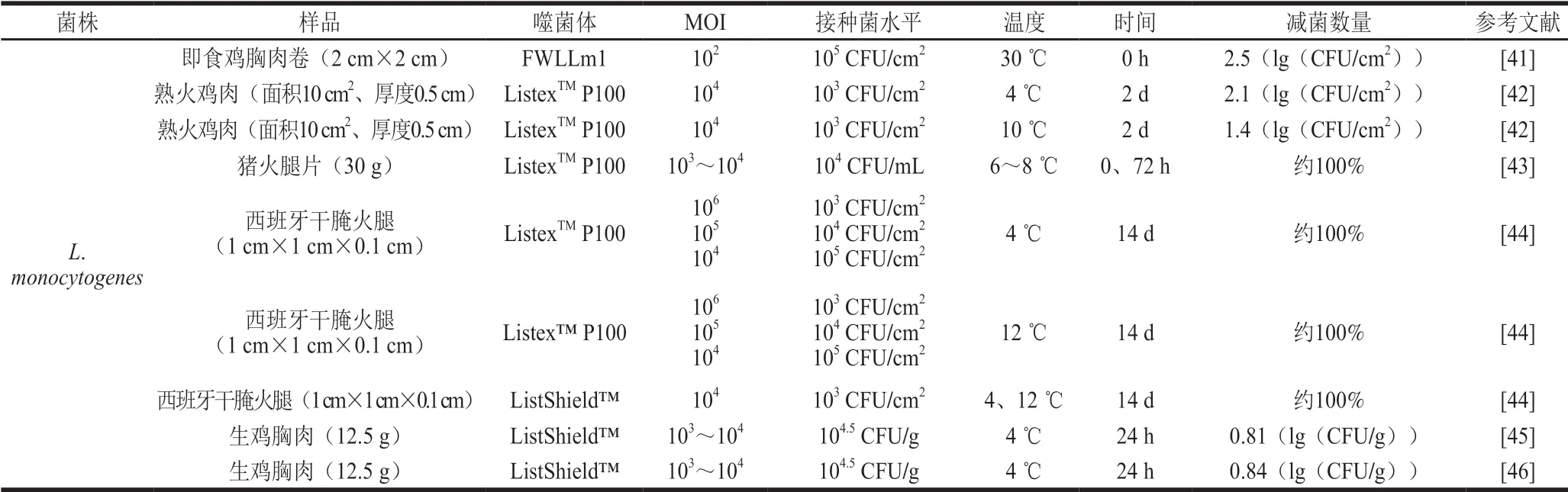
表 3 噬菌体对肉类中单核增生李斯特菌污染的防控效果Table 3 Controlling effect of bacteriophage on L. monocytogenes contamination in meat
2.2.3 噬菌体的来源
自然界中存在大量的噬菌体,应筛选到宿主广泛、裂解性强的烈性噬菌体作为生物抑菌剂将其应用于食品安全领域。研究表明,宿主密度低的场所分离出的样品具有更广泛的宿主范围,Huang Chenxi等[35]从存在低密度宿主菌的场所(废水处理厂、河流附近的污水、禽舍和附近的农场沟渠)分离出58 株噬菌体,其中筛选出3 株高效灭菌的噬菌体LPST10、LPST18和LPST23。对于LPST10,不论是4 ℃还是28 ℃,采用相对较低的MOI(1、100)均可显著降低猪肉香肠中 2(lg(CFU/样品))左右的S.typhimurium。Wang Changbao等[34]从养鸭场污水分离纯化出一株广谱且具强裂解性的噬菌体fmb-p1,并将其应用于即食鸭肉中,他们发现高MOI(105和106)的4 ℃处理组在贮藏1~7 d 内均无Salmonellaspp.检出,25 ℃处理组中不同MOI的 噬菌体在接种1 h后也无Salmonellaspp.检出,即食鸭肉中Salmonellaspp.的生长被高MOI的强裂解性噬菌体几乎完全控制。畜禽养殖农场的污水以及畜禽粪便等都可作为良好的噬菌体来源,还有研究表明,以不同动物共存为特征的养殖系统中噬菌体具有更丰富的血清型且宿主范围更广泛[39],在这些来源中筛选出的强裂解性、广谱的噬菌体是未来噬菌体制剂理想的选择。
综上所述,噬菌体在不同的畜禽肉类中均可显著抑制Salmonellaspp.的生长,但是其在不同肉类呈现方式(如块状、碎肉)中的抑菌效果有所不同。由于实际生产中一般污染的致病菌较少,并不能支持噬菌体进行大量的自我增殖,因此,想达到理想的杀菌水平, 噬菌体必须能够充分地扩散和均匀地分布。另外,从目前的研究可以看出,与畜禽生活相近的场所如周边污水、沟渠等都是理想的噬菌体来源,并且其中筛选出的强裂解性、宿主广泛的噬菌体是未来噬菌体制剂的最佳选择。
2.3 单核增生李斯特菌
L.monocytogenes是一种重要的食源性致病菌。高致死率和广泛的来源(如动物粪便、土壤、食品和食品加工厂)使其对食品安全构成了严重的威胁。此外,L.monocytogenes在冷藏环境中的适应能力以及其生物膜的形成能力让传统的抑菌方式受到挑战[40]。表3概述了噬菌体在防控肉源L.monocytogenes中的应用情况,重点讨论了商业噬菌体联合应用其他抑菌剂在肉及其制品中的抑菌效果。
由于商业噬菌体便于获取、使用简便,大量学者将商业噬菌体与传统杀菌方式相结合,探究二者的联用在L.monocytogenes方面的防控效果。Yang等[45]将ListShieldTM与月桂酸精氨酸乙酯联用,结果发现L.monocytogenes数量下降了1.96(lg(CFU/g))。随后Yang等[46]又将此噬菌体制剂与紫外光杀菌联用以控制鸡肉中的L.monocytogenes,结果发现减菌数量达到2.04(lg(CFU/g)), 且对肉色、pH值、脂肪氧化以及感官评价均无影响。上述实验结果说明,复合减菌方式可能在实际生产加工中更有效。另外,较小的MOI可能会导致部分细菌无法与噬菌体接触,或存在噬菌体不敏感的菌株往往会在实验后期造成细菌数量回升的现象,因此,采用与其他减菌方式联用将是解决上述问题的一种有效手段。Chibeu等[42]发现商业噬菌体在短期内显著抑菌后,随着贮藏时间的延长L.monocytogenes又恢复生长,贮藏28 d后,样品中的细菌数量回升到6~8(lg(CFU/cm2)),随后将乳酸钾及双乙酸钠与噬菌体制剂联用,发现L.monocytogenes在牛肉和鸡肉整个贮藏期间(4 ℃)细菌数量均未超过2(lg(CFU/cm2)),该研究同样证实复合减菌法的使用可能会使肉制品更安全。但是,并非所有的联用方式都取得了更好的效果,Figueiredo等[43]研究了Listex™ P100、乳酸链球菌素和乳酸钠单独和联用在猪火腿切片中的抑菌效果,结果显示在6~8 ℃下噬菌体处理组0 h和72 h时均无L.monocytogenes检出,噬菌体的抑菌效果最好,因此合理高效的联用方式还需要进行不断实验探索。
与非商业噬菌体一样,商业噬菌体的使用也受到多种因素(如使用滴度、目标菌株的敏感程度等[42,44])的制约,非商业噬菌体的显著抑菌作用为丰富噬菌体制剂的开发提供了重要的参考价值。高效、广谱噬菌体制剂的设计方案仍需要大量的噬菌体筛选实验来确定。而合理的使用方式以及使用的时间也是设计噬菌体制剂应该考虑的问题。目前来看,商业化的噬菌体制剂不论是单独还是与其他杀菌方式联合使用都对L.monocytogenes表现出了极好的抑菌效果,并且联合应用可以很好地弥补噬菌体杀菌的不足。
2.4 噬菌体在其他致病菌中的应用
除上述几种食源性致病菌外,还有部分学者探究了噬菌体在动物源性食品中对其他致病菌(如金黄色葡萄球菌(Staphylococcus aureus)、空肠弯曲杆菌(Campylobacterjejuni)和V.parahaemolyticus等细菌)活性的影响。
禽肉是C.jejuni的主要来源,一些研究发现噬菌体制剂可作为一种有效的手段来抑制C.jejuni。Zampara等[47]在丹麦家禽养殖厂中分离出19 株噬菌体,并在其中筛选出两株抑菌效果最好且依赖荚膜多糖侵染细菌的噬菌体F356和F357,并将二者组成的噬菌体混合液以 MOI=1000的接种量应用于鸡表皮上,结果发现在5 ℃贮藏温度下24 h后可降低0.73(lg(CFU/g))的C.jejuni。
S.aureus是一种致病性极强的致病菌,因其通常会造成奶牛乳腺炎而对奶及奶制品污染极为广泛,在肉类制品中,火腿也是其主要的污染载体之一。Chang等[48]评价了源于噬菌体SA11的内溶素LysSA11作为生物防治剂在食品中的应用效果,加入1.125~9 μmol/L内溶素LysSA11于火腿样品上,其可以在15 min内有显著的杀菌效果,并分别在4 ℃和25 ℃减少了样品中3.12(lg(CFU/cm3)) 和3.37(lg(CFU/cm3))的S.aureus。该研究表明噬菌体内溶素也可作为一种食品抗菌剂被开发利用,为噬菌体保护食品安全提供了新思路。
V.parahaemolyticus是一种能引起人畜共患病的细菌,并且常见于海鲜产品,食用生或者未煮熟的海鲜产品都有可能发生由此类细菌引起的食物中毒。Ren Hongyu等[49]首次通过给海参喂食噬菌体来研究防控V.parahaemolyticus的效果,结果显示对照组海参存活率不足30%,MOI=10和MOI=100噬菌体处理组其存活率均在80%左右,且存活率均略高于抗生素处理组,显示出噬菌体在水产品中应用的阶段性成效,有望成为抗生素的替代品,但仍需大量实验来提高其可操作性和实用性。
综上,噬菌体在多种致病菌污染的食品中均表现出显著的抑菌效果,特别地,在肉类产业中具有较大的应用潜力。
3 噬菌体在食品中应用的安全性
噬菌体从1919年首次应用于防治人类疾病至今已有较长的安全使用历史,大量临床案例都可证明噬菌体对人类的安全健康无害。噬菌体在临床医学上的成功应用使得其在食品领域也不断取得进展,噬菌体制剂的安全性在国际权威机构中也被广泛认可[12,50]。噬菌体在自然界中 种类极多,而且开发和研制噬菌体制剂不同于传统化学制剂,将其应用于食品工业中仍存在较多的风险与挑战。
在噬菌体筛选环节,筛选出的噬菌体本身是否具有有害组分(毒素、应变源等)、是否具有潜在风险的基因、溶原性噬菌体是否会转移有害基因等[51]问题都需要从基因组学、蛋白组学层面上进行严格把控。同时,噬菌体作为生物抑制剂应用于食品后,在食品中往往会有噬菌体不敏感菌株出现[16],Guenther等[31]在实验中还发现了噬菌体抗性细菌,这些细菌的存在不仅能够使噬菌体的保护作用失效,让食品产业损失巨大的经济效益,而且会对人类健康安全产生重大的危害。因此,怎样制备高效噬菌体混合制剂、如何拓宽噬菌体制剂的宿主谱等都是今后研究需要始终关注的焦点。噬菌体在食品的流通过程中也可能存在一定的安全问题,例如食品会受到如温度波动、挤压碰撞等外界因素的影响,但是噬菌体在受到这些因素影响时能否保持其良好的杀菌效果,需要进一步研究和评估。国内学者在食品领域对噬菌体已做了大量研究[34-35,49],并且取得了阶段性进展,同时国内也在控制食源性致病菌方面出台了与噬菌体相关的国家标准[52]。但我国在食品领域尚无获批的噬菌体制剂,亟需在食品领域建立一套完善的噬菌体应用安全评价体系,这将不仅有利于我国商业噬菌体的快速开发,更对整个食品安全控制体系有重要的意义。
4 结 语
噬菌体作为天然的致病菌抑制剂,并且具有来源广、特异性高以及快速裂解致病菌等优势,在肉类工业中极其有望替代传统抑菌剂。噬菌体对肉类中常见致病菌均有显著的抑制效果,可以适应不同的肉类呈现方式,冷藏或短暂的室温存放都可以保护肉类安全,并且不会受到畜禽种类的影响。为了达到更好的杀菌效果,应致力于筛选出宿主广泛、裂解能力强的噬菌体来组成混合制剂,并且高MOI、均匀地分散方式都是提高噬菌体抑菌效果的关键。
现阶段研究表明,噬菌体的高度特异性虽然可以令其快速有效的杀菌,但同样也造成了不敏感菌株的出现,很容易出现细菌恢复生长的现象[18,30,34]。因此,对噬菌体尾部具有特异性识别功能的基因研究,和如何通过编辑相关基因从而扩大噬菌体宿主范围都将是未来重要的研究方向。此外,肉类等固体食品表面易干燥,不利于噬菌体扩散,细菌恢复增长也可能是噬菌体与食品未充分接触造成,所以如何优化噬菌体与细菌的接触方式也是设计噬菌体制剂应该考虑的问题,否则只能通过施用高滴度的噬菌体来提高抑菌效果[53]。使用噬菌体混合制剂是解决抗性细菌和不敏感菌株出现的有效办法, 但如何设计其配比从而避免噬菌体之间出现的竞争 干扰问题[22]将会是难点。联合应用其他抗菌剂在一定程度上也弥补了噬菌体的不足,但不是所有的复合法都优于噬菌体的单独使用。因此一种合理的复合减菌方式也有待探索。在噬菌体防控食源性致病菌过程中,如微胶囊化、活性包装等许多关联技术的应用,增强了噬菌体应用稳定性,同时提高了噬菌体对致病菌的控制能力。此外,噬菌体作为一种新型杀菌剂在食品中应用的时间较短,因此,亟需建立一套科学完善的噬菌体应用安全评价体系,以保证噬菌体从筛选到应用过程中每个环节的安全性。

