血清sTREM-1联合ESM-1预测脓毒症相关急性肾损伤患者预后的价值
汪晓波 吴建华 倪步烤 章雪娜 刘树理
肾脏是脓毒症病程中常见的受累脏器,约50%的脓毒症患者伴有急性肾损伤(AKI)[1],脓毒症合并AKI患者的28 d死亡率达52.54%[2]。全身炎症反应的级联放大激活是脓毒症的病理生理特征,伴有多种炎症细胞因子的大量释放。可溶性髓样细胞触发受体-1(sTREM-1)是新发现的一类炎症标志物,介导炎症反应的级联放大。血管内皮是脓毒症病程中炎症反应作用的靶组织,炎症作用于内皮细胞造成内皮细胞特异性分子1(ESM-1)表达增多并脱落进入血液循环。已有研究报道,血清sTREM-1及ESM-1可评估脓毒症的诊断和预后[3],但其在脓毒症合并AKI中的变化及意义尚不清楚。本研究旨在观察血清sTREM-1联合ESM-1的变化及其对脓毒症相关AKI患者28 d死亡的预测价值。
1 资料与方法
1.1 临床资料 选择2019年2月至2020年6月本院收治的脓毒症患者120例。(1)纳入标准:①符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[4]中脓毒症的诊断标准;②临床资料完整;③随访资料完整。(2)排除标准:①既往有慢性肾功能不全、恶性肿瘤病史;②合并脓毒症性心肌炎。参照《KDIGO急性肾损伤临床实践指南》[5]中AKI的诊断标准,符合AKI诊断的脓毒症患者64例作为AKI组,其余56例脓毒症患者纳入非AKI组。本研究经医院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 方法 (1)血清sTREM-1及ESM-1检测:患者入院后立即采集外周静脉血3 ml,静置30 min,以3000 r/min离心10 min,分离血清后采用酶联免疫吸附法试剂盒(上海西唐公司)检测sTREM-1及ESM-1的含量,按试剂盒说明书进行操作。(2)临床资料收集:记录患者的性别、年龄、体质量指数(BMI),入科24 h内的白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、肌酐(Cr)、C反应蛋白(CRP)、降钙素原(PCT)等指标水平。
1.3 观察指标 (1)血清sTREM-1及ESM-1含量;(2)性别、年龄、BMI等一般资料与WBC、Hb、PLT、CRP、Cr、PCT等实验室检查指标水平;(3)急性生理和慢性健康评分II(APACHE II):根据入院后24 h内各项指标的最差值计算;(4)患者28 d存活情况。
1.4 统计学方法 采用SPSS 19.0统计软件。计量资料符合正态分布以(±s)表示,采用t检验;符合偏态分布以M(P25,P75)表示,采用非参数秩和检验。计数资料以n(%)表示,采用卡方检验。影响因素采用Logistic回归分析,利用Logistic回归模型产生新的联合预测指标,预测死亡的价值采用ROC曲线分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组血清sTREM-1、ESM-1含量比较 见图1。
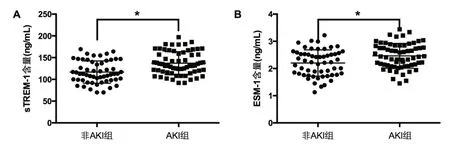
图1 两组患者血清sTREM-1、ESM-1含量比较
2.2 AKI组中存活患者与死亡患者血清sTREM-1、ESM-1含量比较 见图2。

图2 AKI组中存活患者与死亡患者血清sTREM-1、ESM-1含量比较
2.3 AKI组中存活患者与死亡患者的临床资料比较 见表1。
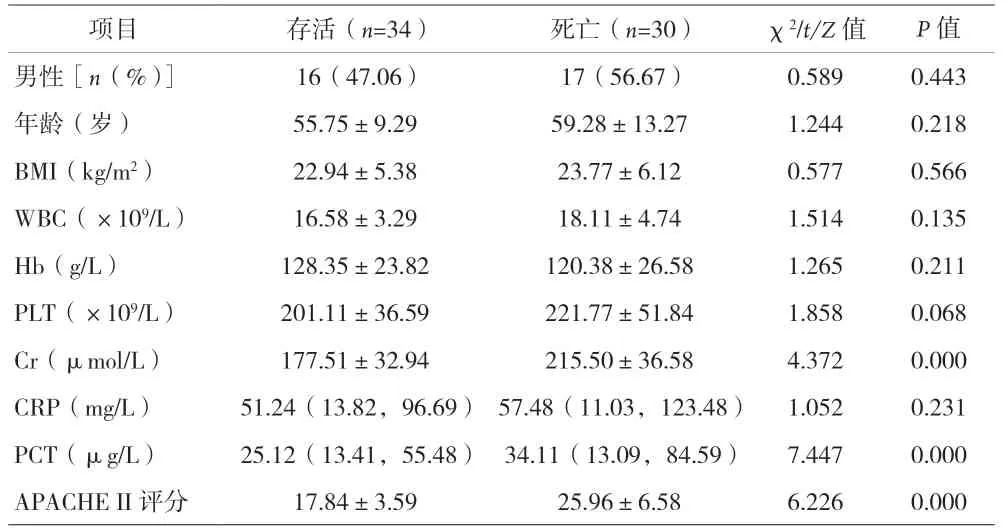
表1 AKI组中存活患者与死亡患者的临床资料比较
2.4 AKI组患者死亡影响因素的多因素Logistics回归分析 以AKI组患者是否死亡作为应变量,以Cr、PCT、APACHE II评分、sTREM-1、ESM-1作为自变量,进行多因素Logistics回归分析,结果显示APACHE II评分、sTREM-1、ESM-1是AKI组患者死亡的影响因素(P<0.05)。见表2。
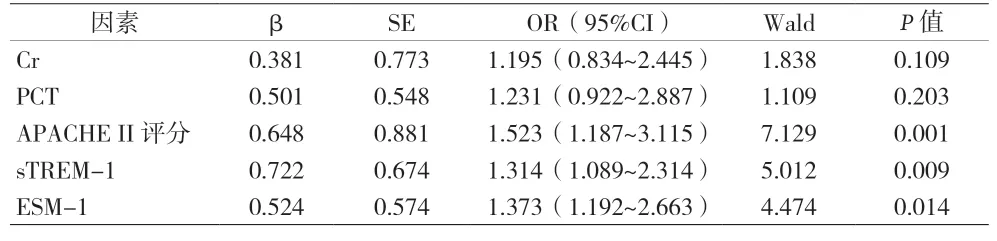
表2 AKI组患者死亡影响因素的多因素Logistics回归分析
2.5 血清sTREM-1及ESM-1预测AKI患者死亡的ROC曲线分析 血清sTREM-1及ESM-1预测AKI患者死亡的ROC曲线下面积分别为0.8172(95%CI:0.7111~0.9232)和0.7721(95%CI:0.6465~0.8977);根据约登指数最大确定最佳截断值分别为135.5和2.36,该截断值预测死亡的灵敏度均为76.67%,特异性分别为79.41%和76.47%。根据Logistics回归模型得到sTREM-1联合ESM-1预测AKI患者死亡的新指标(方程式:-0.7585+0.46×sTREM-1+1.644×ESM-1),其预测AKI患者死亡的ROC曲线下面积为0.8265(95%CI:0.7241~0.9289),根据约登指数最大确定最佳截断值为60.05,该截断值预测死亡的灵敏度为73.33%、特异性为85.29%。见图3-5。
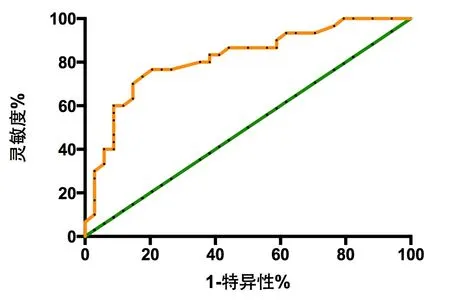
图3 sTREM-1预测AKI患者死亡的ROC曲线
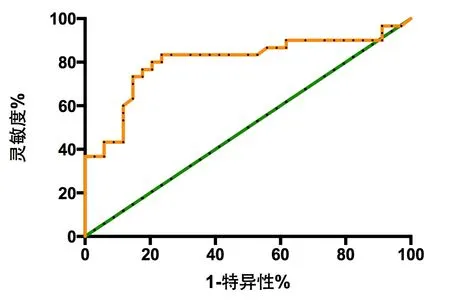
图4 ESM-1预测AKI患者死亡的ROC曲线
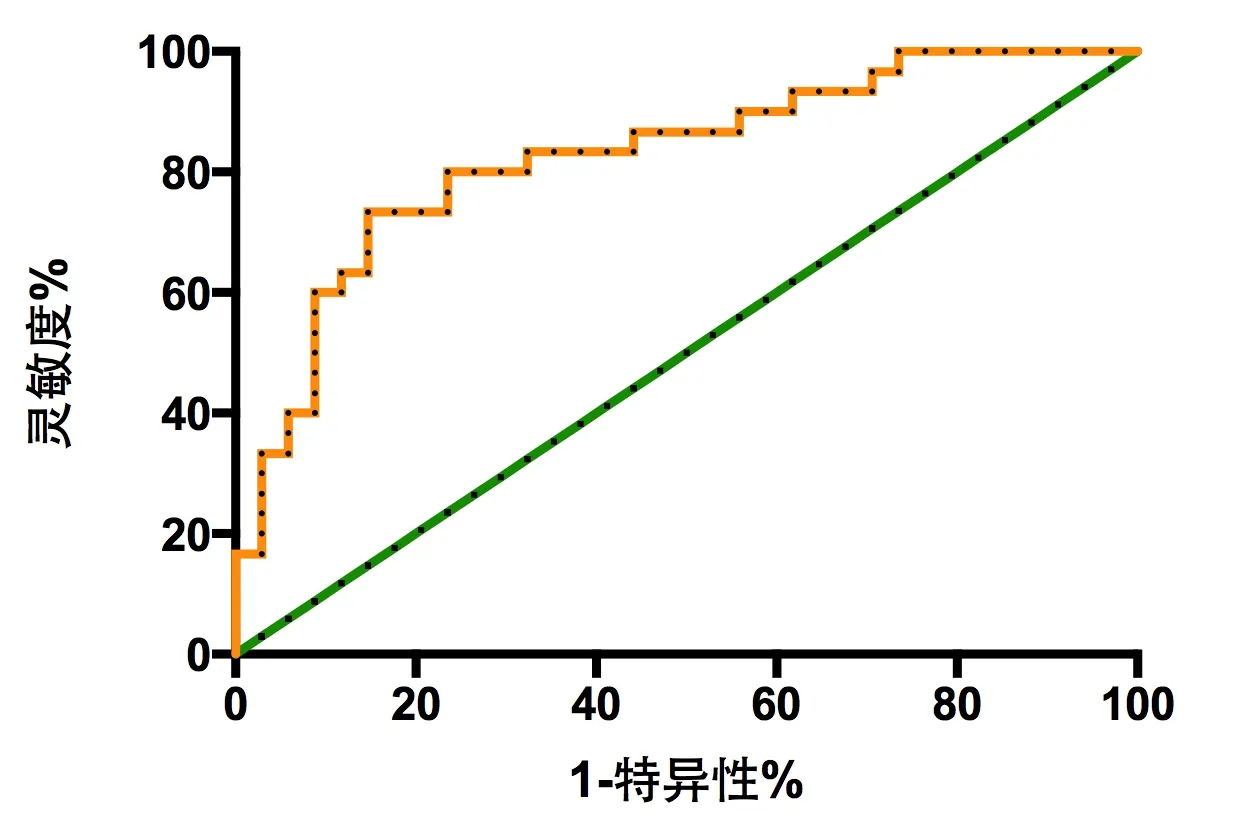
图5 sTREM-1联合ESM-1预测AKI患者死亡的ROC曲线
3 讨论
AKI是脓毒症常见的并发症之一,合并AKI的脓毒症患者病情恶化快、死亡率高,在起病早期准确评估病情、预测疾病转归并及时进行治疗,可防治病情恶化、提高救治成功率、降低疾病死亡率。肾脏具有强大的代偿功能,只有肾小球滤过功能损伤>50%时,传统的肌酐、尿素等肾功能指标才会发生变化,因此传统肾功能指标用于肾功能变化早期评估的价值有限。
随着脓毒症及AKI发病机制研究的不断深入,炎症反应级联放大激活造成血管内皮损伤在脓毒症及AKI发病中的作用受到广泛关注。多项研究报道,炎症标志物sTREM-1和内皮损伤标志物ESM-1对脓毒症合并AKI患者的病情及预后具有评估价值[6]。本资料显示,与未合并AKI的脓毒症患者比较,合并AKI的脓毒症患者的血清sTREM-1和ESM-1含量明显增加,表明sTREM-1和ESM-1的增多可能参与脓毒症合并AKI的发生。脓毒症合并AKI的发病过程中,炎症反应对肾小球内皮细胞的攻击会造成内皮通透性增加、局部微血栓形成、肾小球灌注不足,最终引起肾小球滤过功能损害并发生AKI[7]。sTREM-1是重要炎症介质、介导了炎症反应的级联放大[8]。ESM-1是血管内皮细胞特异性表达的糖蛋白在炎症等病理因素引起内皮损伤的过程中大量释放。血清sTREM-1及ESM-1增多可反映炎症反应的级联放大及血管内皮的损伤,进而可能加重AKI的病情并影响预后。通过观察患者28 d死亡情况,与存活患者比较,死亡患者的血清sTREM-1及ESM-1明显增多,表明sTREM-1和ESM-1的增多不仅与脓毒症相关AKI的发生有关,还与脓毒症相关AKI病情加重和患者的死亡均有关。
近年来,脓毒症相关AKI的预后相关因素成为研究热点。不同学者关于PCT、白蛋白、胱抑素C与脓毒症相关AKI预后关系的研究结论存在差异[9],提示PCT、白蛋白、胱抑素C等指标评估脓毒症相关AKI的预后可能存在较大个体差异,进而会影响其评估价值。研究证实,APACHE II评分是脓毒症相关AKI预后的影响因素[10],但APACHE II评分的评价过程较为复杂,限制了其在疾病早期评估中的应用。本资料结果显示,APACHE II评分、sTREM-1及ESM-1是脓毒症相关AKI患者死亡的影响因素。经ROC曲线进一步证实,sTREM-1及ESM-1对脓毒症相关AKI患者的死亡均具有预测价值。在此基础之上,本研究通过Logistics回归模型生成sTREM-1联合ESM-1预测的新指标,其预测死亡的灵敏度与单一指标相当,特异性优于单一指标。表明,sTREM-1联合ESM-1在脓毒症相关AKI患者死亡的预测中具有一定价值,且联合预测可提高特异性。

