不同解冻方法对冰蛋黄功能特性、理化特性及蛋白质结构的影响
杜清普,赵 英,王瑞红,迟玉杰,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.东北农业大学农学院,黑龙江 哈尔滨 150030)
鸡蛋质优价廉,富含蛋白质、脂质、维生素以及各种微量矿物质元素,是一种营养丰富且均衡的动物性食品,深受世界各国消费者的青睐。蛋黄作为鸡蛋中营养价值更高的部分,因具有良好的功能特性和诸多免疫活性物质而广泛应用于食品、制药和生命科学等领域[1]。
冰蛋黄是以鲜鸡蛋经清洗、去壳后分离出的蛋黄为原料,经过匀浆、过滤、巴氏杀菌等一系列加工工艺,最后冷冻处理而成的蛋制品。冷冻作为食品贮藏保鲜技术之一,不仅可以最大限度地保留蛋黄的营养成分,而且可以有效延长其货架期。然而,Moran[2]研究指出低温冷冻会破坏蛋黄蛋白质的结构并使其变性,进而使蛋黄流动性不可逆地降低,降低程度受冷冻温度、冷冻时间等条件的影响。闫峥蓉等[3]研究表明,相比于鲜蛋黄,冻藏180 d的蛋黄经自然解冻后自由水含量降低,黏性系数、表面疏水性增大。Liu Jingyuan等[4]用冻融后的蛋黄加热制备凝胶时发现,冻融蛋黄的弹性模量、黏性模量及最低成胶温度均高于鲜蛋黄。Harrison等[5]研究发现在90 d冻藏期内,自然解冻后蛋黄的乳化性表现出先下降、后回升、再略微下降的变化规律。
冻融对蛋黄功能特性的影响会使其在食品工业中的加工应用受到限制,合理运用解冻技术是解决此问题的有效途径之一。目前,食品工业中常采用的解冻方法有自然解冻、低温解冻、静水解冻、流水解冻和微波解冻等,多应用于水产品、畜产品的加工与研究[6-8]。然而,关于解冻方法或解冻条件对蛋黄品质的影响却鲜见报道。本研究采用室温自然解冻、静水浴解冻、超声波解冻、微波解冻4 种方法,对比分析了各解冻方法对冰蛋黄乳化特性、凝胶特性等主要功能特性的影响,并探究解冻后蛋黄理化特性和蛋白质结构的变化,旨在选出一种适用于冰蛋黄的解冻方法,从而减少冻融对蛋黄品质的劣变影响,并进一步改善蛋黄的功能特性,同时为冰蛋黄的解冻方法在不同应用需求下的选择提供参考,并为其工业化生产利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
褐壳鸡蛋购于哈尔滨市忠君连锁超市,4 ℃冷藏备用;自采购日起,鸡蛋冷藏时间不超过7 d。
乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、5,5'-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis-(2-nitrobenzoic acid),DTNB)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司;考马斯亮蓝G-250染液、磷酸缓冲盐溶液(phosphate buffered saline,PBS)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等其他试剂均为国产分析纯。
1.2 仪器与设备
DHP-9012型电热恒温箱、HWS-24型电热恒温水浴锅 上海一恒科学仪器有限公司;KQ3200DE型数控超声波清洗器 昆山舒美超声仪器有限公司;NN-GD576M型微波炉 日本松下微波炉有限公司;T18型高速匀浆机 德国IKA公司;TGL-20B型高速台式离心机 上海安亭科学仪器厂;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;TA.XT plus型质构分析仪 英国Stable Micro Systems公司;Mastersizer 2000型激光粒度仪 英国Marlven公司;F-4700型荧光分光光度计 日本Hitachi公司;inVia型激光显微拉曼光谱仪 英国Renishaw公司。
1.3 方法
1.3.1 样品的制备与处理
鲜蛋清洗、去壳后分离出蛋黄,用镊子挑除系带,将其在滤纸上轻轻滚动以清除卵黄膜表面残余的蛋清,然后划破卵黄膜使蛋黄流出。300 r/min搅拌蛋黄10 min后,过滤以除去残留的卵黄膜。将其在恒温箱60.6 ℃下杀菌处理3.5 min后冷却至室温,得到鲜蛋黄。取30 mL鲜蛋黄置于经过相同条件杀菌处理的50 mL离心管中,在-18 ℃下冷冻6 h得到冰蛋黄。参照表1中的实验方法对冰蛋黄进行解冻处理。

表1 冰蛋黄的4 种解冻方法Table 1 Four thawing methods for frozen egg yolk
1.3.2 解冻复温曲线的测定
取出经过冷冻处理的30 mL冰蛋黄,对其进行室温自然解冻、静水浴解冻、超声波解冻时,将热电偶温度计探头插于蛋黄几何中心,实时测定蛋黄中心温度;进行微波解冻时,将光纤测温仪传感光纤插于蛋黄几何中心测定温度。
1.3.3 浊度与蛋白质溶解性的测定
浊度根据Kurisaki等[9]的方法进行测定。用0.15 mol/L NaCl溶液配制0.5 g/100 mL蛋黄溶液,漩涡振荡1 min使其充分溶解。以0.15 mol/L NaCl溶液为对照组,使用紫外分光光度计测定660 nm波长处的吸光度,以此表示为浊度。
蛋白质溶解性参照孙燕婷等[10]的方法测定。取上述0.5 g/100 mL蛋黄溶液,10 000 r/min离心3 min。取200 μL上清液加至4 mL考马斯亮蓝G-250染液,静置20 min。以200 μL 0.15 mol/L NaCl溶液混合4 mL考马斯亮蓝G-250染液为对照组,测定595 nm波长处的吸光度。根据蛋白质标准曲线计算蛋黄溶液的可溶性蛋白质量浓度,单位mg/mL,以可溶性蛋白质量浓度表示蛋白溶解性。
1.3.4 乳化特性的测定
乳化活性指数(emulsifying activity index,EAI)、乳化稳定性指数(emulsifying stability index,ESI)参照Pearce[11]和Jiang Shanshan[12]等的方法测定,并略作调整。用0.15 mol/L NaCl溶液配制0.5 g/100 mL蛋黄溶液,漩涡振荡1 min。取20 mL蛋黄溶液加入5 mL大豆油(水相与油相体积比为4∶1),10 000 r/min均质1 min后立即从底部吸取0.5 mL乳状液移入49.5 mL的0.1 g/100 mL SDS溶液中,漩涡振荡10 s。以0.1 g/100 mL SDS溶液作为对照组,测定500 nm波长处的吸光度A0。根据式(1)计算EAI。
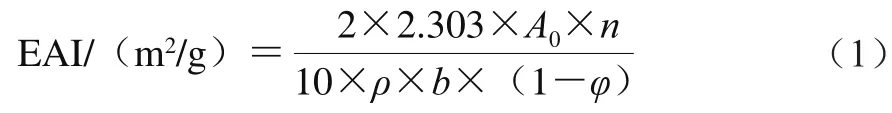
式中:n为乳状液稀释倍数;ρ为蛋黄质量浓度/(mg/mL);b为光程(1 cm);φ为油相体积分数(0.2)。
距初次吸取乳状液5 min后重复上述步骤,测得吸光度A5min。根据式(2)计算ESI。

式中:Δt为间隔时间5 min。
1.3.5 凝胶特性的测定
参考毋引子等[13]的方法进行质构剖面分析(texture profile analysis,TPA),使用质构仪和P/0.5型探头测定蛋黄的凝胶特性。取30 mL蛋黄于50 mL烧杯中,85 ℃水浴加热20 min制备凝胶,室温冷却12 h后测定其凝胶强度和凝胶硬度。测试参数设置为测前速率5 mm/s、测试速率1 mm/s、测后速率5 mm/s、行进距离10 mm、触发力5 g。
1.3.6 质构特性的测定
参考Ramaswamy等[14]的方法,通过反挤压流变学利用质构仪、A-BE型探头测定蛋黄的硬度、稠度、内聚性及黏性。测试参数设置为测前速率5 mm/s、测试速率1 mm/s、测后速率2 mm/s、行进距离15 mm、触发力5 g。
1.3.7 粒径及其分布的测定
取一定量的蛋黄用超纯水稀释10 倍,漩涡振荡至充分溶解。参照Campbell等[15]使用Mastersizer 2000型粒度分析仪测定D4,3、d0.1、d0.5、d0.9及粒径分布曲线。其中,D4,3表示体积平均粒径,d0.1、d0.5、d0.9分别指体积占比累计10%、50%、90%的平均粒径。测试参数设置为颗粒折射率1.460、分散剂折射率1.330、粒径检测范围0.02~2 000 μm。
1.3.8 表面疏水性的测定
表面疏水性参考Shen Xue等[16]的方法,利用ANS作为荧光探针进行测定。用1×PBS(0.01 mol/L,pH 7.2~7.4)配制8 mmol/L ANS溶液和质量浓度依次为0.025、0.05、0.1、0.2、0.4 mg/mL的蛋黄溶液。10 000 r/min离心3 min,取4 mL上清液加入至20 μL ANS溶液并立刻漩涡振荡5 s,然后避光静置反应20 min。使用荧光分光光度计测定荧光强度,测试参数设置为激发波长390 nm、发射波长470 nm、狭缝宽度3.0 nm。以浓度为横坐标、荧光强度为纵坐标绘制拟合曲线,以拟合曲线斜率作为表面疏水性指数(H0),以H0表征表面疏水性。
1.3.9 巯基与二硫键含量的测定
参考Beveridge等[17]的方法,利用Ellman试剂测定蛋黄游离巯基、表面巯基以及二硫键含量。用Tris-Gly缓冲液(含0.086 mol/L Tris、0.1 mol/L Gly及4 mmol/L EDTA,用HCl调pH值至8.0)配制1 g/100 mL蛋黄溶液,漩涡振荡3 min。避光条件下用Tris-Gly缓冲液配制4 mg/mL DTNB溶液,即得Ellman试剂。取0.1 mL Ellman试剂加入至5 mL蛋黄溶液,室温下避光反应20 min后,5 000 r/min离心15 min后取上清液。以0.1 mL Ellman试剂混合5 mL Tris-Gly缓冲液为对照组,测定上清液于412 nm波长处的吸光度A412nm。根据式(3)计算蛋黄游离巯基含量。
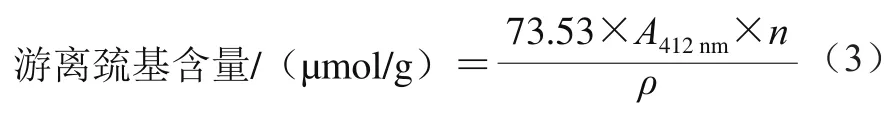
式中:n为蛋黄溶液稀释倍数;ρ为蛋黄质量浓度/(mg/mL)。
Tris-Gly缓冲液加入8 mol/L尿素制得Urea-Tris-Gly缓冲液,再加入10 mmol/Lβ-巯基乙醇制得βME-Urea-Tris-Gly缓冲液,用Urea-Tris-Gly缓冲液和βME-Urea-Tris-Gly缓冲液分别替代Tris-Gly缓冲液重复上述方法分别测定上清液A412nm,并按照公式(3)计算表面巯基含量、总巯基含量。根据式(4)计算二硫键含量。

1.3.10 拉曼光谱的测定与分析
参考Herrero等[18]的方法,将蛋黄均匀涂抹于载玻片上用于拉曼光谱扫描。测试参数为:拉曼频移范围400~2 000 cm-1,激发波长532 nm,发射功率50 mW,峰位误差小于3 cm-1,以苯丙氨酸峰位归属(1 003±1)cm-1作为归一化因子。运用OMINIC软件校准拉曼光谱基线、检测峰位归属,采用PeakFit 4.12软件定量分析蛋白质二级结构的相对含量。
1.4 数据分析与处理
每组数据平行测定3 次,结果以平均值±标准差表示。运用SPSS 25.0软件对实验数据进行统计分析,数据平均值的多重比较采用Duncan法,并进行单因素方差分析(One-Way ANOVA),以P<0.05表示差异显著。采用OriginPro 9.5软件绘图。
2 结果与分析
2.1 各解冻方法下冰蛋黄的复温曲线
冰蛋黄在室温自然解冻、静水浴解冻、超声波解冻及微波解冻方法下复温至25 ℃所需时间依次缩短,分别为213.5、37.5、21.0、0.5 min(图1)。在室温自然解冻、静水浴解冻、超声波解冻的过程中,蛋黄中心温度升至(-0.7±0.1)℃时变化趋势较为平缓,表明此时蛋黄正在进行由固相至液相的相转变。Lopez等[19]的研究也指出蛋黄的凝固点为-0.65 ℃。相比于室温自然解冻,静水浴解冻的复温时间缩短了82.44%。这是因为在同等温度、压力及自然对流等条件下,水的对流换热系数和导热系数均大于空气,故静水浴的热传递作用更强,解冻所需时间较短[20]。超声波解冻的复温时间为静水浴解冻复温时间的56.00%,可能是超声波通过机械效应与空化作用使分子处于机械振动状态,瞬间产生高温、高压条件,继而加速复温过程[21]。4 种解冻方法中,微波解冻的复温速率最快。然而进行微波解冻时,蛋黄内产生局部凝胶化的现象,解冻后有少量凝胶微粒形成。这是因为蛋黄内部部分冰晶先于其他冰晶融化成极性水分子,加剧了微波的吸收。谭明堂等[8]也发现鱿鱼在微波解冻下呈现局部烧焦的现象。

图1 各解冻方法下冰蛋黄的复温曲线Fig.1 Rewarming curves of frozen egg yolk with different thawing methods
2.2 解冻方法对蛋黄浊度与蛋白质溶解性的影响
蛋白质溶解性是反映蛋黄水合性质的重要指标,也是评价其功能特性的基础指标;浊度则能直观反映蛋黄组分的聚集、交联程度。本研究以蛋黄溶液的吸光度表示浊度,以其中可溶性蛋白的质量浓度表示蛋白质溶解性。
如图2所示,室温自然解冻后蛋黄的浊度最高(1.78),且可溶性蛋白的质量浓度最低,仅为0.298 mg/mL。这表明冷冻使低密度脂蛋白(low density lipoprotein,LDL)及其他可溶性蛋白结构遭到破坏,疏水基团暴露并发生疏水相互作用从而形成聚集体,宏观表现为水溶性的降低[22]。同时,这也表明蛋白质溶解性与浊度呈一定的负相关性。静水浴解冻下蛋黄的可溶性蛋白质量浓度仅高于室温自然解冻蛋黄,且与鲜蛋黄无显著性差异(P>0.05),说明加快复温速率可以起到减缓冷冻致使LDL变性聚集的作用。蛋黄经过超声波解冻和微波解冻后的可溶性蛋白质量浓度无显著性差异(P>0.05),相对于鲜蛋黄分别提高10.73%、14.39%。这表明在微波的影响下,蛋白质聚集体因次级键遭到破坏而分散,其内部的极性基团得以暴露,从而使溶解性增强;超声波则通过机械作用产生空穴效应,使聚集体结构逐渐疏松,更多的极性基团接触到水相,疏水性多肽朝向脂质部分,最终使其溶解性增强[23]。张春红等[24]的研究也表明短期微波处理可以增强大豆分离蛋白质溶解性,溶解性随处理时间延长而上升。
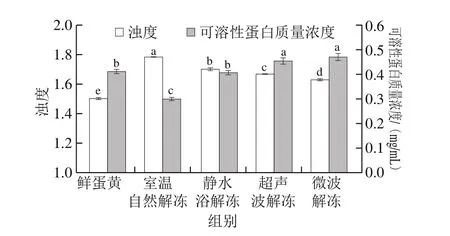
图2 解冻方法对蛋黄浊度与蛋白质溶解性的影响Fig.2 Effects of thawing methods on turbidity and protein solubility of egg yolk
2.3 解冻方法对蛋黄乳化特性的影响
EAI和ESI是评价蛋黄乳化性的两个重要参数。EAI反映乳化剂在油、水两相中自由扩散并吸附于两相界面处使两相间接“相溶”的能力;ESI则反映乳化剂易于在油-水界面附着,维持乳状液体系稳定的能力[23]。
由图3可知,蛋黄的乳化活性与蛋白质溶解性的变化趋势基本相同,表明EAI与可溶性蛋白质量浓度具有一定的正相关性。相比于鲜蛋黄,蛋黄在室温下自然解冻后EAI降低10.65%、ESI降低6.98%,且均显著低于其他解冻方法(P<0.05)。静水浴解冻后蛋黄的EAI与鲜蛋黄的差异不显著(P>0.05),但ESI显著高于鲜蛋黄(P<0.05)。超声波解冻和微波解冻下蛋黄的EAI分别为8.54、8.61 m2/g,虽然两者均较高且无显著性差异(P>0.05),但超声波解冻后蛋黄的ESI显著高于微波解冻(P<0.05)。这可能是因为超声波处理使油-水界面处蛋白质与油相的疏水相互作用力增强,亲水基团进入水相使两相界面的界面张力减小,导致被包埋的油滴难以聚集;也可能是蛋黄经过微波解冻后粒径分布不均,乳状液体系自身紊乱所致[25]。李杨等[26]的研究也发现利用超声处理可以有效改善大豆分离蛋白的乳化活性和乳化稳定性。

图3 解冻方法对蛋黄乳化活性与乳化稳定性的影响Fig.3 Effects of thawing methods on emulsifying activity and emulsion stability of egg yolk
2.4 解冻方法对蛋黄凝胶特性的影响
凝胶特性是反映蛋白质变性、交联的宏观特征之一。凝胶的形成既依赖于蛋白质分子之间的共价键相互作用,也与蛋白质和水的偶极-偶极相互作用有关。凝胶强度的差异性取决于蛋白质分子质量分布、氨基酸组成以及肽链长度的差异性[27]。
如图4所示,蛋黄经过冷冻并在室温下自然解冻后,所制备热凝胶的凝胶强度下降11.75%。静水浴解冻、超声波解冻后蛋黄的凝胶强度和凝胶硬度都处于较低水平,且差异均不显著(P>0.05)。微波解冻下蛋黄的凝胶强度介于鲜蛋黄和室温自然解冻之间,但其凝胶硬度超出鲜蛋黄9.41%并显著高于其他解冻方法(P<0.05)。这说明在微波辐照的影响下,蛋黄蛋白质构象发生改变使疏水基团暴露,并通过共价作用和疏水相互作用形成胶束,最终形成三维凝胶网络[28]。这也与微波解冻导致蛋黄局部产生凝胶微粒的现象相吻合。闫虹等[28]的研究也指出微波处理可使白鲢鱼糜的凝胶特性得到有效提高。
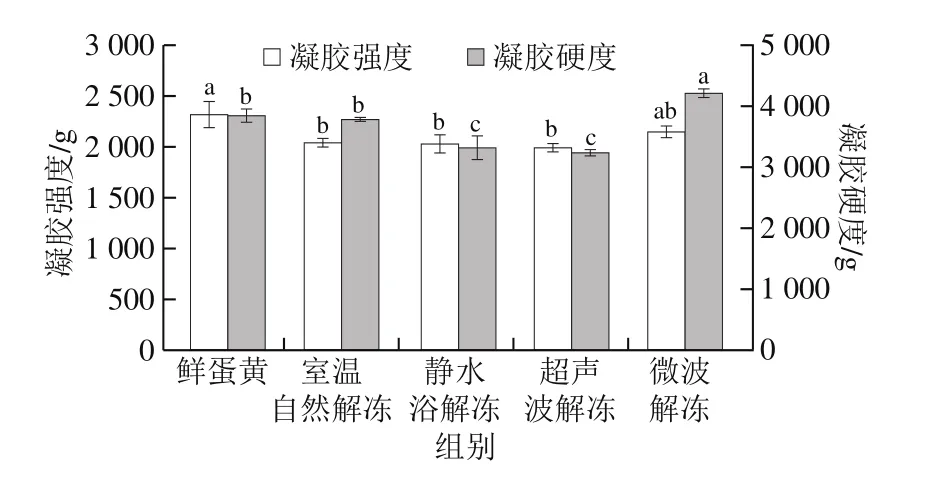
图4 解冻方法对蛋黄凝胶强度与凝胶硬度的影响Fig.4 Effects of thawing methods on gel strength and hardness of egg yolk
2.5 解冻方法对蛋黄质构特性的影响
冻融后的蛋黄形态为半固态,在纵向剪切力的作用下,其横截面产生屈服应力并宏观表现出一定的黏性、弹性等质构特性。反挤压流变学已用于多项触变性流体、半固体等样品的研究[14,29]。依据反挤压流变学对蛋黄质构特性进行测定,结果可以直观地反映出蛋黄蛋白质的变性程度。
从表2可以看出,室温自然解冻对蛋黄流动性的影响最大,该方法解冻后蛋黄的硬度、稠度、内聚性及黏性均显著高于鲜蛋黄和其他解冻方法(P<0.05)。其次是静水浴解冻,该方法下蛋黄的黏性是鲜蛋黄的4.66 倍。超声波解冻后蛋黄的硬度、稠度、黏性与内聚性均高于鲜蛋黄,但差异均不显著(P>0.05)。相比于鲜蛋黄,微波解冻使蛋黄的硬度、内聚性显著增大(P<0.05),分别提高1.59、2.36 倍。相对于其他3 种解冻方法,室温自然解冻下蛋黄的质构特性变化较大,究其原因,可能是静水浴解冻、超声波解冻及微波解冻均使冰蛋黄中蛋白质分子的运动加剧,创造出有利于因冻融而形成的共价键断裂的条件,同时蛋白质分子难以稳定接触并发生相互作用,最终使蛋黄流动性增强[30]。

表2 解冻方法对蛋黄质构特性的影响Table 2 Effects of thawing methods on textural properties of egg yolk
2.6 解冻方法对蛋黄粒径及其分布的影响
2.6.1 解冻方法对蛋黄粒径的影响
各解冻方法下蛋黄的平均粒径如表3所示。其中D4,3显示出蛋黄在室温下自然解冻后的粒径整体较大,而采用其他方法进行解冻可以对D4,3增加起到不同程度的抑制效果。鲜蛋黄的d0.1、d0.5、d0.9分别为4.56、25.44、47.12 μm,通过比较鲜蛋黄和经室温自然解冻处理的蛋黄粒径可以发现,冻融处理使d0.1减小69.96%、d0.5减小46.50%,而d0.9增大3.77 倍,表明冻融过程中所形成的大粒径颗粒是由小粒径颗粒聚集而成,进一步印证了室温自然解冻下蛋黄浊度较大的研究结果。Au等[31]也报道了冷冻处理会使蛋黄“颗粒”组分的粒径增大、凝胶性增强,并且这是由脂蛋白或载脂蛋白在低温环境中发生交联聚集所致。相比于室温自然解冻,微波解冻后蛋黄的平均粒径较小,其D4,3为10.76 μm。张海华等[32]利用微波处理小麦面筋蛋白时也得到了平均粒径减小的结果。微波解冻下蛋黄的d0.1、d0.5均显著小于超声波解冻(P<0.05),但其d0.9达到28.54 μm,为后者的1.94 倍,表明微波解冻下蛋黄中有凝胶微粒初步形成。

表3 解冻方法对蛋黄粒径的影响Table 3 Effects of thawing methods on particle size of egg yolk
2.6.2 解冻方法对蛋黄粒径分布的影响
图5反映了蛋黄经不同解冻方法处理后粒径分布的情况。室温自然解冻后蛋黄的粒径分布较为分散,且在100~1 000 μm范围内检测出大量颗粒。Relkin等[33]指出乳状液的平均粒径越小,粒径分布越均匀,其乳化性越好,这解释了室温自然解冻下蛋黄乳化性较差的原因。与室温自然解冻相比,静水浴解冻后蛋黄的粒径分布趋于集中,说明用静水浴解冻后的蛋黄制备出的乳状液更加稳定。超声波解冻后蛋黄的粒径分布较为均匀,几乎呈单峰且近似于正态分布,因此在该解冻方法下蛋黄制备出的乳状液体系稳定性最好[34]。微波解冻后蛋黄的D4,3与超声波解冻的差异不显著(P>0.05),但微波解冻下蛋黄的粒径分布呈现双峰,印证了微波解冻下蛋黄的乳化活性与超声波解冻无显著性差异(P>0.05),乳化稳定性却显著低于超声波解冻(P<0.05)的结果。

图5 解冻方法对蛋黄粒径分布的影响Fig.5 Effects of thawing methods on particle size distribution of egg yolk
2.7 解冻方法对蛋黄表面疏水性的影响
表面疏水性指数能够反映蛋白质表面所暴露疏水性氨基酸残基的相对含量,其越大表示蛋白质构象展开程度越大[35]。由图6可知,鲜蛋黄H0为3 873.30,而蛋黄经过冷冻并在室温下自然解冻后增至4 835.30。这是由蛋黄经过冷冻处理后蛋白质构象发生改变,使包埋在内部的疏水性氨基酸残基暴露所致。彭欢欢等[36]在研究冻藏期间河蟹肌原纤维蛋白生化特性的变化时,发现肌原纤维蛋白的表面疏水性随冷冻时间延长而上升。静水浴解冻后蛋黄的H0最高(5 079.63)(P<0.05),相比于鲜蛋黄增大31.14%。这进一步表明冰蛋黄在室温下自然解冻时,脂蛋白构象发生改变,导致其脂质部分伸出蛋白质表面,形成疏水环境,因蛋白质变性而暴露的疏水基团之间发生疏水相互作用,使得表面疏水性有所降低;而静水浴解冻削弱了蛋白质表面疏水基团的相互作用[3,37],因此该解冻方法下蛋白质的表面疏水性较强。超声波解冻和微波解冻后蛋黄的H0均显著低于其他解冻方法(P<0.05),且两者无显著性差异(P>0.05),印证了这两种解冻方法下蛋白质溶解性较高的研究结果。梁雯雯等[38]的研究也指出微波解冻下鲢鱼肌球蛋白的表面疏水性低于静水解冻。
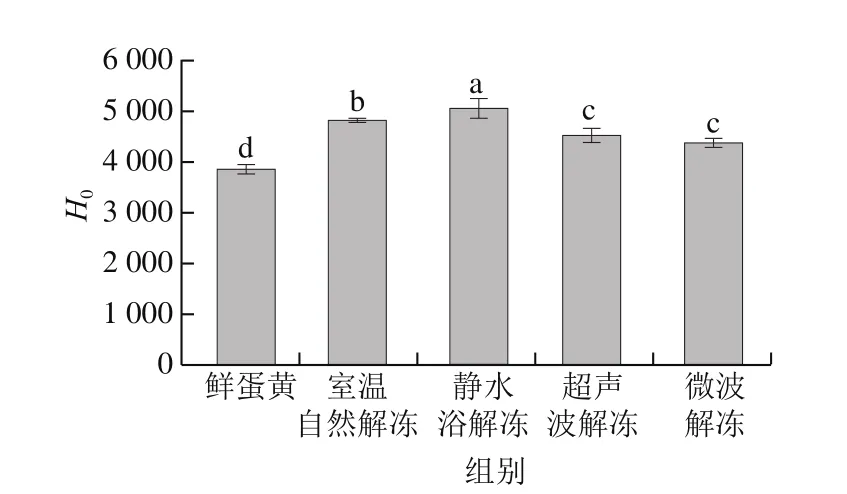
图6 解冻方法对蛋黄表面疏水性的影响Fig.6 Effects of thawing methods on surface hydrophobicity of egg yolk
2.8 解冻方法对蛋黄巯基与二硫键含量的影响
作为半胱氨酸的活性残基,巯基易于氧化形成二硫键,对蛋白质构象的形成与改变发挥着至关重要的作用[39]。各解冻方法对蛋黄游离巯基、表面巯基及二硫键含量的影响如图7所示。室温自然解冻下蛋黄的游离巯基含量最低,仅为3.07 μmol/g,相比于鲜蛋黄减少了36.96%,而二硫键含量最高(11.71 μmol/g),相比于鲜蛋黄增加了17.33%。这表明在冻融处理的影响下,蛋黄蛋白质分子之间的巯基氧化结合形成二硫键。Chen Zhenjia等[40]研究指出巯基含量的减少也可能是其发生氧化重排形成其他氧化产物所致。超声波解冻后蛋黄游离巯基、表面巯基的含量与微波解冻近似,但超声波解冻下蛋黄的二硫键含量显著低于微波解冻(P<0.05),表明超声波作用可使蛋黄总巯基含量减少。李弓中等[41]的研究表明蛋清液的总巯基含量随超声时间延长呈下降的趋势。通过对比各解冻方法下蛋黄的表面巯基含量与可溶性蛋白质量浓度的结果可以发现两者呈现出一定的正相关性,说明巯基与水分子之间的氢键作用也是影响蛋白质溶解性的因素之一。
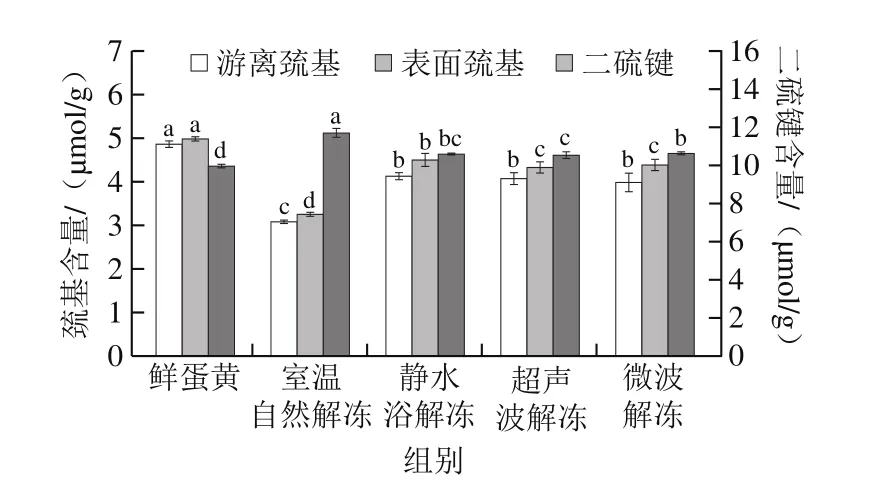
图7 解冻方法对蛋黄巯基与二硫键含量的影响Fig.7 Effects of thawing methods on contents of sulfhydryl groups and disulfide bonds in egg yolk
2.9 各解冻方法下蛋黄的拉曼光谱及蛋白质二级结构相对含量
2.9.1 各解冻方法下蛋黄的拉曼光谱
拉曼激光经过分子产生非弹性散射时,其波长、频率会发生改变,散射光与激发光的光频差称为拉曼频移。拉曼频移取决于分子振动或转动能级的变化,因此拉曼光谱可用于分子结构的纯定性或高度定量分析。在拉曼光谱中,有酰胺III带(波数1 230~1 350 cm-1)、酰胺I带(波数1 600~1 700 cm-1)以及所包含的肽键C=O伸缩振动带、N—H弯曲振动带(波数1 665 cm-1)等以拉曼光强的形式反映出的蛋白质二级结构信息,也有诸如色氨酸吲哚环(波数759 cm-1)、酪氨酸残基(波数830 cm-1和850 cm-1)等所处微环境变化的反馈信息[34]。依据谱峰的峰位归属,可以对经过不同方法解冻的蛋黄蛋白质构象变化情况进行分析,从而深入了解各解冻方法影响蛋黄功能特性的作用机制。
由图8可知,各方法解冻后的蛋黄均在波数1 004 cm-1附近呈现高强度谱峰(归属于苯丙氨酸苯环伸缩振动),该谱峰因受外界环境影响较小而常被用作归一化因子。冰蛋黄于室温下自然解冻后脂蛋白烷基链C=C伸缩振动(波数1 522 cm-1附近谱峰)强度与鲜蛋黄相比有所减弱,这可能是因为蛋白质C=C与水分子—OH基共价结合使其含量减少所致[42]。超声波解冻、微波解冻后的蛋黄均在波数1 157 cm-1和1 443 cm-1附近呈现拉曼光谱峰强度高于鲜蛋黄的谱峰(归属于脂肪族氨基酸非对称C—H弯曲振动),而室温自然解冻和静水浴解冻下该谱峰强度均略低于鲜蛋黄,表明低温冷冻使蛋白质发生变性聚集的同时,脂肪族疏水性基团被包埋于蛋白质分子内部,继而导致C—H振动强度减弱,拉曼频移减小,并且该过程受静水浴快速复温的影响而有所缓和;微波、超声波则是利用机械效应使分子运动加剧,对聚集体结构分别进行不同程度的破坏,将处于包埋状态以及原有的疏水性基团暴露至极性微环境下[34],最终使谱峰强度恢复并高于鲜蛋黄。该研究结果与各解冻方法对蛋黄蛋白质溶解性、乳化性影响的研究结果表现出高度一致性。
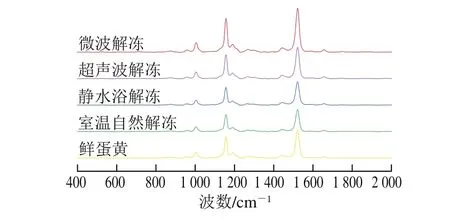
图8 各解冻方法下蛋黄的拉曼光谱Fig.8 Raman spectra of frozen egg yolk thawed by different thawing methods
2.9.2 解冻方法对蛋黄蛋白质二级结构相对含量的影响
蛋白质分子中肽键之间的氢键、分子间的范德华力等次级键是使其二级结构保持稳定的主要作用力。低温、超声波及微波作用会使次级键发生断裂,导致蛋黄蛋白质原有二级结构被破坏,进而重排形成新的蛋白质分子构象。有研究指出,在拉曼光谱酰胺I带中:波数1 626~1 638 cm-1拉曼谱带归属于β-折叠;波数1 640~1 648 cm-1拉曼谱带归属于无规卷曲;波数1 648~1 657 cm-1拉曼谱带归属于α-螺旋;波数1 673~1 686 cm-1拉曼谱带归属于β-转角[43-44]。通过对酰胺I带内不同谱带的拉曼曲线峰面积进行积分,可计算出蛋白质4 种二级结构的相对含量。
如表4所示,α-螺旋是蛋黄蛋白质中含量最高的二级结构,在鲜蛋黄中相对含量为34.80%。对比微波解冻后的蛋黄和鲜蛋黄可知,微波解冻使蛋黄α-螺旋相对含量显著减少(P<0.05),并向其他结构转化。郝天舒等[45]在研究微波处理对米糠蛋白二级结构影响时得到了相同的结果。Blume等[46]也指出α-螺旋含量的减少有利于凝胶三维网络的形成,这解释了微波解冻下蛋黄凝胶硬度较大这一现象。蛋黄经冷冻并在室温下自然解冻后,氢键含量较多、结构规则有序的β-折叠结构相对含量显著增多(P<0.05),解释了蛋黄经过冻融后流动性较低,内聚性、黏性等质构特性较高的现象。冰蛋黄经超声波解冻处理后,β-折叠相对含量由19.27%降低至16.08%,无规卷曲相对含量由17.02%增加至20.59%,这与李弓中等[41]研究发现蛋清蛋白质β-折叠、无规卷曲含量随超声作用时间延长而分别减少、增多的研究结果类似。从β-转角的结果来看,室温自然解冻、静水浴解冻均使其相对含量降低,而超声波解冻、微波解冻均使其相对含量上升,与蛋黄蛋白质溶解性呈现出一致的规律。这可能是因为β-转角结构多含有带电荷的极性氨基酸残基,且该结构常出现于球状蛋白表面,有利于使蛋白质结构更加松散,故β-转角含量越高,蛋白质溶解性越强[47]。
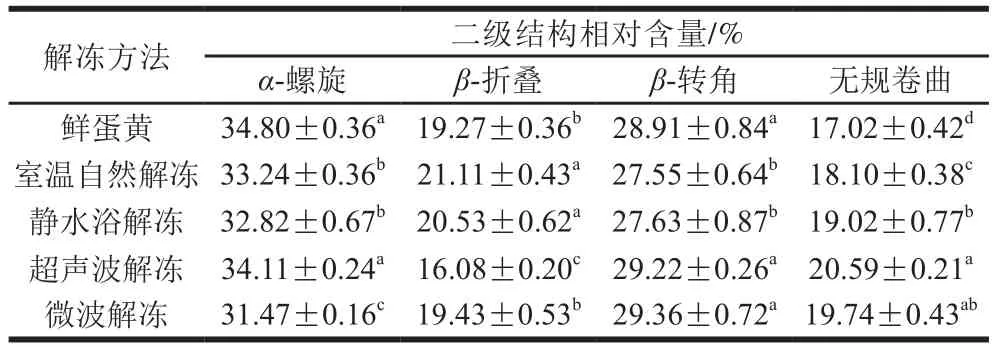
表4 解冻方法对蛋黄蛋白质二级结构相对含量的影响Table 4 Effects of thawing methods on protein secondary structures in egg yolk
3 结 论
本研究结果表明不同解冻方法对冰蛋黄的蛋白质溶解性、乳化特性、凝胶特性及表面疏水性等功能、理化特性有不同程度的影响,并证明超声波解冻是较适用于冰蛋黄的解冻方法。
室温自然解冻下冰蛋黄的复温时间最长,为213.5 min。该方法解冻后蛋黄的浊度最高(1.78),二硫键含量最高(11.71 μmol/g),且蛋白质二级结构中β-折叠相对含量最高,表明该解冻方法下蛋白质的交联聚集程度最高。静水浴解冻后蛋黄的乳化活性、乳化稳定性均显著低于超声波解冻(P<0.05),并且该解冻方法下蛋黄的表面疏水性最强,相比于鲜蛋黄增大31.14%。冰蛋黄经超声波解冻后D4,3最小(8.69 μm),且粒径分布最为集中。该解冻方法下蛋黄的硬度、内聚性、黏性等质构特性均较低且与鲜蛋黄无显著性差异(P>0.05)。而且与鲜蛋黄相比,超声波解冻后蛋黄的蛋白质溶解性、乳化活性、乳化稳定性均有所改善。微波解冻下冰蛋黄的复温时间最短,仅为0.5 min。但该解冻方法下蛋黄的二硫键含量显著高于超声波解冻(P<0.05),且粒径分布较为分散,蛋白质α-螺旋结构相对含量最低,解冻后蛋黄中有凝胶微粒形成。

