基于肾脏尿酸转运的中药降尿酸活性成分筛选及评价
邹丽娜 王雨 姜卓希 巨珊珊 张冰 林志健 杨婷
摘要 目的:基于腎脏尿酸转运环节,筛选及评价中药降尿酸活性成分,为阐释中药降尿酸物质基础提供理论和技术支撑。方法:以不同灌注压力进行大鼠离体肾脏灌流,通过肾小球滤过率、尿流率、葡萄糖重吸收率、钠离子重吸收率、钾离子重吸收率等评价肾功能,建立离体肾脏模型;设置尿酸组、菊苣酸组和丙磺舒组进行离体肾脏灌流,观察肾脏尿酸排泄情况,以菊苣酸示例应用离体肾脏灌流模型;设置对照组、尿酸组、苯溴马隆组、丙磺舒组及菊苣酸组,通过蛋白免疫印迹法检测高尿酸状态下HKC细胞GLUT9蛋白表达变化,及高尿酸状态下菊苣酸干预后的表达变化,结合离体肾脏灌流技术评价降尿酸活性成分。结果:在120 mm Hg(1 mm Hg=0.133 kPa)灌注压力下离体肾功能良好;菊苣酸在20~40 min、40~60 min均能提高肾脏清除率,增加肾脏尿酸排泄分数;且菊苣酸能够显著抑制高尿酸状态下HKC细胞的GLUT9蛋白表达。结论:该研究基于肾脏尿酸转运环节,应用离体肾脏灌流技术结合体外HKC细胞筛选并评价中药降尿酸活性成分,筛选出菊苣酸可能是菊苣通过促进尿酸排泄发挥降尿酸作用的活性成分,为抗高尿酸血症药物的研发奠定实验基础,为中药的开发和临床应用提供实验依据,以更好服务于临床。
关键词 降尿酸;活性成分;离体肾脏灌流;HKC;筛选及评价
Screening and Evaluation of Active Ingredients of Traditional Chinese Medicine For Lowering Uric Acid Based on Renal Uric Acid Transport:a Case Study of Cichoric Acid
ZOU Lina,WANG Yu,JIANG Zhuoxi,JU Shanshan,ZHANG Bing,LIN Zhijian,YANG Ting
(School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 102488,China)
Abstract Objective:Based on the kidney uric acid transport link,to screen and evaluate the active ingredients of traditional Chinese medicine for lowering uric acid,providing theoretical and technical support for the interpretation of the material basis of traditional Chinese medicine(TCM)for lowering uric acid.Methods:The isolated rat kidneys was perfused with different perfusion pressures.The renal function was evaluated by glomerular filtration rate,urine flow rate,glucose reabsorption rate,sodium ion reabsorption rate,potassium ion reabsorption rate,etc.,and the isolated kidney model was established.The uric acid group,the cichoric acid group and the probenecid group for isolated kidney perfusion were set,the renal uric acid excretion was observed.Western blotting was used to detect the changes in the expression of GLUT9 protein in HKC cells under high uric acid conditions and the changes in the expression of cichoric acid intervention under high uric acid conditions,and to evaluate the uric acid-lowering active ingredients combined with isolated kidney perfusion technology.Results:The isolated kidney function was good under 120 mm Hg perfusion pressure; cichoric acid can improve renal clearance and increase renal uric acid excretion at 20-40 min and 40-60 min; cichoric acid can increase renal uric acid excretion fraction; and cichoric acid can significantly inhibit the expression of GLUT9 protein in the state of high uric acid.Conclusion:The study is based on the transport of uric acid in the kidney.By applying isolated kidney perfusion technology combined with in vitro HKC cells,the active ingredients of TCM for lowering uric acid are screened and evaluated.Cichoric acid screened out may be the active ingredient of chicory to lower uric acid by promoting uric acid excretion,laying an experimental foundation for the research and development of anti-hyperuricemia drugs,and providing experimental evidence for the development and clinical application of traditional Chinese medicine to better serve clinical practices.
Keywords Lowering uric acid; Active ingredient; Isolated kidney perfusion; HKC; Screening and evaluation
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.01.005
临床研究结果显示,90%左右的原发性高尿酸血症属于尿酸排泄不良型[1]。尿酸是机体内嘌呤代谢的产物,其中2/3以尿液的形式经肾脏排出体外,1/3以粪便的形式经肠道排泄。肾脏作为对尿酸排泄贡献较大的器官,受到人们的广泛研究,目前,研究药物降尿酸的作用机制多以肾脏作为靶器官。
离体肾脏灌流(Isolated Perfused Kidney,IPK)技术是将动物肾脏从活体中分离出来,通过体外灌注灌流液,在不受体液、激素或神经系统的情况下,特异性地对肾脏的生理活性和生化功能进行研究的一种方法。多年来,该技术已被用于阐明药物对肾脏的影响[2-5]、肾毒性[6]及药物作用特点及机制[8-11]等方面。
我国使用中药治疗高尿酸血症历史悠久,中药治疗高尿酸血症具有独特的临床优势,但中药治疗高尿酸血症的活性成分有待明确,如何从中药或中药复方中筛选降尿酸活性成分?目前,降尿酸活性成分筛选多以XOD为靶点,肾脏作为对尿酸排泄贡献最大的器官,以肾脏为靶器官的降尿酸活性成分筛选模式尚没有建立,故该研究将依据高尿酸血症发病机制,应用离体灌流技术结合HKC细胞初步筛选和评价中药降尿酸活性成分,为阐释中药降尿酸物质基础提供理论和技术支撑。
1 材料与方法
1.1 材料
1.1.1 动物与细胞
SPF级SD大鼠,雄性,体质量(450±10)g,购于斯贝福(北京)实验动物科技有限公司。标准条件:室温(23±1)℃,湿度(45±5)%,12 h光照/12 h黑暗节律饲养。动物伦理号:BUCM-4-2019090301-3032。
HKC细胞株购于国家实验细胞资源共享平台,实验用20-30代。培养基组成:含10%胎牛血清,1%青霉素-链霉素工作液的DMEM/F12培养基。培养条件:在37 ℃,5%CO2,95%湿度条件下培养于25 cm2细胞培养瓶。
1.1.2 药物
菊苣酸(大连美仑生物技术有限公司,批号:N0517AS);丙磺舒(源叶生物,批号:R09O8X45213);苯溴马隆(源叶生物,批号:S20O6X4571)
1.1.3 试剂与仪器
试剂:Krebs-Henseleleit Buffer Modified(Sigma公司,美国,批号:SLCC3728);菊粉(Bioruler,批号:r6001);尿酸(Sigma公司,美国,批号:BCBR0860V)牛血清白蛋白V(北京百瑞极生物科技有限公司,批号:20201008);肝素钠(北京百瑞极生物科技有限公司,批号:20200601);甘露醇(索莱宝有限公司,批号:717X036);生理盐水(石家庄四药有限公司,批号:2008012003);蒽酮(Solarbio,批号:107R021);葡萄糖试剂盒(南京建成生物工程研究所,批号:A154-1-1);钠离子试剂盒(南京建成生物工程研究所,批号:C002-1-1);钾离子试剂盒(南京建成生物工程研究所,批号:C001-2-1);尿酸试剂盒(中生北控生物科技股份有限公司,批號:190691);甘氨酸(北京百瑞极生物科技有限公司,批号:20200721);Tris(北京拜尔迪生物技术有限公司,批号:20C1956715);SDS(Bioruler,批号:r471903);甲醇(天津市大茂化学试剂厂,批号:20200801);超敏ECL化学发光试剂盒(Millipore,美国,批号:1925901);1M Tris-HCl缓冲液(索莱宝有限公司,批号:20200908);1.5M Tris-HCl缓冲液(索莱宝有限公司,批号:20200925);20×TBST(索莱宝有限公司,批号:20200910);GAPDH Mouse Monoclonal antibody(Proteintech,美国,批号:60004-1-lg);SLC2A9(Proteintech,美国,批号:26486-1-AP);HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)(Proteintech,美国,批号:SA00001-1);HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(Proteintech,美国,批号:SA00001-2);青霉素-链霉素双抗溶液(Corning公司,美国,批号:30002341);0.25%胰蛋白酶-EDTA溶液(Gibco公司,美国,批号:2186976);PBS(Corning公司,美国,批号:05720003);CCK-8试剂盒(北京百瑞极生物科技有限公司,批号:DCM7126);DMSO(国药集团化学试剂有限公司,批号:20200405)
仪器:蠕动泵(兰格恒流泵有限公司,型号:DG-4-A型);恒温水浴箱(江苏省金坛市荣华仪器制造有限公司,型号:LKTC-B1-T型);Sunrise酶标仪(瑞士Teacan公司,瑞士,型号:SUNRISE型);低温高速离心机(德国Sigma公司,德国,型号:3K15型);全自动凝胶成像分析系统(北京赛智创业科技有限公司,型号:MiniChemi500型);CO2细胞培养箱(Thermo公司,美国,型号:3111型)
1.2 方法
1.2.1 分组与模型制备
离体肾脏灌流模型制备:选择Krebs-Henseleit液为基础液,其组成(mmol/L)为:NaCl 118.0、KCl 4.7、CaCl21.28、MgSO4 2.34、KH2PO4 1.2、NaHCO3 25、葡萄糖5.55 g。另外加入0.2%牛血清白蛋白V和0.153%复方氨基酸注射液(18AA,临用前加入),充分溶解。加入0.2 g/L菊粉,用以测定肾小球滤过率。用0.45 μm孔径滤膜过滤,调pH至7.2~7.4之间,置于37 ℃恒温浴槽内。选择(450±10)g体质量范围的SD大鼠,腹腔注射水合氯醛(10%)麻醉,麻醉诱导后,在膀胱上方作中线切口,延伸至胸骨。确定主要的解剖点:包括右肾、右输尿管、肠系膜上动脉和肾动脉。先后分离出右侧输尿管,暴露主动脉肾段,分离肠系膜上动脉,最后分离肾动脉、肾静脉。右下肢静脉注射肝素(500 U/kg)使全身肝素化。10 min后,肾动脉插管后结扎固定,立即泵入37 ℃预温的灌流液,紧接着肾静脉插管后结扎固定,肾脏、动脉插入管、静脉插入管和灌流泵仪器形成一个循环系统。借输尿管充盈插管及结扎固定,管的另一末端收集尿液。最后,整个左侧肾脏、左肾动脉、左肾静脉及左侧输尿管从腹腔内一同摘离,修剪掉肾脏周围组织,并用预温至37 ℃的生理盐水冲洗腹腔流体放入盛有37 ℃灌流液的恒温浴槽内,继续灌流。
分组:分别以80、100、120 mm Hg(1 mm Hg=0.133 kPa)压力对离体肾脏进行灌注,灌流液冲洗肾脏10 min,平衡10 min后隔20 min收集1次尿液,每次尿液采集间隔的中点采集灌流液样本,灌注实验完成后,应将腎脏吸干、称重。
1.2.2 给药方法
菊苣酸对离体肾脏尿酸排泄的影响:制备离体肾脏灌流模型,设置尿酸组(300 μmol/L)、丙磺舒组(1 mmol/L)、菊苣酸组(3 mmol/L),灌流液冲洗肾脏10 min,平衡10 min后隔20 min收集1次尿液,每次尿液采集间隔的中点采集灌流液样本,灌注实验完成后,应将肾脏吸干、称重。
菊苣酸对HKC细胞GLUT9表达影响:设置对照组(0.1%DMSO)、尿酸组(400 μmol/L)、苯溴马隆组(50 μmol/L)、丙磺舒组(50 μmol/L)及菊苣酸组(400 μmol/L),每组设立3个复孔,药物干预24 h后,提取细胞总蛋白。
1.2.3 检测指标与方法
肾功能参数检测指标:以蒽酮比色法测定菊粉含量以计算肾小球滤过率,用钠测试盒检测钠离子含量,用钾测试盒检测钾离子含量,葡萄糖测试盒检测葡萄糖含量。(肾小球滤过率=尿液中菊粉浓度/灌流液中菊粉浓度×尿量;葡萄糖重吸收率=1-尿液中葡萄糖/灌流液中葡萄糖×尿流率/肾小球滤过率;钠离子重吸收率=1-尿液中钠离子浓度/灌流液中钠离子浓度×尿流率/肾小球滤过率;钾离子重吸收率=1-尿液中钾离子浓度/灌流液中钾离子浓度×尿流率/肾小球滤过率)
尿酸排泄检测指标:尿酸试剂盒检测尿酸含量,计算尿酸清除率和尿酸排泄分数。(尿酸清除率=尿液中尿酸含量/灌流液中尿酸含量×尿流率;尿酸排泄分数=(尿液中尿酸浓度/灌流液中尿酸浓度)/(尿液中菊粉浓度/灌流液中菊粉浓度)×100%)
提取细胞总蛋白,Western-blot法检测GLUT9/OAT1蛋白的表达水平。1)SDS-PAGE胶制备:制备10%分离胶和5%浓缩胶待分离胶聚合完全后,倾倒去上层水,滤纸吸干,将上述浓缩胶组分迅速混匀,沿玻璃板壁加入分离胶至短玻璃板顶端,插入梳子,室温静置至分离胶聚合。2)SDS-PAGE电泳:组装电泳装置,加入电泳液,内槽液面高于外槽,拔出梳子,顺次加入等质量蛋白样品与预染Maker。电泳:恒压80 V 30 min,120 V 1 h,至溴酚蓝指示剂到达分离胶底部停止电泳。3)转膜电泳完成后根据预染Marker指示,准备与SDS-PAGE胶大小一致的PVDF膜、海绵垫和6层滤纸,甲醇活化PVDF膜30 s,均置于电转液平衡10 min。从电转夹负极面(黑色)依次放置海绵、滤纸、SDS-PAGE胶、PVDF膜、滤纸、海绵,排除气泡,夹紧电转夹。将电转夹正极面(透明)对电转槽红色面,放入电转槽,加满电转液,置冰盆中,恒流300 mA 1.5 h通电转膜。4)封闭及杂交:电转完成后,置入封闭液,摇床室温封闭1 h。一抗杂交:加入5%脱脂奶稀释的一抗(GLUT9:1∶50 000;GAPDH:1∶1 000),4 ℃孵育过夜。TBST洗膜5 min×3次。二抗杂交:加入5%脱脂奶稀释的二抗(山羊抗鼠二抗1∶5 000,山羊抗兔二抗1∶5 000),室温孵育1.5 h。TBST洗膜5 min×3次。5)ECL显影:配制化学发光液,避光均匀洒于PVDF膜上,曝光机自动曝光。6)图像分析Image J软件检测各蛋白条带灰度值,总蛋白以GAPDH为内参对照,计算GLUT9的蛋白表达情况。
1.3 统计学方法
采用GraphPad Prism7.00统计软件,数据均采用均数±标准差(±s)表示,含多时间点设计的2组样本间比较采用重复测量方差分析,2组独立样本间比较根据正态或方差齐性检验,采用独立样本t检验或非参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同灌注压下离体肾脏功能参数
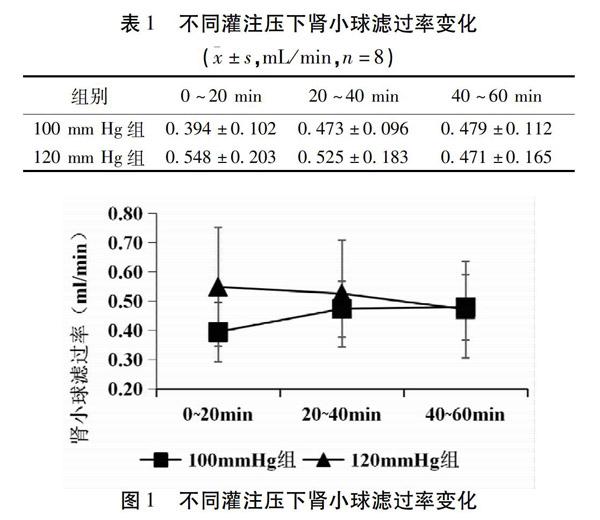
在100 mm Hg灌注压下,肾小球滤过率在0~20 min、20~40 min、40~60 min有升高趋势,但差异无统计学意义(P>0.05);在120 mm Hg灌注压下,肾小球滤过率在0~20 min、20~40 min、40~60 min有降低趋势,但差异无统计学意义(P>0.05)。与在100 mm Hg灌注压下的肾小球滤过率比较,在120 mm Hg灌注压下的肾小球滤过率较高,但差异无统计学意义(P>0.05)。结果见表1,图1。
在100 mm Hg灌注压下,尿流率在0~20 min、20~40 min、40~60 min有升高趋势,但差异无统计学意义(P>0.05);在120 mm Hg灌注压下,尿流率在0~20 min、20~40 min、40~60 min有降低趋势,但差异无统计学意义(P>0.05)。与在100 mm Hg灌注压下的肾小球滤过率比较,在120 mm Hg灌注压下的尿流率较高,但差异无统计学意义(P>0.05)。结果见表2,图2。
在100 mm Hg及120 mm Hg灌注压下,葡萄糖重吸收率在0~20 min、20~40 min、40~60 min均有降低趋势,但差异无统计学意义(P>0.05),肾脏重吸收功能仍满足模型要求。见表3,图3。
在100 mm Hg灌注压下,钠离子重吸收率在0~20 min、20~40 min、40~60 min有降低趋势,但差异无统计学意义(P>0.05);在120 mm Hg灌注压下,钠离子重吸收率在0~20 min、20~40 min、40~60 min有上升趋势,但差异无统计学意义(P>0.05);在2个不同灌注压下的不同时间段,钠离子重吸收率差异均无统计学意义,且肾脏重吸收功能满足模型要求。见表4,图4。
在100 mm Hg及120 mm Hg灌注压下,钾离子重吸收率在0~20 min、20~40 min、40~60 min差异均无统计学意义(P>0.05),且肾脏重吸收功能满足模型要求。见表5,图5。
2.2 菊苣酸对离体肾脏尿酸排泄水平影响
动态观察各组肾脏尿酸排泄情况,结果显示:与尿酸组比较,在0~20 min,菊苣酸组肾脏尿酸清除率、肾脏尿酸排泄分数差异无统计学意义,在20~40 min、40~60 min,菊苣酸组肾脏尿酸清除率、肾脏尿酸排泄分数均显著升高(P<0.05),其中,尿酸清除率分别提高75.7%,尿酸排泄分数分别提高148.68%、130.76%;与尿酸组比较,在0~20 min、20~40 min、40~60 min,丙磺舒组肾脏尿酸清除率、肾脏尿酸排泄分数均显著降低(P<0.05或P<0.01)。见表6~7,图6~7。
2.3 菊苣酸对人肾小管上皮细胞(HKC)GLUT9表达影响
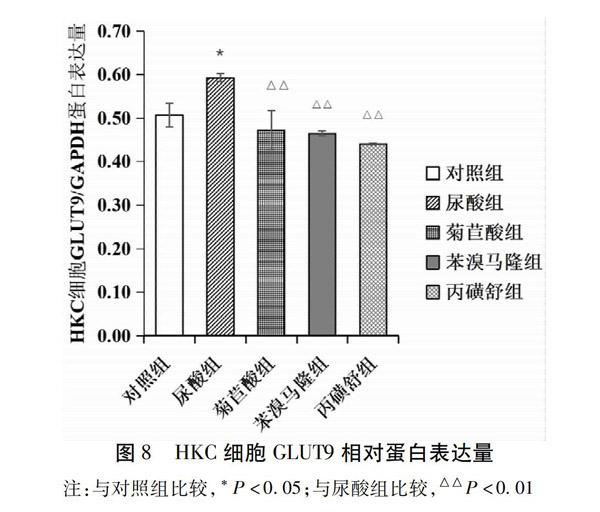
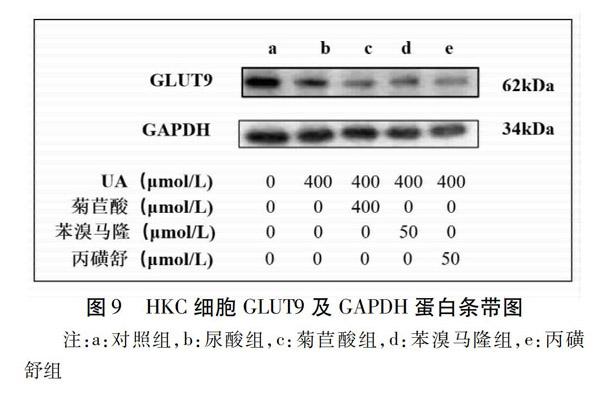
与对照组比较,尿酸组HKC细胞GLUT9蛋白相对表达量显著升高(P<0.05);与尿酸组比较,菊苣酸组、苯溴马隆组、丙磺舒组HKC细胞GLUT9蛋白相对表达量显著降低(P<0.01)。结果见表8,图8~9。
3 讨论
3.1 离体肾脏灌流模型的条件选择
适当的灌流量是保证离体肾脏功能的基本要求。目前,离体肾脏灌流有恒压灌流与恒流灌流2种灌流方式。前期实验发现,采用恒流灌注过程中,灌注压力随时间延长逐渐增大,超出肾脏的生理灌注压力,导致肾功能下降,故该研究采用恒压灌注方式。
统计离体肾脏灌流技术相关文献发现,离体肾脏灌流的灌注压力在50~160 mm Hg区间内,其中90%以上研究者选择以80~120 mm Hg区间的压力进行灌注,故该研究分别在80 mm Hg、100 mm Hg、120 mm Hg灌注压力下,观察不同灌注压力对离体肾脏功能的影响。通过观察离体肾脏功能参数,包括肾小球滤过率、尿流率、葡萄糖重吸收率、钠离子重吸收率、钾离子重吸收率等评价离体肾脏功能选择最佳灌注压力。实验结果显示,在80 mm Hg灌注压力下,尿流率小于0.005 mL/min,可能由于灌注压力较小达不到一定灌流量造成,尿量过少,无法检测肾功能参数指标,在相关图表中均未显示该组结果。在100 mm Hg、120 mm Hg灌注压力下,肾小球滤过率、尿流率、葡萄糖重吸收率、钠离子重吸收率各参数比较差异均无统计学意义,2组的肾功能相似,但与100 mm Hg比较,在120 mm Hg灌注压力下,肾小球滤过率、尿流率较高,肾功能较好,故在后续实验中,选择120 mm Hg灌注压力。
3.2 菊苣酸示例应用离体肾脏灌流模型
研究显示,菊苣具有良好的降尿酸的作用[12-13],菊苣提取物能降低高尿酸血症大鼠的血尿酸水平,增加肾脏的清除率,调节肾脏转运蛋白GLUT9和OAT1表达,从而促进尿酸排泄。朱春胜等[14]研究发现菊苣酸能够降低高尿酸血症鹌鹑的血清尿酸水平,且能够抑制鹌鹑血清中黄嘌呤氧化酶(XOD)和腺苷脱氨酶(ADA)活性,从而得出其发挥药效的机制可能与抑制XOD、ADA活性從而减少尿酸生成有关。那么,菊苣酸是否能通过促进尿酸排泄发挥降尿酸作用呢?肾脏作为对尿酸排泄贡献最大的器官,菊苣酸是否能够促进肾脏尿酸的排泄?故该研究应用离体肾脏灌流技术,排除体液、神经循环等因素的影响,观察菊苣酸对肾脏中尿酸排泄的影响。实验结果显示,菊苣酸在20~40 min、40~60 min均能提高肾脏清除率,增加肾脏尿酸排泄分数,提示菊苣酸发挥降尿酸作用可能与促进肾脏尿酸排泄有关,应用离体肾脏灌流技术初步筛选出菊苣酸可能是菊苣通过促进尿酸排泄发挥降尿酸作用的活性成分。
3.3 HKC细胞联合离体肾脏灌流模型评价菊苣酸降尿酸活性
肾脏尿酸排泄需多种位于肾小管上皮细胞的尿酸转运蛋白共同协调完成,是肾脏调节体内尿酸稳态的关键,也是新型降尿酸药物的研究靶点。目前已发现多种肾脏尿酸转运蛋白,可分为尿酸重吸收蛋白和尿酸分泌蛋白2大类。GLUT9在肾脏的分布主要在近端小管上皮细胞基底膜外侧,是唯一表达在小管上皮细胞基底膜侧的尿酸重吸收蛋白,因此对尿酸重吸收最后环节具有决定性的作用[15-17]。细胞研究显示,当GLUT9突变时,尿酸重吸收几乎完全停止[18]。Dinour等[19]发现,SLC2A9基因突变可引起尿酸吸收障碍,导致严重的低尿酸血症,并可能诱发肾结石和急性肾功能衰竭,由此认为GLUT9在尿酸盐的重吸收及维持体内尿酸稳态方面具有重要的调控作用。故该研究选择尿酸转运蛋白GLUT9为靶点,从体外细胞水平观察菊苣酸对尿酸转运的影响,从而评价离体肾脏灌流技术筛选降尿酸活性成分的可行性。
HKC细胞为人肾小管上皮细胞系细胞,多用于研究外源性毒物,不良刺激等因素对HKC损伤的机制研究等。研究显示尿酸转运体GLUT9在HKC中有表达[20],故该研究通过蛋白免疫印迹法检测高尿酸状态下HKC细胞GLUT9蛋白表达变化,及高尿酸状态下菊苣酸干预后的表达变化,实验结果显示,菊苣酸能够显著抑制高尿酸状态下GLUT9蛋白表达,提示菊苣酸可能通过调节尿酸转运体GLUT9的表达促进肾脏尿酸排泄。
参考文献
[1]Dincer HE,Dincer AP,Levinson DJ.Asymptomatic hyperuricemia:to treat or not to treat[J].Cleveland Clinic Journal of Medicine,2002,69(8):594-594.
[2]Wedn AM,El-Gowilly SM,El-Mas MM.The α7-nAChR/heme oxygenase-1/carbon monoxide pathway mediates the nicotine counteraction of renal inflammation and vasoconstrictor hyporeactivity in endotoxic male rats[J].Inflamm Res,2020,69(2):217-231.
[3]Wedn AM,El-Gowilly SM,El-Mas MM.Nicotine reverses the enhanced renal vasodilator capacity in endotoxic rats:Role of α7/α4β2 nAChRs and HSP70[J].Pharmacol Rep,2019,71(5):782-793.
[4]Marinho AD,Alison de Moraes Silveira J,Maia Chaves Filho AJ,et al.Bothrops pauloensis Snake Venom-derived Asp-49 and Lys-49 Phospholipases A2 mediates acute kidney injury by oxidative stress and release of inflammatory cytokines[J].Toxicon,2020(20):30951-X.
[5]Júnior FAN,Jorge ARC,Marinho AD,et al.Bothrops alternatus Snake Venom Induces Cytokine Expression and Oxidative Stress on Renal Function[J].Curr Top Med Chem,2019,19(22):2058-2068.
[6]Villalta M,Sampaio TL,De Menezes RRPPB,et al.Nephrotoxicity induced by the venom of Hypnale hypnale from Sri Lanka:Studies on isolated perfused rat kidney and renal tubular cell lines[J].Toxicon,2019,165:40-46.
[7]Ma YR,Zhou Y,Huang J,et al.The urinary excretion of metformin,ceftizoxime and ofloxacin in high serum creatinine rats:Can creatinine predict renal tubular elimination[J].Life Sci,2018,196:110-117.
[8]Meurer M,Ebert K,Schweda F,et al.The renal vasodilatory effect of prostaglandins is ameliorated in isolated-perfused kidneys of endotoxemic mice[J].Pflugers Arch,2018,470(11):1691-1703.
[9]Godinho AN,Costa GT,Oliveira NO,et al.Effects of cardiotonic steroids on isolated perfused kidney and NHE3 activity in renal proximal tubules[J].Biochim Biophys Acta Gen Subj,2017,1861(8):1943-1950.
[10]Smith DE,Kugler AR.Influence of intrarenal metabolism on the analysis of renal drug transport mechanisms[J].Journal of Pharmaceutical Sciences,2010,83(10):1519-1520.
[11]Giustarini D,Galvagni F,Dalle-Donne I,et al.Anethole Dithiolethione Increases Glutathione in Kidney by Inhibiting γ-Glutamyltranspeptidase:Biochemical Interpretation and Pharmacological Consequences[J].Oxid Med Cell Longev,2020:3562972.
[12]朱春勝,张冰,林志健,等.菊苣降尿酸药效验证[J].中华中医药杂志,2018,33(11):4933-4936.
[13]朱春胜,林志健,张冰,等.菊苣降尿酸作用的谱效关系研究[J].中草药,2015,46(22):3386-3389.
[14]朱春胜,张冰,林志健,等.菊苣降尿酸有效成分及机制研究[J].中草药,2017,48(5):957-961.
[15]Anzai N,Jutabha P,Amonpatumrat TS,et al.Recent advances in renal urate transport:characterization of candidate transporters indicated by genome-wide association studies[J].Clin Exp Nephrol,2012,16(1):89-95.
[16]Li S,Sanna S,Maschio A,et al.The GLUT9 gene is associated with serum uric acid levels in Sardinia and Chianti cohorts[J].PLoS Genet,2007,3(11):2156-2162.
[17]Wang MX,Liu YL,Yang Y.Nuciferine restores potassium oxonate-induced hyperuricemia and kidney inflammation in mice[J].Eur J Pharmacol,2015,747:59-70.
[18]Nakanishi T,Ohya K,Shimada S,et al.Functional cooperation of URAT1(SLC22A12)and URATv1(SLC2A9)in renal reabsorption of urate[J].Nephrol Dial Transplant,2013,28(3):603-611.
[19]Dinour D,Gray NK,Campbell S,et al.Homozygous SLC2A9 mutations cause severe renal hypouricemia[J].J Am Soc Nephrol,2010,21(1):64-72.
[20]张冰清,张昀,曾学军.尿酸转运蛋白是治疗高尿酸血症的新靶点[J].基础医学与临床,2014,34(11):1582-1585.
(2020-12-10收稿 责任编辑:徐颖)
基金项目:国家自然科学基金项目(81673618);国家中医药领军人才支持计划“岐黄学者”项目(1040063320004);国家高层次人才特殊支持计划(万人计划)教学名师项目(2020063320001)
作者简介:邹丽娜(1996.03—),女,硕士研究生,研究方向:中药防治代谢性疾病研究,E-mail:zoulina1996@163.com
通信作者:张冰(1959.08—),女,博士,教授,主任医师,博士研究生导师,研究方向:中药防治代谢性疾病研究,E-mail:zhangbing6@263.net

