重组白细胞抑制因子和水蛭肽嵌合蛋白工程菌的高密度发酵
冀成法,马鲁南,柳常青,滕学东,邵明学,刘 忠,张贵民
(1.鲁南制药集团股份有限公司 哺乳动物细胞高效表达国家工程实验室,山东 临沂 276006;2.鲁南新时代生物技术有限公司,山东 临沂 273400;3.山东新时代药业有限公司 山东省蛋白类药物工程实验室,山东 临沂 273400)
脑卒中又叫脑中风,是由各种不同病因引起的脑部血管性疾病,是我国成年人致死、致残的首位病因,具有发病率高、致残率高、死亡率高和复发率高的特点,是导致老年人死亡的最常见三大疾病(脑血管病、冠心病、肿瘤)之一。数据显示,2017年我国约有 196 万人死于脑卒中[1]。重组白细胞抑制因子和水蛭肽嵌合蛋白(TNHH)是应用基因工程技术设计的一种新型蛋白药物,属于治疗用生物制品Ⅰ类新药。该蛋白具有多重功效,包括抑制白细胞活化、迁移、黏附功能,抑制凝血酶活性,能与纤维蛋白结合,从而达到治疗脑卒中的目的[2]。TNHH由280个氨基酸组成,N末端含257个氨基酸的NIF,C末端含20肽水蛭肽(hirulog),中间由短链氨基酸交链区组成,TNHH结构中,NIF区域与天然的NIF差异1个氨基酸,而其中水蛭肽与文献[3]报道的hirulog有2个氨基酸差异。
重组大肠杆菌的生长受培养基和培养条件的影响,其中影响较大的有培养基组成、pH、培养温度、诱导剂浓度和补料方式等[4-7]。根据TNHH工程菌的生长特性,结合包涵体产量,优化培养基组成及补料流加方式,以减少碳源的抑制[8-9],控制合适的比生长速率,选择在适宜的密度诱导表达,实现TNHH工程菌的高密度高表达。鉴于诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)毒性较大、成本较高,而乳糖作为二糖,无毒、价廉,本身可以作为碳源使用,是一种较佳的IPTG替代物,目前已有不少基因工程菌利用乳糖进行诱导的报道[10-11],笔者对此进行了对比研究。随着国家药品监督管理局对制药行业抗生素使用的监管趋严,《中国药典》明确规定青霉素类抗生素禁止在生产过程中使用。为此,本研究还考察了工艺放大过程中抗生素对发酵结果的影响。
1 材料和方法
1.1 菌株
TNHH表达菌株E.coliBL21(DE3)/pET12a-TNHH,由本实验室构建(质粒构建见图 1)和保存。
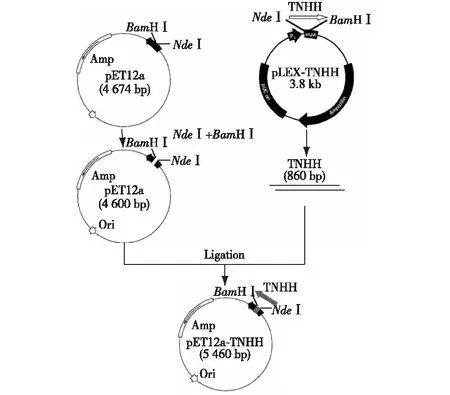
图1 表达重组质粒pET12a-TNHH的构建Fig.1 Construction of recombinant plasmid pET12a-TNHH
1.2 培养基
LB培养基:配方参照文献[12]。
LA培养基:在LB培养基中加入氨苄西林钠(Amp)溶液。
发酵培养基(M9-YE-Gly):0.3%酵母膏、0.5%蛋白胨、0.06%NaCl、0.5%KH2PO4、3%Na2HPO4·12H2O、2%甘油、0.1%MgSO4、0.3%NH4Cl。
补料:50%甘油、5%蛋白胨、3%酵母膏。
以上都是质量分数。
所有培养基均用氨水调节pH到7.0,各培养基均加入氨苄西林钠溶液至0.1 g/L。
1.3 仪器设备
5 L多联玻璃发酵罐、50 L发酵罐,迪必尔生物工程(上海)有限公司;LYNX 6000型高速冷冻离心机,Thermo公司;DM750型显微镜,徕卡公司;Ultrospec 2100 pro型紫外分光光度计,GE公司。
1.4 方法
1.4.1 种子培养
甘油管菌种划线接种至固体LB斜面上,37.0 ℃培养12~15 h,挑取种子斜面菌落接种于液体LB培养基中,37.0 ℃、150 r/min培养至OD600为 0.5~0.8,得活化种子液。
1.4.2 摇瓶培养
将培养好的活化种子液按1%接种量接入含200 mL M9-YE-Gly培养基的三角瓶中,37 ℃、200 r/min培养12~15 h。

表1 培养基的正交试验设计及结果
1.4.3 分批补料发酵
发酵采用5 L和50 L发酵罐,初始发酵体积为发酵罐体积的60%,按发酵初始体积的10%接种量接入摇瓶种子液,发酵温度为37 ℃。整个发酵过程通过调节搅拌转速或通入纯氧控制溶氧在30%~60%。当培养基中养料耗尽,溶氧和pH同步上升后,采用指数流加的方式补料。待OD600达到40,加入适当浓度的诱导剂进行诱导,根据试验设计继续补料培养。
1.5 分析方法
1.5.1 菌体密度测定
采用紫外分光光度计测定600 nm波长处的光密度,用OD600表示。
1.5.2 TNHH蛋白表达量的测定
SDS-聚丙烯酰胺凝胶电泳( SDS-PAGE)参照文献[13],采用凝胶处理系统分析目的蛋白表达量。
1.5.3 质粒丢失率检测
TNHH工程菌的表达质粒带有氨苄抗性基因,在菌体传代过程中,在一定浓度的抗生素环境下,质粒丢失后菌体便不能存活,而在不含抗生素的发酵培养液中,随着传代代次的提高,可能有部分大肠杆菌丢失了质粒,失去了抗生素抗性基因,也同时失去表达目的蛋白的能力。通过比较在含有或不含抗生素培养基的菌体存活数,可以检测质粒的丢失率,考察发酵过程的质粒稳定性。
发酵过程取样,测定菌体密度,取适当稀释倍数的菌液涂布于不含氨苄西林钠的LB平板上,37 ℃培养16 h,用无菌牙签随机挑取100个单菌落分别接种于含氨苄西林钠的LA平板和LB平板上, 37 ℃培养15 h。统计2种平板长出的菌落数目,按式(1)计算。

(1)
2 结果与讨论
2.1 摇瓶发酵结果
2.1.1 正交试验优化培养基组分
通过田口试验设计方法重点考察合成培养基中碳、氮源不同的浓度水平,进行酵母膏(Y)、蛋白胨(T)、NH4Cl(N)、甘油(G)四因素三水平试验(表1),图2所示为9组试验摇瓶的SDS-PAGE电泳表达情况,TNHH理论分子量3.1×104~3.5×104,箭头所指示的条带即为目的表达条带。经Minitab软件分析,确定了最佳的发酵培养基组成Y2T2N3G1,提高并稳定外源蛋白的表达量在30%以上。

M—标准蛋白; 1~9—9组摇瓶试验的TNHH图2 培养基组分优化的SDS-PAGE分析电泳表达图Fig.2 SDS-PAGE analysis of the optimization results of culture medium
2.1.2 温度对工程菌生长的影响
选择不同培养温度(30、35、37、39、42和45 ℃)条件下,150 r/min培养4 h后,加入IPTG诱导表达,结果如图3所示。由图3可知:在30 ℃时,工程菌的生长速度显著慢于其他温度,在接种后6 h生长速度随着温度的升高逐步加快,6 h以后工程菌生长速度趋于一致。在45 ℃培养6 h后工程菌生长速度开始减慢,同时在45 ℃培养14 h后生长速度也有下降趋势,推断高温使工程菌代谢负荷加重,影响胞内酶系统的正常运转,从而使工程菌过早老化所致。由此可知,35~39 ℃是工程菌生长的最适温度,是比生长速率达到最大值的温度范围。

图3 温度对工程菌生长的影响Fig.3 Effects of temperatures on cell growth
2.1.3 pH对工程菌生长的影响
调节培养基pH为6.0、6.5、6.8、7.0、7.2、7.5、8.0,37 ℃、150 r/min培养4 h后,加入IPTG诱导表达,发酵过程取样测OD600,结果如图4所示。由图4可知:不同pH条件下,菌体生长的延迟期均在3 h左右,其中,pH为6.8~7.5时,菌体对数生长期持续到6~7 h。在对数生长期内,工程菌在pH6.0时生长速度最慢,其次是pH8.0、7.5和6.5;而pH为6.8~7.5时,在7 h内的菌体生长速度基本相同,在7 h后随着pH的升高,生长速度呈同步上升趋势。由于工程菌在生长过程中会产生代谢副产物(如乙酸、乳酸等),摇瓶培养无法调控pH,这使培养基的pH不断下降,而pH为7.5时,工程菌在7 h后仍能保持较快的生长速度。由此可知,过低的pH(pH6.5以下)和过高的pH(pH7.5以上)都会抑制工程菌的生长,工程菌的最适生长pH为6.8~7.5。

图4 pH对工程菌生长的影响Fig.4 Effects of pH on cell growth
2.1.4 诱导剂浓度和诱导时间对工程菌生长和目的蛋白表达的影响
摇瓶培养5 h后,分别加入终浓度为0.1、0.2、0.4和1.0 mmol/L的IPTG,0.1、0.5和1.0 g/L乳糖诱导10 h,发酵结束取样测蛋白表达量,结果如表2和图5所示。由表2和图5可知:不同IPTG浓度对表达量影响不大,而不同乳糖浓度对表达量有一定影响,IPTG的诱导表达效果优于乳糖。加入IPTG和乳糖都会对工程菌的生长有显著抑制,但乳糖的抑制作用弱于IPTG,这可能与IPTG的毒性有关。综合考虑成本及高密度发酵,优选0.2~0.4 mmol/L IPTG为诱导剂。乳糖虽然摇瓶试验诱导效果不及IPTG,但1.0 g/L乳糖诱导的表达量仍能达到25.6%,其无毒、价格低廉,可以考虑在发酵罐放大阶段进一步优化以替代IPTG作为诱导剂。
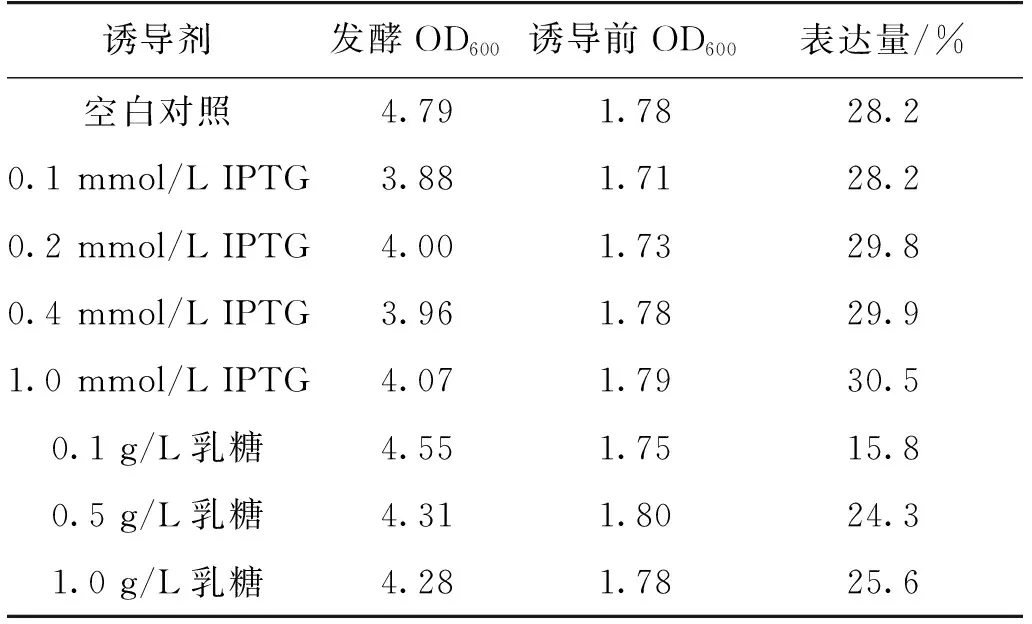
表2 不同诱导剂浓度对工程菌发酵影响实验数据

图5 诱导剂浓度与诱导时间对工程菌生长影响Fig.5 Effects of inducer concentration and induction time on cell growth
2.2 发酵罐结果
大肠杆菌高密度发酵最大的难题和障碍是乙酸的生成[14-15],基于此,在不同的时间流加同等量的补料以保证菌体正常生长,可一定程度上降低乙酸的生成。诱导剂的加入会显著抑制工程菌的生长,如果在较低的菌体密度下诱导,会导致最终发酵密度偏低,就无法实现高密度发酵,而在过高的菌体密度下进行诱导,可能会导致诱导后期菌体自溶或表达量偏低。因此,发酵诱导时机也是高密度发酵需要考虑的重要因素。由于TNHH工程菌具有氨苄抗性,在发酵过程中添加Amp能有效抑制质粒丢失工程菌的生长,在一定程度上提高发酵表达量,但《中国药典》明确规定青霉素类抗生素禁止在生产过程中使用,因此应考察非抗生素选择压力下发酵过程的质粒丢失情况,以保证生产过程的稳定。
2.2.1 5 L发酵罐发酵
在摇瓶试验结果的基础上,在5 L发酵罐中采用分批补料的方式发酵生产TNHH融合蛋白。以改良培养基为发酵基础培养基,接种量5%~10%,控制温度37 ℃,溶氧不低于30%。优化补料量和补料时间,待培养基主要碳源基本耗尽,加入IPTG诱导,诱导后补料时间控制在4、6和8 h,过程中取样检测菌体密度和表达量,发酵结果如图6和7所示。由图6和7可知:随着补料时间的延长,OD600从36.34提高至62.30;包涵体质量从7.3 g提高至18.8 g,提高了258%。随着补料时间的进一步延长,目的蛋白表达量均同步增加,可见增加补料量并延长诱导时间均有利于菌体密度的提高和目的表达产物的积累。

图6 补料量和补料时间对工程菌OD600的影响Fig.6 Effects of feed quantity and feed time on OD600

图7 补料量和补料时间对工程菌发酵的影响Fig.7 Effects of feed quantity and feed time on fermentation
2.2.2 50 L发酵罐中试发酵
基于以上试验结果,笔者确定了50 L发酵罐中试发酵方案:采用半合成培养基,溶氧30%左右,pH6.8~7.5,接种后37 ℃培养6~8 h,待养料耗尽,恒速流加补料1~2 h,待培养基主要碳源基本耗尽,加入终浓度为0.2 mmol/L IPTG诱导,继续指数流加补料诱导培养8 h,结果如表3所示。由表3可知:发酵的前一阶段,工程菌的生长速率很高,但随后工程菌生长趋于缓慢;工程菌最终的OD600在79以上,表达量维持在30%以上,质粒丢失率保持在10%以内。

表3 50 L发酵罐结果
3 结论
为实现TNHH的高密度发酵和高效表达,首先利用摇瓶试验对单因素逐一优化,随后优化补料流加策略,通过5 L发酵罐试验确定了最适宜的培养基配比、培养温度35~39 ℃、pH 6.8~7.5、诱导剂浓度0.2~0.4 mmol/L IPTG,通过优化后的培养基及发酵工艺进行50 L发酵放大,符合预期。通过摇瓶试验对比了IPTG和乳糖对发酵诱导的影响,乳糖效果不及IPTG,但其价廉、无毒,仍可以作为一种备选的诱导剂。通过不同的补料时间流加等量的补料,获得了相对较佳的补料速度和诱导时间,控制工程菌的比生长速率,从而实现菌体密度的提高和目的表达产物的积累。
采用构建的TNHH中试发酵工艺,在50 L发酵罐中发酵6批,无论是否添加抗生素,各批发酵结果的稳定性和重复性较好,最终菌体密度OD600均能达到79以上,目的蛋白表达量30%以上,发酵结束时的质粒丢失率保持在10%以内。通过一系列的发酵参数及补料控制等过程优化,摸索出了较佳的发酵培养基和工艺控制策略,发酵产量提高258%,在获得TNHH高产的同时保证了较低的质粒丢失率。本研究为该项目后续GMP生产的工艺控制与偏差管理提供了理论与技术支持,并对TNHH的商业化发酵生产及推广具有重要的技术指导意义。

