黄芪甲苷配伍三七总皂苷对OGD/R大鼠脑微血管内皮细胞增殖、凋亡及线粒体功能的影响
刘晓丹 丁煌 李艳玲 陆展辉 杨芙蓉 黄小平 邓常清

〔摘要〕 目的 觀察黄芪甲苷(AST IV)配伍三七总皂苷(PNS)对氧糖剥夺后再复糖复氧(OGD/R)大鼠脑微血管内皮细胞(BMECs)增殖、凋亡及线粒体功能的影响。方法 差速密度梯度离心法提取BMECs,免疫荧光检测血管性血友病因子(vWF)表达对细胞进行鉴定,取第3代BMECs,采用AST IV与PNS高(100 μmol/L+60 μmol/L)、中(50 μmol/L+30 μmol/L)、低(25 μmol/L+15 μmol/L)剂量配伍预处理24 h,以OGD/R建立缺血再灌注损伤模型,同时设立正常组和模型组。CCK8法测定细胞增殖情况,LDH漏出率检测细胞损伤,AnnexinⅤ/PI双染检测细胞凋亡,TraKineTMPro活细胞线粒体染色试剂盒对线粒体进行染色,激光共聚焦观察线粒体结构,JC1染色测定线粒体膜电位变化情况。结果 成功培养分离BMECs,阳性表达vWF,与正常组比较,模型组细胞存活数量明显减少(P<0.05),LDH漏出率显著增加(P<0.01),细胞凋亡率显著增加(P<0.01);与模型组比较,AST IV与PNS不同剂量配伍均能促进BMECs增殖、抑制LDH的释放和抑制细胞凋亡(P<0.05,P<0.01)。与正常组比较,模型组线粒体荧光强度明显降低,分布不均;与模型组比较,AST IV与PNS不同剂量配伍组深红色荧光强度有所增强。与正常组比较,模型组线粒体膜电位水平下降(P<0.01),与模型组比较,AST IV与PNS不同剂量配伍组线粒体膜电位明显增强(P<0.05,P<0.01)。结论 AST IV配伍PNS在体外能促进缺血再灌注模型BEMCs细胞增殖,抑制细胞凋亡,降低LDH漏出率,其机制与保护线粒体,增加线粒体膜电位有关。
〔关键词〕 脑微血管内皮细胞;脑缺血再灌注;黄芪甲苷;三七总皂苷;凋亡;增殖;线粒体
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.04.002
〔Abstract〕 Objective To observe the effects of astragaloside IV (AST IV) combined with panax notoginseng saponins (PNS) on proliferation, apoptosis, and mitochondrial function of rats brain microvascular endothelial cells (BMECs). Methods BMECs were extracted by differential density gradient centrifugation. The cells were identified by immunofluorescence detection of the expression of von willebrand factor (VWF). The third generation of BMECs were pretreated with AST IV combined with PNS at high (100 μmol/L + 60 μmol/L), medium (50 μmol/L + 30 μmol/L), and low (25 μmol/L + 15 μmol/L) doses for 24 hours. OGD/R was used to establish ischemia reperfusion injury model, and control group and model group were established at the same time. CCK8 assay was used to detect cell proliferation, LDH leakage rate was used to detect cell injury, Annexin V/PI double staining was used to detect cell apoptosis, and TraKineTMPro living cell mitochondrion staining kit was used stain the mitochondria. The structure of mitochondria was observed by confocal laser scanning. The changes of mitochondrial membrane potential were measured by JC1 staining. Results BMECs were successfully cultured and separated, and with positive expression of vWF. Compared with the control group, the number of surviving cells in the model group was significantly reduced (P<0.05), the leakage rate of LDH was significantly increased (P<0.01), and the apoptosis rate was significantly increased (P<0.01). Compared with the model group, the combination of IV and PNS at different doses could promote BMECs proliferation, inhibit the release of LDH and inhibit apoptosis (P<0.05, P<0.01); compared with the control group, fluorescence intensity of mitochondria in the model group was significantly decreased and the distribution was uneven; compared with model group, the intensity of dark red fluorescence was enhanced in AST IV and PNS groups with different doses. Compared with the control group, the level of mitochondrial membrane potential in the model group was decreased (P<0.01). Compared with the model group, the mitochondrial membrane potential of AST IV and PNS in different doses was significantly increased (P<0.05, P<0.01). Conclusion AST IV combined with PNS can promote the proliferation of ischemia reperfusion model BMECs, inhibit cell apoptosis and reduce the leakage rate of LDH in vitro. The mechanism is related to the protection of mitochondria and the increase of mitochondrial membrane potential.
〔Keywords〕 brain microvascular endothelial cells; cerebral ischemia reperfusion injury; astragaloside IV; panax notoginseng saponins; apoptosis; proliferation; mitochondria
脑缺血性疾病的病因及发病机制复杂,致残率、死亡率很高,再灌注治疗引起的脑微血管内皮细胞功能障碍是继发性神经功能受损的关键环节[1]。脑微血管内皮细胞是脑微循环的重要组成部分,也是血脑屏障的组成单位,在维持血管的完整、稳态平衡中发挥了重要的作用。因此,对脑微血管内皮细胞的保护成为脑缺血再灌注治疗的重要靶点。
黄芪总皂苷(astragalosides, AST)和三七总皂苷(Panax notoginseng saponins, PNS)为黄芪和三七发挥心脑血管效应的有效组分。课题组大量研究[2-11]证实黄芪甲苷(AST IV)和PNS配伍可多环节多靶点发挥对脑缺血再灌注损伤大鼠的神经保护作用,并且能够修复脑缺血再灌注损伤大鼠血脑屏障。基于此,本研究采用氧糖剥夺后再复糖复氧(OGD/R)建立体外缺血再灌注损伤模型,观察AST主要有效成分AST IV和PNS配伍对OGD/R大鼠BMECs增殖、凋亡及线粒体功能的影响,以期为中药有效组分配伍对脑缺血再灌注损伤后的微循环保护提供实验依据。
1 材料
1.1 实验动物
健康新生5~7 d SD大鼠6只,雌雄各半,购于斯莱克景达实验动物有限公司,实验动物质量合格证号ZS-202007210006,饲养于湖南中医药大学动物实验中心,实验动物许可证号SKY(湘)2013-0005。
1.2 药品与试剂
AST IV(质量分数≥98%,批號MUST-17022804)、PNS(质量分数≥98%,批号MUST-17060601)购于成都曼思特生物科技有限公司;Cell Counting Kit(CCK-8)试剂盒(Biosharp生物科技公司);LDH检测试剂盒(南京建成生物工程研究所);AnnexinⅤ/PI细胞凋亡检测试剂盒(南京诺唯赞生物科技股份有限公司);TraKineTMPro活细胞线粒体染色试剂盒(Abbkine生物技术有限公司);JC1线粒体膜电位检测试剂盒(北京索莱宝科技有限公司);大鼠脑微血管内皮细胞完全培养基(武汉普诺赛生命科技有限公司);vWF抗体(北京博奥森生物技术有限公司)。
1.3 主要仪器
Heracell二氧化碳培养箱(德国Heraeusy有限公司);FORMA3131三气培养箱(美国Forma公司);SW-CJ-1FD超净工作台(中国苏净安泰公司);A1激光共聚焦显微镜(日本NIKON公司);CYTATION5多功能酶标成像系统仪(美国博腾仪器有限公司)。
2 方法
2.1 BMECs分离、培养及鉴定
将出生5~7 d的6只SD乳鼠用75%乙醇消毒全身后,断头取脑。无菌条件下于冰上剥取大脑皮质,用显微手术镊小心撕去软脑膜血管,用预冷PBS 液清洗 3 次后,将脑组织块剪成1 mm3左右大小,将10 mL 0.1%的Ⅱ型胶原酶(内含0.005% D-NaseⅠ)加入50 mL离心管中37 ℃消化30 min,每10 min上下晃动离心管3次,加入等体积DMEM-F12完全培养液混匀后通过100目的筛网,收集滤液,800×g离心10 min,弃上清,加入10 mL 20% BSA溶液分别于800×g离心10 min、1 500×g离心15 min,分别收集两次离心底部沉淀,以大鼠脑微血管内皮细胞完全培养基(含4 mg/L的嘌呤霉素)重悬,以接种于调整至1×106个/mL细胞密度接种于T-75培养瓶,置于37 ℃、5% CO2、饱和湿度的培养箱培养。48 h后更换不含嘌呤霉素的培养基,待贴壁细胞完全融合后,0.25%胰酶消化传代。
选取P3代BMECs,用含0.02% EDTA的0.25%胰酶消化细胞,以1×105个/mL密度接种于预先铺有细胞爬片的12孔板中,待细胞60%融合后,吸出培养液,PBS冲洗3次(每次3 min),给予4%的多聚甲醛固定30 min,PBS冲洗3次,0.5% Tritonx-100室温孵育5 min破膜,PBS冲洗3次,2% BSA常温封闭30 min,vWF山羊抗兔一抗4 ℃湿盒内孵育过夜,PBS冲洗3次,加入荧光二抗避光孵育1 h,PBS冲洗3次,含DAPI封片剂封片,激光共聚焦拍照观察。
2.2 AST IV配伍PNS对OGD/R大鼠BMECs增殖的影响
根据本课题前期研究[12]结果,拟用AST IV与PNS高(100 μmol/L+60 μmol/L)、中(50 μmol/L+30 μmol/L)、低(25 μmol/L+15 μmol/L)剂量配伍作为药物使用剂量。以缺糖缺氧2 h再复糖复氧24 h复制脑缺血再灌注损伤细胞模型。具体操作如下:选取P3代BMECs,用含0.02% EDTA的0.25%胰酶消化细胞,以1×105个/mL密度接种于96孔板,置于37 ℃、5% CO2、饱和湿度的培养箱培养4 h,待细胞贴壁后,加入以大鼠微血管内皮细胞培养基配制的AST IV与PNS配伍药物,分为低剂量组、中剂量组、高剂量组,每孔100 μL,模型组每孔加入等体积大鼠微血管内皮细胞完全培养基,每组设立8个复孔,继续培养24 h;同时另铺1块96孔板加入等体积大鼠微血管内皮细胞完全培养基作为正常组;处理完成后,弃培养液,实验板更换成大鼠微血管内皮细胞无糖培养基置于N2 94%、O2 1%、CO2 5%的三气培养箱中培养2 h,换成大鼠微血管内皮细胞完全培养基继续培养24 h,正常组在同一时间加大鼠微血管内皮细胞完全培养基正常培养。之后取出2块培养板,每孔加入10 μL CCK8溶液,37 ℃避光孵育2 h,于多功能酶标仪测定吸光度(A)值并计算细胞相对增殖率。
细胞增殖率=(A实验-A对照)/A对照×100%
2.3 AST IV配伍PNS对OGD/R大鼠BMECs LDH漏出的影响
细胞分组及处理同“2.2”项,处理结束后,收集各组培养液,800 g/min离心10 min,取上清;同时将细胞用等量培养液重悬,反复冻融3次,离心取上清;按LDH试剂盒说明测定细胞培养液及冻融液的LDH活性,并计算出细胞LDH漏出率:
细胞LDH漏出率=培养液LDH活性/(培养液LDH活性+细胞冻融液LDH活性)×100%
2.4 AST IV配伍PNS对OGD/R大鼠BMECs细胞凋亡的影响
用胰酶消化P3代BMECs,调整细胞密度为1×105个/mL,接种于6孔板,细胞分组及处理同“2.2”项,处理结束后,胰酶消化收集细胞,调整细胞密度为1×106个/mL,按照AnnexinⅤ/PI试剂盒要求进行流式染色,每组设立5个复孔,用流式细胞仪计数2 000个细胞,计数凋亡细胞,计算凋亡率。
细胞凋亡率=(凋亡细胞总数/细胞总数)×100%
2.5 AST IV配伍PNS对OGD/R大鼠BMECs细胞线粒体形态及线粒体膜电位的影响
用胰酶消化P3代BMECs,调整细胞为5×104 个/mL,接种于有细胞爬片的12孔板,按照“2.2”项下进行分组处理。处理完成后,按照TraKineTMPro活细胞线粒体染色试剂盒及要求进行线粒体染色,于激光共聚焦显微镜下进行拍照观察。
细胞以1×105个/mL接种于96孔板,按“2.2”分组方法进行给药处理后,加入含终浓度为10 μg/mL JC1的无血清培养基,37 ℃温育30 min,PBS洗涤3次,细胞成像多功能酶标仪下分别以495 nm和585 nm激发波长进行扫描成像,并读取綠色JC1单体平均荧光强度值和红色JC1多聚体平均荧光强度值,每组设置5个复孔,以JC1多聚体平均荧光强度值/JC1单体荧光强度值进行数据统计。
2.6 统计学方法
数据均用SPSS 21.0 统计软件进行分析。计量资料用“x±s”表示,采用单因素方差分析,组间两两比较方差齐者用LSD检验,方差不齐者用Dunnet T3检验;P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
3 结果
3.1 BMECs鉴定
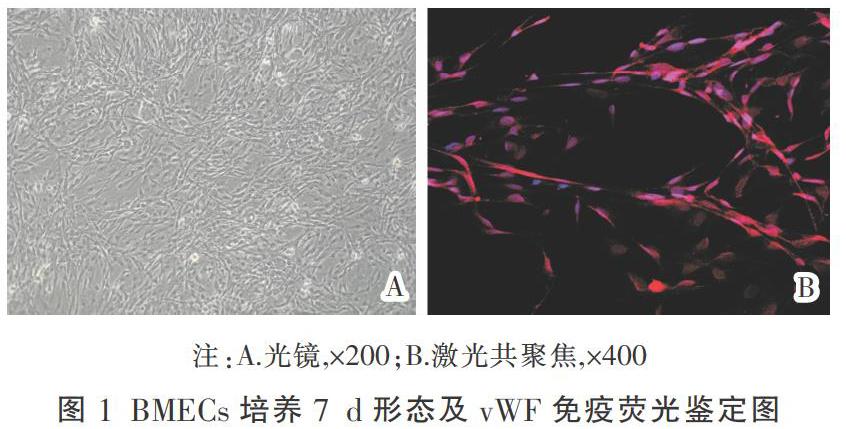
倒置相差显微镜下观察,大鼠脑微血管内皮细胞末贴壁内皮细胞呈圆形,培养48 h后细胞呈长梭形改变,7 d左右融合成致密的单层,呈“铺路石”征象,有明显的成管特性。
免疫荧光结果显示:90%以上细胞胞浆有红色荧光表达,提示细胞表达vWF因子,证实培养的细胞为内皮细胞。见图1。
3.2 AST IV配伍PNS对OGD/R大鼠BMECs增殖的影响
与正常组比较,模型组细胞增殖率降低,差异有统计学意义(P<0.05)。与模型组比较,AST IV配伍PNS的高、中、低剂量组细胞增殖率升高。差异有统计学意义(P<0.05)。见表1。
3.3 AST IV配伍PNS对OGD/R大鼠BMECs LDH漏出的影响
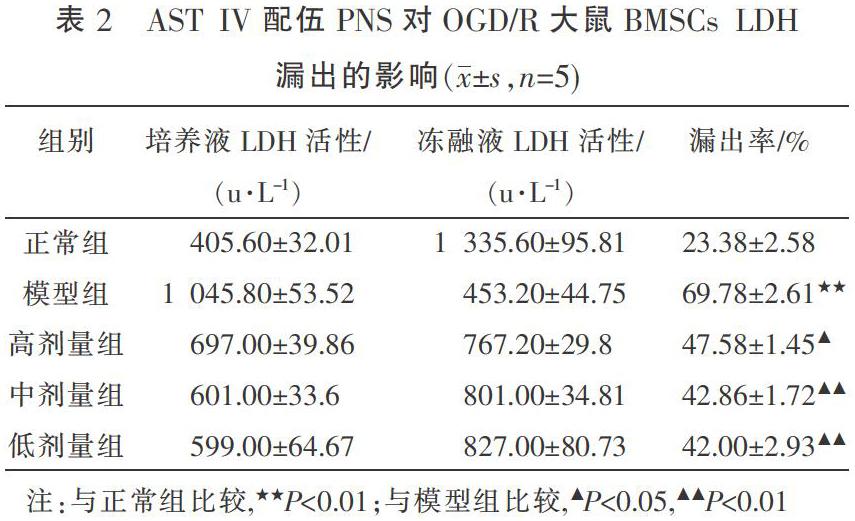
与正常组比较,模型组大鼠BMSCs LDH漏出率升高,差异有统计学意义(P<0.01)。与模型组比较,AST IV配伍PNS的高、中、低剂量组均能有效抑制LDH的漏出,差异有统计学意义(P<0.05,P<0.01)。见表2。
3.4 AST IV配伍PNS对OGD/R大鼠BMECs细胞凋亡的影响
与正常组(2.67%±0.31%)比较,模型组细胞经OGD/R刺激后,细胞凋亡率(27.56%±1.01%)显著增加,差异具有统计学意义(P<0.01)。与正常组比较,AST IV与PNS高、中、低剂量配伍均可显著抑制BMSCs凋亡(17.25%±0.84%、14.31%±0.79%、9.91%±0.57%),差异均具有统计学意义(P<0.05)。见图2。
3.5 AST IV配伍PNS对OGD/R大鼠BMECs细胞线粒体形态及线粒体膜电位的影响
TraKineTMPro活细胞线粒体染色结果显示,正常组细胞质中可观察到较多均匀分布的深红色荧光颗粒,为着色的线粒体;模型组细胞经OGD/R刺激后,红色荧光颗粒明显较少,且融合成片,提示细胞缺血再灌注损伤后,细胞线粒体数量减少,形态破坏,AST IV与PNS高、中、低剂量配伍均可不同程度减轻OGD/R后的线粒体损伤。见图3。
JC1检查结果显示,正常组BMECs细胞线粒体膜电位较高,聚集在线粒体基质中的JC1荧光探针以二聚体形式存在,产生红色荧光;经OGD/R刺激后,细胞发生凋亡,线粒体膜电位显著降低,此时JC1荧光探针为单体形式,产生绿色荧光。与模型组比较,AST IV与PNS高、中、低剂量配伍均可降低绿色荧光比例,差异具有统计学意义(P<0.05,P<0.01)。见图4。
4 讨论
脑缺血的病理生理机制为一系列复杂的级联反应,以神经元及神经网络为核心假说的脑科学研究虽然取得了可观的成绩,但在临床上的应用却非常有限,对多数患者来说,神经元的死亡仍然不可避免。脑部微循环是中枢神经血管系统中与其周围组织进行物质代谢的结构与成分,受血管内外因素、血管壁结构等的精细调节,共同维持脑部内环境的稳定[13-14]。血脑屏障(blood-brain barrier, BBB)是脑部微循环最重要的功能整合单位,脑微血管内皮细胞是构成BBB最重要的单元,在维持BBB结构完整和屏障功能上起着至关重要的作用[15-16]。研究发现[17-18],BMECs不仅参与构成血脑屏障,同时分泌多种细胞因子和活性物质,维持正常微循环稳态。因此,脑微血管内皮保护成为脑缺血再灌注治疗的重要靶点。
课题组前期对黄芪和三七的有效组(成)分配伍抗缺血性脑损伤的作用及机制进行了大量研究[1-10],发现其可通过多环节、多靶点抗脑缺血后神经功能损伤,最新研究发现[11],其与冰片配伍可抑制缺血脑组织MMP-9表达,可能减轻脑微血管基底膜损伤,保护血脑屏障,抑制血管源性脑水肿的形成。为进一步研究AST IV配伍PNS是否有靶向抗脑微血管内皮细胞损伤的作用,本研究以OGD/R法建立体外脑缺血再灌注模型,研究AST IV 配伍 PNS对OGD/R模型大鼠BMECs功能的影响。结果显示:OGD/R刺激后,BMECs细胞增殖显著减少,凋亡明显增加,LDH漏出显著增加,提示脑缺血再灌注损伤可引起BMECs 损伤,影响其屏障功能和分泌功能。AST IV与PNS不同剂量配伍均能促进BMECs增殖、抑制细胞凋亡、减少LDH的漏出,减轻缺血再灌注引起的BMECs损伤。
线粒体是細胞能量代谢场所,参与细胞凋亡的重要细胞器。线粒体膜电位是评价线粒体功能的敏感指标,它的大小直接反映线粒体功能。TraKineTMPro活细胞线粒体染色试剂盒主要由线粒体特异性染料Mito Tracker Red荧光染料构成,极易透过细胞膜,在活细胞中被氧化进而发出荧光,并聚集于线粒体中,通过荧光显微镜观察,可对线粒体结构进行观察。本研究结果显示:OGD/R损伤后,线粒体荧光强度明显降低,分布不均,线粒体膜电位显著降低,提示脑缺血再灌注损伤线粒体结构和功能明显受损,可能是引起细胞损伤和凋亡的主要机制,AST IV与PNS不同剂量配伍均能不同程度改善OGD/R模型BMECs线粒体的结构和功能,提示中药有效组分配伍抗OGD/R模型BMECs损伤的机制可能与保护线粒体,增高线粒体膜电位有关。
参考文献
[1] 黄小平,谭 华,陈北阳,等.黄芪总苷和三七总皂苷配伍对脑缺血再灌注后MMP-9和TIMP-1表达的影响[J].中国中药杂志,2010,35(16):2187-2191.
[2] 谭 华,黄小平,邓常清.黄芪总苷和三七总皂苷配伍对小鼠缺血再灌注脑组织氧化应激的影响[J].中西医结合学报,2010,8(5):448-452.
[3] 黄小平,谭 华,,等.黄芪总苷和三七总皂苷配伍对小鼠脑缺血再灌注脑组织能量障碍的影响[J].湖南中医药大学学报,2012,32(7):19-22,40.
[4] HUANG X P, TAN H, CHEN B Y, et al. Combination of total Astragalus extract and total Panax notoginseng saponins strengthened the protective effects on brain damage through improving energy metabolism and inhibiting apoptosis after cerebral ischemia-reperfusion in mice[J]. Chinese Journal of Integrative Medicine, 2017, 23(6): 445-452.
[5] HUANG X P, QIU Y Y, WANG B, et al. Effects of Astragaloside IV combined with the active components of Panax notoginseng on oxidative stress injury and nuclear factor-erythroid 2-related factor 2/heme oxygenase-1 signaling pathway after cerebral ischemia-reperfusion in mice[J]. Pharmacognosy Magazine, 2014, 10(40): 402-409.
[6] HUANG X P, DING H, WANG B, et al. Effects of the main active components combinations of Astragalus and Panax notoginseng on energy metabolism in brain tissues after cerebral ischemia-reperfusion in mice[J]. Pharmacognosy Magazine, 2015, 11(44): 732-739.
[7] 黄小平,刘晓丹,邓常清.黄芪和三七主要有效成分配伍对氧化损伤所致的PC12细胞凋亡及其活性氧、线粒体膜电位的影响[J]. 中西医结合学报,2012,10(10):1127-1134.
[8] HUANG X P, DING H, YANG X Q, et al. Synergism and mechanism of Astragaloside IV combined with Ginsenoside Rg1 against autophagic injury of PC12 cells induced by oxygen glucose deprivation/reoxygenation[J]. Biomedecine & Pharmacotherapie, 2017, 89: 124-134.
[9] 刘晓丹,成绍武,范婧莹,等.人参皂苷Rg1对H2O2诱导的HT22细胞凋亡及胞内Ca2+变化的影响[J].湖南中医药大学学报,2017,37(3):236-239.
[10] 刘晓丹,邓常清.黄芪甲苷和三七总皂苷中主要有效成分抗PC12细胞氧化损伤的配伍研究[J].湖南中医药大学学报,2012,32(1): 8-12.
[11] 欧阳波,杨筱倩,丁 煌,等.冰片配伍黄芪甲苷和三七总皂苷对脑缺血/再灌注损伤后神经血管单元的保护作用[J].中国药理学通报,2020,36(10):1470-1476.
[12] 刘晓丹,丁 煌,邓常清.黄芪甲苷配伍三七总皂苷对OGD/R大鼠骨髓间充质干细胞增殖、凋亡、迁移及神经分化的影响[J].中草药,2019,50(23):5795-5801.
[13] HAN J Y, LI Q, MA Z Z, et al. Effects and mechanisms of compound Chinese medicine and major ingredients on microcirculatory dysfunction and organ injury induced by ischemia/reperfusion[J]. Pharmacology & Therapeutics, 2017, 177: 146-173.
[14] 南 丁,金海强,滕雨明,等.缺血性脑卒中后微循环灌注缺损[J]. 中华老年心脑血管病杂志,2017,19(12):1339-1341.
[15] ABDULLAHI W, TRIPATHI D, RONALDSON P T. Blood-brain barrier dysfunction in ischemic stroke: Targeting tight junctions and transporters for vascular protection[J]. American Journal of Physiology Cell Physiology, 2018, 315(3): C343-C356.
[16] PAN Q W, HE C X, LIU H, et al. Microvascular endothelial cells-derived microvesicles imply in ischemic stroke by modulating astrocyte and blood brain barrier function and cerebral blood flow[J]. Molecular Brain, 2016, 9(1): 63.
[17] 余奇勁,陶 红.脑微血管内皮细胞与脑卒中关系的研究进展[J]. 实用医学杂志,2015,31(19):3259-3261.
[18] 何 筑,况时祥,张树森,等.脑通汤对脑微血管内皮细胞缺氧/复氧损伤内皮屏障抗原及紧密连接相关蛋白Claudin-5、ZO-1表达的影响[J].实用医学杂志,2015,31(21):3483-3486.
(本文编辑 苏 维)

