茜芷胶囊质量标准提高研究
杨博涵 朱旭江

【摘 要】 目的:建立茜芷胶囊含量测定和薄层色谱(Thin—Layer Chromatography/TLC)鉴别方法。方法:采用TLC法对处方中川牛膝进行定性鉴别;采用高效液相色谱(High Performance Liquid Chromatography/HPLC)法,以CAPCELL PAK C18(4.6 mm×250 mm,5 μm)色譜柱分离,流动相为乙腈-水(50∶50),检测波长300 nm,流速1.0 mL·min-1,柱温30 ℃。测定欧前胡素、异欧前胡素含量。结果:TLC鉴别有较强的专属性,阴性对照无干扰;欧前胡素在0.0276~0.4409 μg范围内呈良好的线性关系,r=0.9999,加样回收率为99.97%,RSD为1.66%;异欧前胡素在0.0168~0.2680 μg范围内呈良好的线性关系,r=0.9999,加样回收率为99.66 %,RSD为1.15%。结论:该方法专属性强、重现性好,可以控制本品的质量。
【关键词】 茜芷胶囊;TLC;HPLC;欧前胡素;异欧前胡素
【中图分类号】R284.1【文献标志码】 A 【文章编号】1007-8517(2021)07-0022-05
Study on Determination Method of Qianzhi Capsules
YANG Bohan1 ZHU Xujiang2*
1.Tianjin Institute of Medical and Pharmaceutical Sciences,Tianjin 300020,China;
2.Gansu Institute for Drug Control,Lanzhou 730070,China
Abstract:ObjectiveTo set up the quality standard of Qianzhi capsules and TLC identification. MethodsQualitative identification of Cyathula officinalis Kuan in prescription by TLC; The content of imperatorin and isoimperatorin were determined by HPLC. The chromatographic condition was as follows: Waters Acquity BEH C18column(4.6 mm×250 mm,5 μm), using mobile phase with acetonitrile-water(50∶50), the detective wavelength was set at 300 nm, with a flow rate of 1.0 L/min and the column temperature was 30 ℃. ResultsTLC identification has strong specificity,negative control without interference; HPLC determined that imperatorin was in range from 0.0276 to 0.4409 μg, which presented a good linear relationship(r=0.9999). The average recovery was 99.97%, RSD was 1.66%. HPLC determined that isoimperatorin was in range from 0.0168 to 0.2680 μg, which presented a good linear relationship(r=0.9999). The average recovery was 99.66%, RSD was 1.15%. ConclusionThe method is specific and reproducible. It can control the quality of Qianzhi capsules.
Keywords:Qianzhi Capsules; TLC; HPLC; Imperatorin;Isoimperatorin
茜芷胶囊是由白芷、茜草、川牛膝、三七组成的复方制剂,其现行质量标准为国家食品量标准提高,在原标准的基础上,增加了川牛膝中杯苋甾酮的薄层鉴别,并将原标准中用薄层扫描法测定欧前胡素的方法改为高效液相色谱法。结果表明采用高效液相色谱法测定白芷中欧前胡素(C16H14O4)和异欧前胡素的含量,方法操作简便、结果准确,可作为控制茜芷胶囊的定性和定量指标。白芷始载于《神农本草经》,为伞形科植物白芷, 或杭白芷的干燥根[1],具有散风除湿、通窍止痛、消肿排脓的作用[2],现代药理实验表明白芷中的有效成分之一欧前胡素属于香豆素[3]的一种,具有显著的止血、抑菌、消炎作用[4]。最新研究证实白芷中呋喃香豆素类化合物具有甲型流感病毒H1N1(Hemagglutinin 1 Neuraminidase 1)和H9N2(Hemagglutinin 2 Neuraminidase 2)的抗病毒活性[5],初步揭示其抗病毒的作用机理。笔者曾尝试测定茜芷胶囊中阿魏酸、人参皂苷Rg1、人参皂苷Rb1、人参皂苷R1的含量,结果测得的含量均较低,最终本研究采用TLC法对处方中的川牛膝进行定性鉴别,同时采用高效液相色谱法测定白芷中欧前胡素和异欧前胡素的含量,进行方法学考察,从而建立一个操作简便、专属性强、重现性好的质量标准,以用于控制该产品的质量。
1 仪器与试药
Waters Alliance e2695型高效液相色谱仪(Waters 2998 DAD检测器,Empower色谱工作站,美国Waters公司);CAMAG Scanner-3型薄层扫描仪,CAMAG半自动点样仪(瑞士CAMAG公司);KH-500DE超声波清洗器(上海超声波仪器厂);Mettler AE 240 电子天平(瑞士Mettler公司);R200D型分析天平(德国Sartorius公司); CAMAG Scanner-3型薄层扫描仪。硅胶G薄层板(青岛海洋化工厂);中性氧化铝柱(100~200目)。
乙腈(色谱纯,德国Merk 公司)、石油醚(60~90℃)、乙醚、正丁醇、乙酸乙酯、硫酸、乙醇、甲醇为分析纯,水为超纯水。欧前胡素(批号:110826-201013,含量99.6%)和异欧前胡素(批号:110827-201109,含量99.7%), 均为中国食品药品检定研究院提供。茜芷胶囊(批号:J20160901、J20160902、J20160903、J20160707、J20160829),均由甘肃新兰药药业有限责任公司提供。白芷对照药材(批号:945-9903),三七皂苷R1对照品(批号:110745-200617),茜草对照藥材(批号:121049-201003),川牛膝对照药材(批号:121065-201105),欧前胡素对照品(批号:110826-201013),杯苋甾酮对照品(批号:111804-201303)。
2 方法与结果
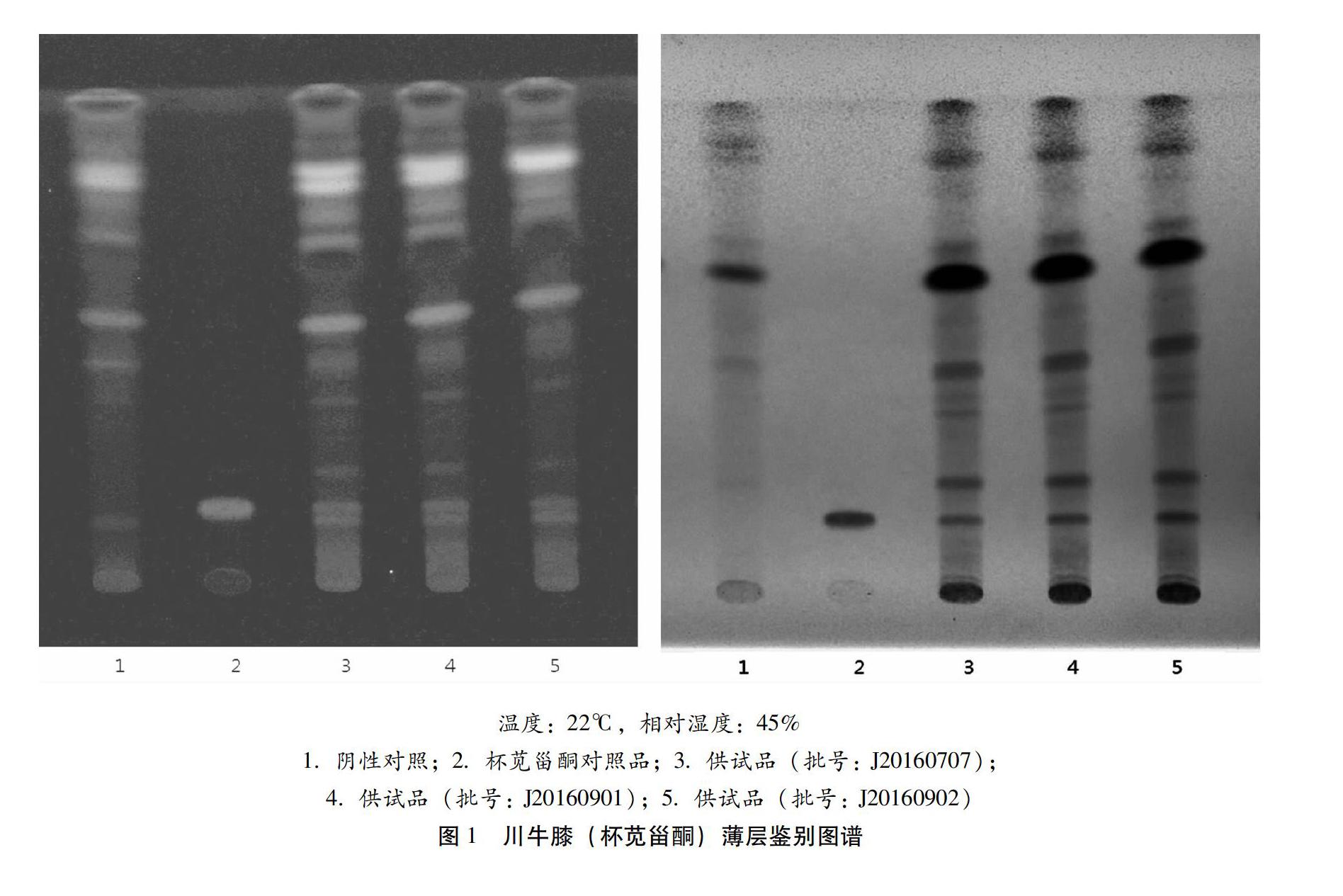
2.1 TLC鉴别 川牛膝[6]TLC鉴别取本品内容物约2 g,加甲醇50 mL,加热回流1 h,滤过,滤液浓缩至约1 mL,加于中性氧化铝柱(100~200目,4 g,内径为1 cm)上,用甲醇-乙酸乙酯(1∶1)40 ml洗脱,收集洗脱液,蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。取杯苋甾酮对照品,加甲醇制成每lml含0.5 mg的溶液,作为对照品溶液。按处方比例及工艺,取不含川牛膝的阴性样品同供试品溶液的制备方法制成阴性对照溶液。照薄层色谱法(《中国药典》 2015 年版四部通则 0502)试验,吸取上述三种溶液各5 μL,分别点样于同一硅胶G薄层板,以三氯甲烷-甲醇(10∶1)为展开剂展开,取出,晾干,置紫外光灯(365 nm)下或日光下检视。供试品色谱中,在与对照品色谱相应的位置上,紫外光灯(365 nm)下,显相同颜色的荧光斑点;日光下,显相同颜色的荧光斑点,阴性无干扰。结果如图1所示。
2.2 含量测定
2.2.1 色谱条件 色谱柱:资生堂CAPCELL PAK C18( 4.6 mm×250 mm,5 μm);流动相:乙腈-水(50∶50);检测波长:300 nm;柱温:30 ℃;流速:1.0 mL·min-1。
2.2.2 对照品溶液的制备 精密称取欧前胡素对照品11.06 mg,置50 mL容量瓶中, 加甲醇稀释至刻度,作为对照品储备液1。精密称取异欧前胡素对照品13.44 mg,置100 mL容量瓶中, 加甲醇稀释至刻度,作为对照品储备液2。再分别精密量取上述两种对照品储备液5 mL置100 mL容量瓶中,加甲醇稀释至刻度,制成混合对照品溶液。
2.2.3 供试品溶液的制备 取本品内容物10粒,混匀,研细,精密称取约0.5g,置25 mL量瓶中,加入甲醇适量,密塞,超声处理30 min(功率200 W,频率60 KHz),放至室温后,用甲醇稀释至刻度,摇匀,用0.45 μm微孔滤膜滤过,取续滤液即得。
2.2.4 阴性对照溶液的制备 按处方比例及工艺,制成不含白芷的阴性样品,取阴性样品按上述供试品溶液的制备方法制成阴性对照溶液。
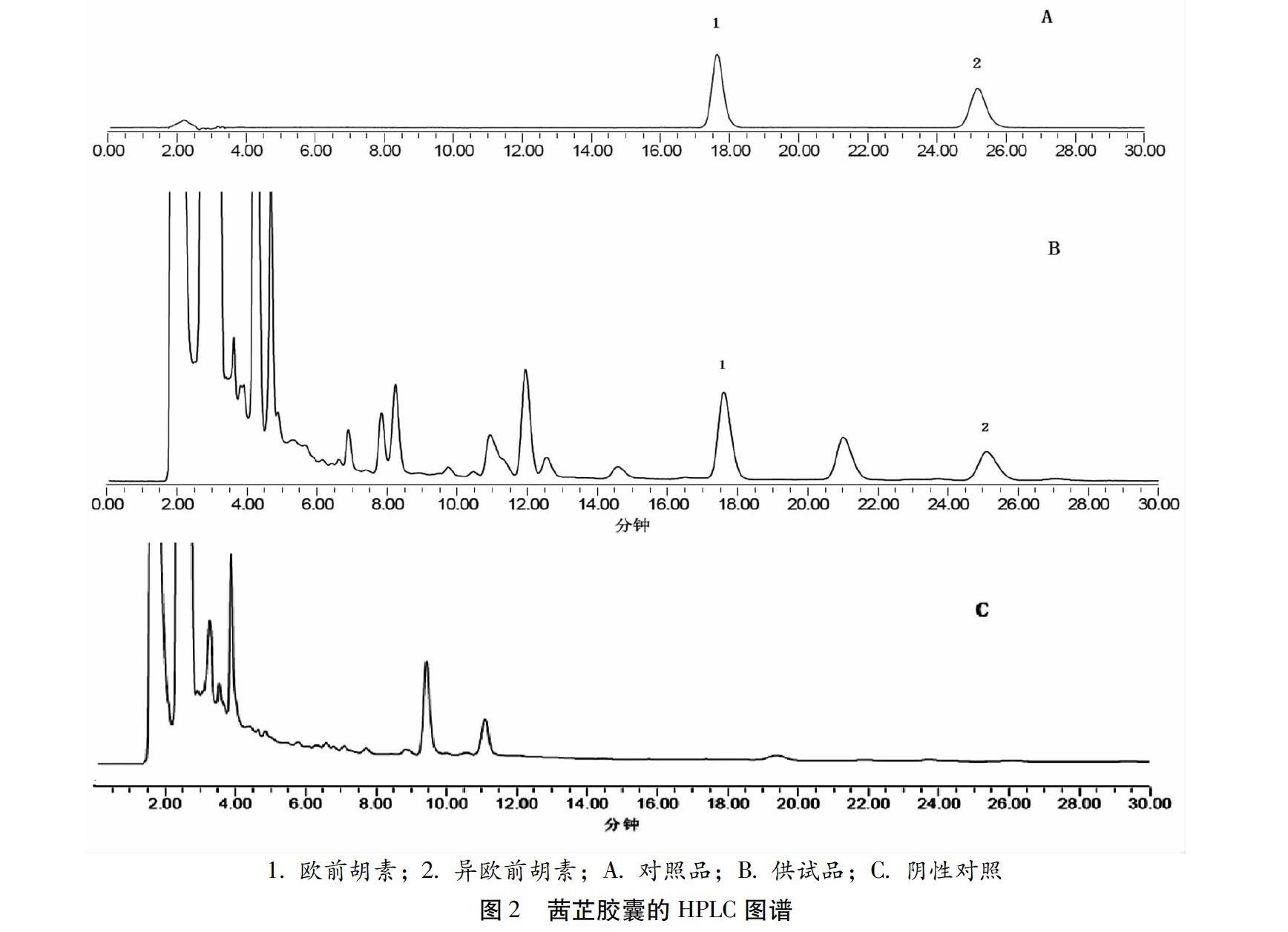
2.2.5 方法学考察 专属性考察:按“2.2.1”项下色谱条件,分别精密吸取对照品溶液、供试品溶液及阴性供试品各20 μL,注入液相色谱仪,测得液相色谱图,结果如图2所示。结果表明阴性对测定结果无干扰,且欧前胡素、异欧前胡素色谱分离良好。
线性关系考察:取“2.2.2”项下对照品溶液,按“2.2.1”项的色谱条件,分别进样2.5、5、10、15、20、25、30、40 μL,测定欧前胡素、异欧前胡素的峰面积,以进样对照品的质量(μg)为横坐标(X),峰面积的积分值为纵坐标(Y)进行线性回归,计算回归方程,见表1。结果表明,欧前胡素和异欧前胡素在线性范围内具良好的线性关系。
精密度试验:分别精密吸取欧前胡素和对照品溶液,按上述色谱条件下进样20 μL,连续重复进样6次,测定对照品峰面积的积分值,欧前胡素、异欧前胡素的RSD值分别为0.8%和1.3%,结果表明此方法精密度良好。
稳定性试验:取对照品溶液,分别在0、8、12、16、24 h按“2.2.1”项的色谱条件分别进样20 μL,以对照品峰面积计算RSD分别为1.1%和1.3%。表明欧前胡素和异欧前胡素在24 h内基本稳定。
重复性试验:取同一批号供试品(批号J20160901)6份,按“2.2.3”项下方法处理,“2.2.1”项的色谱条件测定含量,欧前胡素和异欧前胡素RSD为1.9%和1.2%,结果表明重复性良好。
加样回收率:取欧前胡素对照储备液制成110.2 μg·mL-1的溶液,分别精密吸取1.1 mL、1.3 mL、1.5 mL各3份,置25 mL用量瓶中;取异欧前胡素对照储备液制成67.0 μg·mL-1的溶液,再分别精密吸取0.6 mL、0.8 mL、1.0 mL各3份,分别置上述相应量瓶中,氮吹仪吹干。精密称取已知含量的茜芷胶囊(批号:J20160901,约0.25g)各9份,分别置上述量瓶中,依照“2.3”项下的方法测定,计算回收率,结果见表2和表3。
2.2.6 样品测定 按供试品溶液的制备方法和测定方法,对样品进行制备和测定,分别精密吸取对照品溶液与供试品溶液各20 μL,按“2.2.1”项下色谱条件进样分析,按外标法以峰面积计算样品中欧前胡素和异欧前胡素的含量,测定5批供试品的含量,结果见表4。
3 讨论
3.1 提取方法的选择 在样品的处理阶段,提取方法的选择进行了如下实验方法进行比较。方法一:按照原标准方法采用石油醚(60~90 ℃)索氏提取,蒸干后用乙酸乙酯定容至5 mL,精密取1 mL,蒸干,再用甲醇溶解后定容至100 mL;方法二:取内容物精密称取1 g,精密加入甲醇25 mL,称定重量,超声30 min,取续滤液20 mL,蒸干,用甲醇溶解后定容至5 mL[6-7];方法三:取内容物精密称取0.5 g,置25 mL容量瓶中,加入甲醇适量,密塞,超声处理30 min,放冷,用甲醇稀释至刻度。将上述三种方法的结果进行比较,发现方法一和方法二在制备的供试品溶液处理上与方法三相比步骤较为复杂,对结果的准确度影响更大。方法三操作更为简便,无需蒸干步骤,大大缩短实验所需时间,可以更快速的得出结果。且经过方法三处理后最终结果表明所测成分吸收峰附近无干扰,结果稳定。
3.2 超声时间选择 確定样品提取时间时,按照此方法三步骤进行实验,在超声处理时间上分别选取超声25、30、35、40、50 min,发现超声30 min即可将茜芷胶囊中白芷的特征成分提取完全,故最终确定30 min为超声提取时间。
3.3 流动相的选择 在含量测定时流动相的选择上,曾先后选用甲醇-水(65∶35)[8-9],乙腈-水(53∶47)[10],这两种比例为流动相,根据所测成分吸收峰进行调整,比例为乙腈-水(50∶50)时,色谱峰峰形,分离度良好,故选用乙腈-水(50∶50)为流动相。
4 结论
本次质量标准提高实验,参考中国药典[11],在原标准的三项鉴别项基础上增加了川牛膝中杯苋甾酮的薄层鉴别。经过样品的试验及方法学验证研究,结果表明该方法稳定、重现性较好,阴性样品无干扰。欧前胡素在0.0276~0.4409 μg范围内呈良好的线性关系,r=0.9999,加样回收率为99.97%,RSD为1.66%;异欧前胡素在0.0168~0.2680 μg范围内呈良好的线性关系,r=0.9999,加样回收率为99.66 %,RSD为1.15%。最终试验结果表明,该测定方法操作快捷简便、专属性强、重复性好,可作为控制茜芷胶囊的定性和定量指标,有效控制本品的质量,实现标准的优化提高。
参考文献
[1]
舒翔,叶小春,陈军,等.高效液相色谱法同时测定白芷中欧前胡素和异欧前胡素的含量[J].中国医院药学杂志,2017,13(5):427-429.
[2]朱艺欣,李宝莉,马宏胜,等.白芷的有效成分提取、药理作用及临床应用研究进展[J].中国医药导报,2014,11(31):159-162,166.
[3]朱春璐,王静,乔宇航,等.酒炖白芷中总香豆素及4种香豆素类成分的含量测定[J].中国民族民间医药,2019,28(19):27-29,36.
[4]周钢,李革,刘晓方,等.高效液相色谱法对白芷中的欧前胡素含量测定的研究[J].中医药学刊,2003,28(2):320.
[5]LEE B W, HA Thi K Q,CHO H M, et al.Antiviral activity of furanocoumarins isolated from Angelica dahurica against influenza a viruses H1N1 and H9N2 [J]. Journal of Ethnopharmacology, 2020(259):112945.
[6]张筱芳,沈敏,畅婕.RP-HPLC测定通窍鼻炎片中欧前胡素的含量[J].解放军药学学报,2008,24(4):358-360.
[7]唐福林,黎德南,韦翠吉,等.HPLC法测定克痢痧微丸中欧前胡素的含量[J].广西工学院学报,2011,15(2):78-80.
[8]郭永卿,马宝玉,孝云丽.高效液相色谱法测定蛇床子药材中欧前胡素的含量[J].西北药学杂志,2002,17(3):105-106.
[9]王连国,王欣,孟宪杰,等.高效液相色谱法测定白芷中欧前胡素和异欧前胡素含量[J].现代中西医结合杂志,2011,1(4):2816-2817.
[10]谭生健,狄海涛,卢嘉琪,等.RP-HPLC测定清眩丸中欧前胡素的含量[J].药物分析杂志,1999,19(3):177-178.
[11]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:105-106,234-235.
(收稿日期:2020-10-07 编辑:程鹏飞)

