辣木叶粗多糖的制备?单糖组成及抗氧化活性研究
聂烁 吴佳怡 程乃雪 闻正顺 王文策

摘要 [目的]制备辣木叶粗多糖并研究其单糖组成和抗氧化活性。[方法]以华南地区辣木叶为原料,水提醇沉法、Sevage法、過氧化氢(H2O2)法提取辣木叶粗多糖,水解衍生化分析单糖组成,并通过DPPH自由基清除能力、羟基自由基清除能力、超氧阴离子自由基清除能力、还原力等指标评价辣木叶粗多糖体外抗氧化活性。[结果]该试验所制备的辣木叶粗多糖提取率为7.16%,测得纯度为84.33%。辣木叶粗多糖的单糖组成有甘露糖、鼠李糖、葡萄糖、半乳糖和木糖,各占56.88%、14.44%、10.54%、9.45%和4.13%。另外,试验表明辣木叶粗多糖具有良好的自由基清除能力,抗氧化活性较好且与浓度呈正相关。[结论]该研究为辣木叶多糖的深入研究和开发利用提供科学依据。
关键词 辣木叶;粗多糖;制备;单糖组成;抗氧化活性
中图分类号 R-285 文献标识码 A
文章编号 0517-6611(2021)12-0183-04
doi:10.3969/j.issn.0517-6611.2021.12.047
开放科学(资源服务)标识码(OSID):
Study on Preparation,Monosaccharide Composition and Antioxidant Activity of Crude Polysaccharide from Moringa oleifera Leaves
NIE Shuo,WU Jia yi,CHENG Nai xue et al (School of Food Science and Pharmaceutics,Zhejiang Ocean University,Zhoushan,Zhejiang 316022)
Abstract [Objective]To prepare crude polysaccharides from Moringa oleifera leaves and to study its monosaccharide composition and antioxidant activity. [Method]Using Moringa oleifera leaves in South China as raw materials,the crude polysaccharides of Moringa oleifera leaves were extracted by water extraction and alcohol precipitation method,Sevage method,and hydrogen peroxide (H2O2) method. The anti oxidant activity of Moringa oleifera leaves polysaccharide was evaluated by indicators such as DPPH free radical scavenging ability,hydroxyl free radical scavenging ability,superoxide anion free radical scavenging ability and reducing power. [Result]The extraction rate of crude polysaccharide from Moringa oleifera leaves prepared in this experiment was 7.16%,and the measured purity was 84.33%. Moringa oleifera leaves crude polysaccharides consist of mannose,rhamnose,glucose,galactose and xylose,which account for 56.88%,14.44%,10.54%,9.45% and 4.13% respectively. In addition,the experiment showed that the crude polysaccharide of Moringa oleifera leaves had good free radical scavenging ability,good antioxidant activity and positive correlation with concentration.[Conclusion]The study provides scientific basis for further research and development of Moringa oleifera leaves.
Key words Moringa oleifera leaf;Crude polysaccharide;Preparation;Monosaccharide composition;Antioxidant activity
辣木(Moringa oleifera Lam.)又称鼓槌树,源自印度,因其抗旱抗冻特性广泛种植于世界各国[1]。辣木叶、花、果实、种子、种子油、树皮和根等各个部位成分繁多,被广泛用于传统中药中,并作为重要营养素的丰富来源,有“生命之树”的美誉[2-3]。叶子是植物最常用的营养器官,蛋白质、碳水化合物、脂肪、维生素等营养素在辣木叶大量存在,可被添加到食物中应用于人类和动物营养[4]。辣木叶中还存在许多生物活性成分,被证明有抗氧化[5-6]、抗炎和免疫调节[7]、抗菌[8]、抗病毒[9]、抗癌[10]、降血糖[11]、降血脂[12]及肝肾保护[13-14]等功效,因此应用于许多疾病的治疗,如氧化应激[15]、风湿性关节炎[16]、尿路感染[17]、糖尿病[18]、高血压[19]和肝损伤[20]等。
有报道称每100 g辣木叶中含有碳水化合物38.2 g[21],碳水化合物含量是大豆和蘑菇中的3~4倍[22]。而碳水化合物主要以具有多种生物活性的多糖大分子的形式存在。近年来对辣木叶中多糖的研究逐渐增加,集中在辣木叶多糖的提取工艺和理化性质方面的研究。辣木叶多糖的抗病毒、抗氧化、降血糖等功效在国内都已有相关报道。尽管辣木叶多糖在食品、饲料、医药中的应用价值得到国内外的认可,但王瑞琴等[23]研究指出目前我国对辣木多糖的研究尚处于探索阶段,辣木多糖的提取、结构鉴定及构效关系等研究仍需加强。该试验通过水提醇沉、Sevage法脱蛋白、H2O2脱色等手段制备了辣木叶粗多糖,并研究其单糖组成和体外抗氧化活性,为辣木叶多糖的深入研究和开发利用提供科学依据。
1 材料与方法
1.1 试验材料 辣木叶,源自华南地区。
1.2 主要仪器 HH-W420数显三用恒温水箱,金坛区白塔新宝仪器厂;MULTISKAN GO酶标仪,赛默飞世尔科技(中国)有限公司;TGL20MW台式高速冷冻离心机,湖南赫西仪器装备有限公司;90-2定时恒温磁力搅拌器,上海精科实业有限公司;FD-1E冷冻干燥机,北京德天佑科技发展有限公司;N-100旋转蒸发仪,上海爱麟仪器有限公司;1200高效液相色谱仪,美国Agilent公司。
1.3 试验方法
1.3.1 辣木叶粗多糖的制备。
1.3.1.1 多糖的提取。辣木叶烘干粉碎,称取适量的干燥辣木叶粉,加入蒸馏水(料液比1∶20),80 ℃提取3次,每次1.5 h。每次浸提完成后进行过滤,收集3次滤液后混合,减压浓缩到一定量后加入4倍体积95%乙醇,静置过夜,离心收集沉淀。沉淀用适量无水乙醇洗涤2次,50 ℃烘干。
1.3.1.2 脱蛋白、脱色。蒸馏水溶解干燥辣木叶多糖离心收集上清液,加入1/4体积的Sevage试剂 (氯仿∶正丁醇=4∶1),磁力搅拌30 min,使其充分混匀,3 000 r/min离心10 min,弃去蛋白质和有机层,上清液再加Sevage试剂,重复以上操作数次 (至少8次) ,至上清液无游离蛋白为止。0.1% NaOH调辣木叶粗多糖溶液pH为8~9,然后滴加H2O2,40 ℃保温,搅拌,静置一段时间。移入透析袋(3 000 Da)在蒸馏水中透析48 h,冷冻干燥并称重后即为辣木叶粗多糖。
多糖提取率=多糖质量/辣木叶粉质量×100%(1)
1.3.1.3 总糖和蛋白含量的测定。采用苯酚硫酸法[24]测定总糖含量,采用考马斯亮蓝法[25]测定蛋白含量。
1.3.1.4 脱色率的测定。在预试验中对1%辣木叶粗多糖溶液进行全波长(200~800 nm)扫描以判断辣木叶粗多糖的最大吸收波长。结果显示辣木叶粗多糖无最大吸收波长,因此选用 400、420、450、480、500 nm下测定脱色前后吸光度,并按照公式(2)计算脱色率。
脱色率=脱色前吸光度-脱色后吸光度脱色前吸光度×100%(2)
1.3.2 单糖组成分析。
1.3.2.1 水解。5 mg辣木叶粗多糖,加入1 mL 2 mol/L的三氟乙酸,105 ℃水解6 h。水解后反复加入甲醇蒸出三氟乙酸,最后将辣木叶多糖溶于水中,配制成5 mg/L的溶液待用。
1.3.2.2 单糖标准品溶液的配制。称取等摩尔干燥至恒重的Man、GlcN、Rha、GlcUA、GalUA、Glc、Gal、Xyl、Ara、Fuc共10种单糖标准品,配制成1 mg/L的水溶液。
1.3.2.3 衍生化。分别取100 μL水解完全的单糖标准品和辣木叶粗多糖溶液、120 μL 0.5 mg/L的PMP甲醇溶液与100 μL 0.3 mg/mL的氢氧化钠溶液充分混匀,70 ℃反应1 h,冷却后加100 μL 0.3 mg/mL的盐酸中和,再加700 μL氯仿,振摇后静置,弃去氯仿相,萃取3次后离心,取上清液过微孔滤膜上高效液相色谱分析。
1.3.2.4 色谱条件。Agilent XDB-C18色谱柱;流动相为PBS(pH=6.7)/乙腈(82∶18,V/V);流速1 mL/min;柱温30 ℃;进样量20 μL;检测器为DAD(245 nm)。
1.3.3 抗氧化活性的测定。
1.3.3.1 DPPH自由基清除能力。试管中依次加入1 mL无水乙醇、250 μL 0.02%的DPPH乙醇溶液、1 mL不同浓度的辣木叶粗多糖溶液,混匀后室温避光反应30 min,在510 nm处测定吸光度记为A0;空白组中用无水乙醇代替 0.02%的DPPH乙醇溶液,测定吸光度记为A1;对照组中用蒸馏水代替辣木叶粗多糖溶液,测得吸光度记为A2。DPPH清除率按公式(3)计算。
DPPH清除率=(A1+A2-A0)/A2×100%(3)
1.3.3.2 羟基自由基清除能力。试管中依次加入1 mL 9 mmol/L 硫酸亚铁溶液、1 mL 9 mmol/L 水杨酸的50%乙醇溶液、1 mL不同浓度的辣木叶粗多糖溶液和1 mL 0.03%过氧化氢溶液,37 ℃精确反应1 h,冷却至室温后510 nm测吸光度,記为A0;空白对照组中用蒸馏水代替辣木叶粗多糖溶液,测得吸光度记为A1;样品对照组中用50%乙醇溶液代替水杨酸的50%乙醇溶液,测得吸光度记为A2。羟基自由基清除率按公式(4)计算。
清除率=[1-(A0-A2A1)]×100%(4)
1.3.3.3 超氧阴离子自由基清除能力。取1 mL不同浓度的辣木叶粗多糖溶液,加入4 mL 0.05 mol/L的Tris-HCl缓冲液(pH=8.0),充分混匀后25 ℃水浴20 min,再加入0.4 mL 2.5 mmol/L邻苯三酚溶液混匀后在25 ℃反应3 min,最后加入10 mL 2 mol/L HCl溶液终止反应,在325 nm处测定吸光度记为An;空白组中用蒸馏水代替辣木叶粗多糖溶液,测定吸光度记为A0。超氧阴离子自由基清除率按公式(5)计算。
清除率=[(A0-An)/A0]×100%(5)
1.3.3.4 还原力。取2 mL辣木叶粗多糖溶液加入2 mL PBS缓冲溶液(0.02 mol/L,pH=6.6)和2 mL 1%铁氰化钾溶液充分混匀后,置于50 ℃反应20 min后,在混合体系中继续加入2 mL 10%三氯乙酸溶液。然后从混合体系中取出2 mL置于试管中,加入2 mL蒸馏水和0.4 mL 0.1%三氯化铁溶液室温反应10 min后,700 nm测定吸光度。吸光度越大,还原力越大。
2 结果与分析
2.1 辣木叶粗多糖的制备 该试验采用水提醇沉法提取、Sevage法脱蛋白、H2O2法脱色制备辣木叶粗多糖,辣木叶粗多糖提取率为7.16%,相比陈瑞娇[26]所述最佳提取工艺的提取率降低了1倍。该试验在对辣木叶多糖进行了简单的纯化(脱蛋白、脱色)后计算的提取率,Sevage试剂、H2O2都会对多糖进行不同程度的降解[27],可能是造成辣木叶粗多糖损失的重要原因。制备的辣木叶粗多糖中多糖含量为84.33%,蛋白含量仅为1.08%,多糖含量比董竹平等[28]提取的3种辣木叶多糖都要高,说明该方法制得的辣木叶粗多糖含量较高。该试验还进行脱色率的考量,辣木叶粗多糖无最大吸收波长,辣木叶粗多糖脱色前显橙红色、脱色后显浅黄色,从溶液的互补色考虑蓝紫光的紫外吸收波长范围(400~500 nm)来测定吸光度,计算得出400、420、450、480和500 nm下的脱色率分别为46.36%、52.53%、57.68%、59.00%和50.74%。目前在国内还未发现对辣木叶多糖脱色率的有关报道。
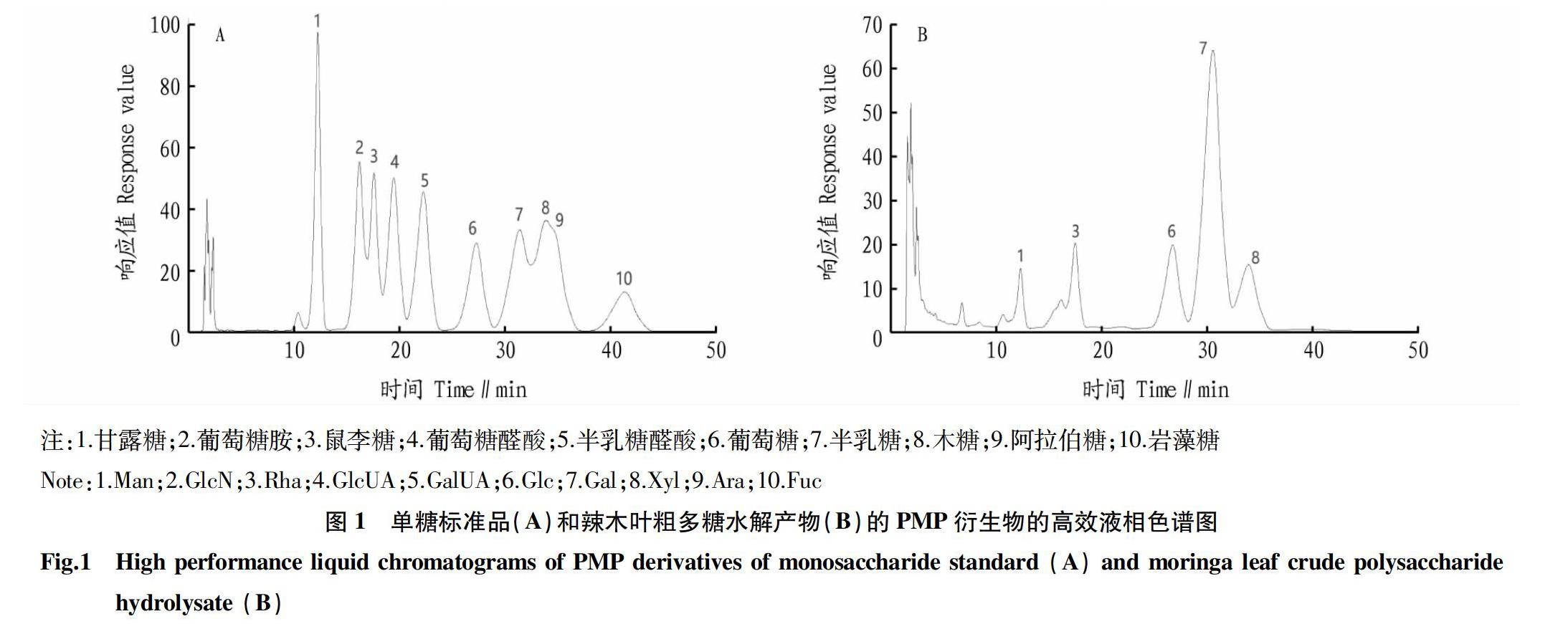
2.2 辣木叶粗多糖的单糖组成
从图1可以看出,10个单糖标准品衍生物以及辣木叶粗多糖水解后PMP衍生物均实现了分离。结果显示,辣木叶粗多糖中半乳糖含量最高,占多糖含量的56.88%,其次是葡萄糖占14.44%、木糖占10.54%、甘露糖占9.45%,鼠李糖含量最低,占4.13%。此结果与汪芳等[29]鉴定的辣木叶多糖中单糖种类大致相同,而李巧琳[30]试验结果表明辣木叶多糖除半乳糖、葡萄糖、甘露糖和鼠李糖外还包括葡萄糖醛酸、半乳糖醛酸和阿拉伯糖。可见,辣木叶多糖一般包含半乳糖、葡萄糖、甘露糖和鼠李糖等单糖。而辣木叶的产地、试验条件和试验操作等因素可能导致了辣木叶多糖的单糖组成的差异。
2.3 辣木叶粗多糖的抗氧化活性
2.3.1 DPPH自由基清除能力。
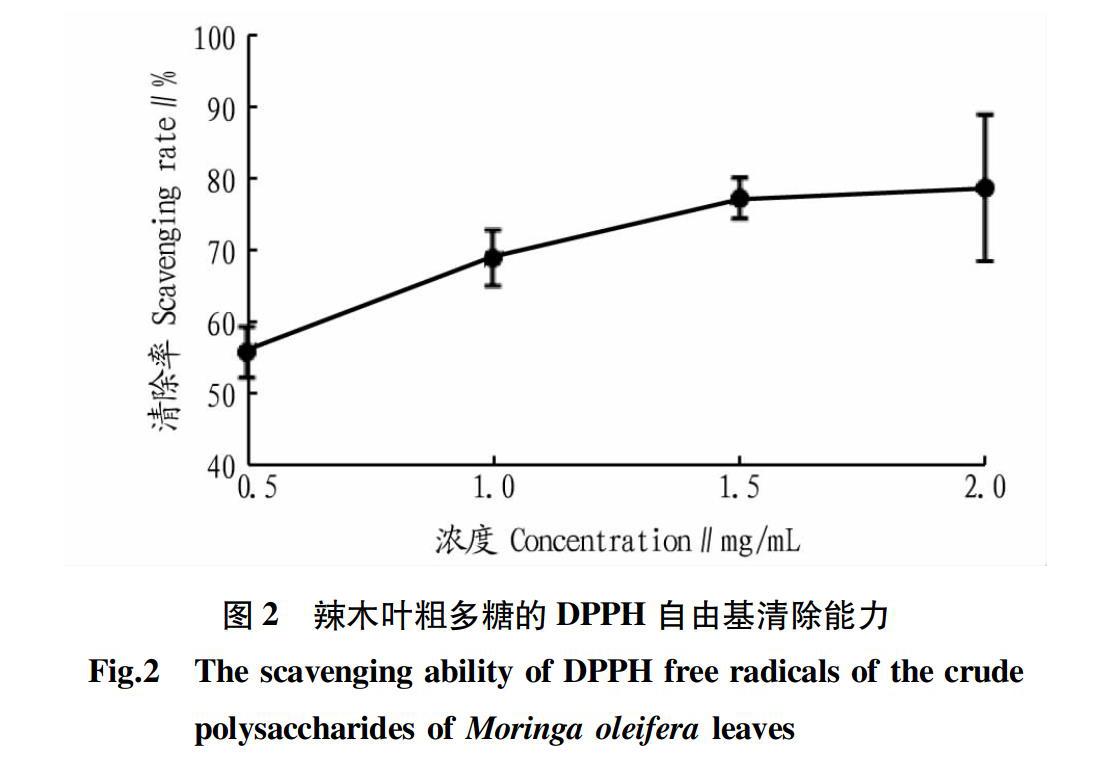
DPPH自由基因其稳定、有最大吸收波长,常用于评价生物试样、提取物的抗氧化能力。该试验测试了4个不同浓度的辣木叶粗多糖DPPH自由基清除率,如图2所示,自由基清除率与辣木叶粗多糖浓度呈正相关,2 mg/mL辣木叶粗多糖的DPPH自由基清除率高达78.91%。相比董竹平等[28]和初雅洁等[31]的试验结果,该辣木叶粗多糖有较高的DPPH自由基清除能力。
2.3.2 羟基自由基清除能力。
羟基自由基清除能力也是评价抗氧化能力常用方法之一。由图3可见,辣木叶粗多糖对羟基自由基的清除随浓度的升高而增强,当辣木叶粗多糖浓度为1.5 mg/mL时,羟基自由基清除率为29.51%。辣木叶粗多糖浓度增加到2 mg/mL时,与1.5 mg/mL相比,羟基自由基的清除率没有显著改变。尽管该试验结果显示比董竹平等[28]所测不同品种辣木叶多糖的羟基自由基清除率要低,但效果优于海南产辣木叶多糖[32],依然具有良好的抗氧化活性。
2.3.3 超氧阴离子清除能力。
超氧阴离子自由基在生物体代谢过程中产生,可攻击生物大分子,引起细胞结构和功能的破坏,与机体衰老和病变密切相关,清除超氧阴离子自由基具有重要意义。测定不同浓度辣木叶粗多糖的超氧阴离子清除率,结果发现(图4),辣木叶粗多糖浓度越高,超氧阴离子自由基的清除率也随之上升。2 mg/mL辣木叶粗多糖对超氧阴离子的清除率在28.76%,略低于梁鹏等[33]的试验结果。
2.3.4 还原力。
还原力反映抗氧化活性,还原力越强,抗氧化活性越强。辣木叶粗多糖可以将铁氰化钾还原成亚铁氰化钾,亚铁氰化钾与三氯化铁反应的产物在700 nm有最大吸收,吸光度越高,辣木叶粗多糖的还原性越强。从图5可以看出,吸光度与辣木叶粗多糖的浓度成正比,浓度越高,辣木叶粗多糖还原力越高。相比初雅洁等[31]所测得的6种辣木叶多糖还原力,该辣木叶粗多糖有较高的还原性。
3 结论
该研究使用水提醇沉、Sevage试剂、H2O2等手段制备得到辣木叶粗多糖,提取率为7.16%,多糖含量为84.33%,纯度较高。辣木叶粗多糖单糖组成为半乳糖(56.88%)、葡萄糖(14.44%)、木糖(10.54%)、甘露糖(9.45%)和鼠李糖(4.13%)。不同浓度辣木叶粗多糖对DPPH自由基、羟基自由基、超氧阴离子自由基的清除反映了其良好的还原力及抗氧化活性,抗氧化活性程度取决于辣木叶粗多糖的浓度。该试验为辣木叶多糖深入研究和开发利用提供一定的科学依据。
参考文献
[1]
DHAKAD A K,IKRAM M,SHARMA S,et al.Biological,nutritional,and therapeutic significance of Moringa oleifera Lam[J].Phytotherapy research,2019,33(11):2870-2903.
[2] 郭剛军,龙继明,黄艳丽,等.多油辣木不同部位营养成分分析及评价[J].食品工业科技,2016,37(22):354-358,364.
[3] FAHEY J W.Moringa oleifera:A review of the medical evidence for its nutritional,therapeutic,and prophylactic properties. Part 1[J].Trees for life journal,2005,1:1-15.
[4] ODURO I,ELLIS W O,OWUSU D.Nutritional potential of two leafy vegetables:Moringa oleifera and Ipomoea batatas leaves[J].Scientific research & essays,2008,3(2):57-60.
[5] CHUMARK P,KHUNAWAT P,SANVARINDA Y,et al.The in vitro and ex vivo antioxidant properties,hypolipidaemic and antiatherosclerotic activities of water extract of Moringa oleifera Lam. leaves[J].Journal of ethnopharmacol,2008,116(3):439-446.
[6] 趙一鹤,李沁,夏菁,等.辣木叶提取物的抗氧化活性研究[J].安徽农业科学,2019,47(7):136-138.
[7] KOOLTHEAT N,SRANUJIT R P,CHUMARK P,et al.An ethyl acetate fraction of Moringa oleifera Lam.inhibits human macrophage cytokine production induced by cigarette smoke[J].Nutrients,2014,6(2):697-710.
[8] DAS B R,KURUP P A,NARASIMHA RAO P L.Antibiotic principle from moringa pterygosperma[J].Naturwissenschaften,1954,41(3):66.
[9] LIPIPUN V,KUROKAWA M,SUTTISRI R,et al.Efficacy of Thai medicinal plant extracts against herpes simplex virus type 1 infection in vitro and in vivo[J].Antiviral research,2003,60(3):175-180.
[10] SREELATHA S,JEYACHITRA A,PADMA P R.Antiproliferation and induction of apoptosis by Moringa oleifera leaf extract on human cancer cells[J].Food and chemical toxicology,2011,49(6):1270-1275.
[11] MBIKAY M.Therapeutic potential of Moringa oleifera leaves in chronic hyperglycemia and dyslipidemia:A review[J].Frontiers in pharmacology,2012,3:1-12.
[12] GHASI S,NWOBODO E,OFILI J O.Hypocholesterolemic effects of crude extract of leaf of Moringa oleifera Lam in high fat diet fed wistar rats[J].Journal of ethnopharmacology,2000,69(1):21-25.
[13] MAZUMDER U K,GUPTA M,CHAKRABARTI S,et al.Evaluation of hematological and hepatorenal functions of methanolic extract of Moringa oleifera Lam. root treated mice[J].Indian journal of experimental biology,1999,37(6):612-614.
[14] OUDRAOGO M,LAMIEN SANOU A,RAMD N,et al.Protective effect of Moringa oleifera leaves against gentamicin induced nephrotoxicity in rabbits[J].Experimental & toxicologic pathology,2013,65(3):335-339.
[15] PRASANNA V,SREELATHA S.Synergistic effect of Moringa oleifera attenuates oxidative stress induced apoptosis in Saccharomyces cerevisiae cells:Evidence for anticancer potential[J].International journal of pharma and bio sciences,2014,5(2):167-177.
[16] DELAVEAU P.Oils of Moringa oleifera and Moringa drouhardii[J].Plant medicine phytotherapy,1980,14(10):29-33.
[17] SHAW B P,JANA P.Clinical assessm ent of Sigru (Moringa oelifera Lam) on Mutrakrichra (lower urinary tract infection)[R].NAGARJUN,1982:231-235.
[18] ASRES K.The major constituent of the acetone fraction of Ethiopian Moringa stenopetala leaves[J].Mansoura journal of pharmacological science,1995,11(1):55-64.
[19] FAIZI S,SIDDIQUI B S,SALEEM R,et al.Isolation and structure elucidation of new nitrile and mustard oil glycosides from Moringa oleifera and their effect on blood pressure[J].Journal of natural products,1994,57(9):1256-1261.
[20] PARI L,KUMAR N A.Hepatoprotective activity of Moringa oleifera on antitubercular drug induced liver damage in rats[J].Journal of medicinal Food,2002,5(3):171-177.
[21] SENGEV A I,ABU J O,GERNAH D I.Effect of Moringa oleifera leaf powder supplementation on some quality characteristics of wheat bread[J].Food and nutrition sciences,2013,4(3):270-275.
[22] FARZANA T,MOHAJAN S,SAHA T,et al.Formulation and nutritional evaluation of a healthy vegetable soup powder supplemented with soy flour,mushroom,and moringa leaf[J].Food science & nutrition,2017,5(4):911-920.
[23] 王瑞琴,許文婷,蔡晨晨,等.辣木多糖的研究进展[J].广西糖业,2018(4):28-30.
[24] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical chemistry,1956,28(3):350-356.
[25] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical biochemistry,1976,72:248-254.
[26] 陈瑞娇.辣木叶多糖的提取及分离纯化[J].中药材,2006,29(12):1358-1360.
[27] 付学鹏,杨晓杰.植物多糖脱色技术的研究[J].食品研究与开发,2007,28(11):166-169.
[28] 董竹平,李超,扶雄.不同品种辣木叶多糖的理化性质和抗氧化活性研究[J].现代食品科技,2018,34(1):38-44.
[29] 汪芳,包伊凡,张羽,等.辣木叶多糖的分离纯化及其体外降糖活性研究[J].食品安全质量检测学报,2018,9(7):1592-1598.
[30] 李巧琳.辣木叶提取物的制备、降血糖活性评价及降糖功效因子结构解析[D].广州:华南理工大学,2019.
[31] 初雅洁,龚加顺.辣木叶多糖的提取及抗氧化活性研究[J].食品研究与开发,2020,41(13):152-156,175.
[32] 吴玲雪,施平伟,洪枫,等.海南产辣木叶粗多糖提取条件优化及其抗氧化活性研究[J].饲料工业,2017,38(2):59-61.
[33] 梁鹏,甄润英.辣木茎叶中水溶性多糖的提取及抗氧化活性的研究[J].食品研究与开发,2013,34(14):25-29.

