低强度抗凝联合多指标监测在成人静脉-动脉体外膜氧合抗凝管理中的并发症分析
熊 鹰,魏新广,韩云飞,刘 燕
体外膜氧合(extracorporeal membrane oxygena⁃tion,ECMO)已成功地应用于常规治疗失败的心肺功能障碍的危重患者。 目前,最广泛应用的抗凝策略是体外生命支持组织(Extrcorporeal Life Support Organization, ELSO)推荐的系统性抗凝联合肝素使用,尽管在监测策略方面取得了部分技术进步,但与使用相关的并发症在过去几年中没有减少[1]。 传统高抗凝强度已被证实可增加出血风险[2-4]。 相反,低剂量肝素的方案则降低了出血事件发生率[5-9],但是否对血栓形成等其他并发症的发生有明确改善,目前国内外缺乏相关研究。 本研究旨在探讨低强度抗凝联合多指标监测在成人静脉-动脉(veno-artery, V-A) ECMO 抗凝管理中的并发症的发生情况。
1 资料与方法
1.1 研究对象 选取武汉市亚洲心脏病医院2011年2 月至2020 年10 月收治的所有使用V-A ECMO成人患者113 例,年龄范围18 ~81 岁,其中男性77名,女性36 名,进行回顾性研究。 根据抗凝策略不同分为传统高强度组(n =53)和低强度组(n =60)。记录患者在ECMO 期间发生的并发症情况。 纳入标准:①年龄≥18 岁;②V-A ECMO;③符合ECMO适应证。 排除标准:①静脉-静脉(veno-venous, VV)ECMO;②18 岁以下者;③在 V-A ECMO 启动的前24 h 有活动性出血者。
1.2 资料收集
1.2.1 患者的基本资料 包括年龄、性别、体重、基础病史、手术术式、ECMO 转机时间、ECMO 期间并发症、院内死亡人数。
1.2.2 仪器和设备 采用离心泵式体外循环机(Maquet 或 Sorin);中空纤维氧合器(Sorin),成人体外膜肺套包(Maquet 或Sorin);膜式氧合器前后压力监测、连续静脉氧饱和度监测及动态超声血流量监测以及各种管径动静脉插管套包。
1.2.3 抗凝策略 2011 年 5 月至 2018 年 3 月采用普通肝素抗凝,采用活化凝血时间(actived clotting time, ACT)监测肝素抗凝,维持 ACT 目标为 180 ~220 s。 2018 年 3 月开始至今采用 ECMO“凝血五项”[凝血酶原时间(prothrombin time, PT)、部分凝血活酶时间(activated partial thromboplastin time,APTT)、抗 Xa 因子、纤维蛋白原(fibrinogen,FIB)、D-二聚体]监测抗凝,维持 ACT 目标值 140 ~180 s,APTT 40~50 s,抗 Xa 因子 0 ~0.3 IU/ml,FIB、D-二聚体、PT 无明确目标值,其测定用以指导血小板、新鲜冰冻血浆、FIB 和抗纤溶药物的使用,对抗凝起辅助指导作用;当APTT 较低时,D-二聚体测量值较低且无升高趋势则继续当前抗凝,若D-二聚体持续升高则需要提高抗凝强度。 PT 是外源性凝血途径的共同监测指标,可用来指导新鲜冰冻血浆、凝血酶原复合物或冷沉淀的使用。 接受ECMO 的患者在外周插管前按照ELSO 指南予以肝素50 ~100 U/kg,随后在ECMO 期间传统高强度组患者根据EL⁃SO 抗凝策略予以 20 ~50 U/(kg·h)肝素量持续输注,在低强度组病患根据凝血五项查血结果予以1~10 U/(kg·h)肝素量持续输注。 患者在 ICU 由一个多学科团队监测,每天对实验室检查进行评估,根据标准 ICU 护理每 2 ~4 h 测量一次 ACT 和 APTT,如果肝素剂量调整或情况需要更频繁地变动,则更频繁地测量。 如果APTT 超出范围,则根据方案改变肝素的输注速度。 对于有明显出血的患者,如果保守止血措施失败,则停用肝素。 调整 ECMO 血流量,维持平均动脉压>65 mmHg,混合静脉血氧饱和度维持在70%左右。 维持血小板>50×109/L,以防发生出血。 维持血红蛋白>100 g/L、红细胞压积(hematocrit, HCT)>0.30。 每日检测血气分析、血常规、肝功能、肾功能、胸部X 片、床旁心脏超声等检查,常规记录患者生命体征,如平均动脉压、尿量、中心静脉压等。
1.2.4 并发症 本研究观察的并发症包括出血相关并发症、血栓相关并发症、肾功能损伤、神经功能障碍、远端肢体缺血、感染等并发症。 其中出血相关并发症定义为临床记录的显著出血事件,包括出血需要手术处理或24 h 内输血2 次及以上或24 h 内血红蛋白下降>20 g/L[10]。 血栓相关并发症包括下肢血栓形成、心内血栓和肺栓塞,所有其他血栓性并发症均经影像学证实,即使不需要干预也包括在内。远端肢体缺血定义为无脉搏、苍白和坏疽或骨筋膜室综合征[11]。 神经系统并发症定义为有脑出血、脑卒中或癫痫发作、深昏迷[12]。 肾功能损伤定义为需要肾脏替代治疗或血肌酐>132 mmol/L[13]。 感染定义为脓毒症或疑似脓毒症需要使用抗生素控制(在 ECMO 转机中血培养或痰培养证明)[13-14]。
1.3 统计学处理 应用SPSS 26.0 软件进行统计学处理。 检验前对所有计量资料进行正态性检验,符合者进行独立样本t检验,其结果以均数±标准差()表示;反之则使用Mann-Whitney 检验,其结果使用中位数和四分位数间距[Q(Q1,Q3)]表示;计数资料结果以例数百分比[n(%)]表示,组间比较采用卡方检验,当理论频数<5,或总频数<40 时,采用连续校正检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 基线资料 两组患者性别、年龄、体重、基础疾病、ECMO 转机时间以及ECMO 应用原因方面无统计学差异。 与高强度抗凝治疗组相比,低强度组的每日平均 APTT 值更低(P<0.01)。 详见表 1。

表1 患者基线资料
2.2 并发症详情 本研究所纳入的113 名患者中,共76 名患者发生各类并发症。 其中最常见的并发症为肾功能损伤(50%),其次为出血(41%)和感染(25%)。 低强度组在总体并发症以及独立并发症方面,发生比例与高强度组无明显统计学差异。 出血患者中,手术部位出血25 例(22%)、穿刺部位出血7 例(6%)、消化道出血9 例(8%)及其他部位出血5 例(4%),组间比较无明显差异。 详见表2。
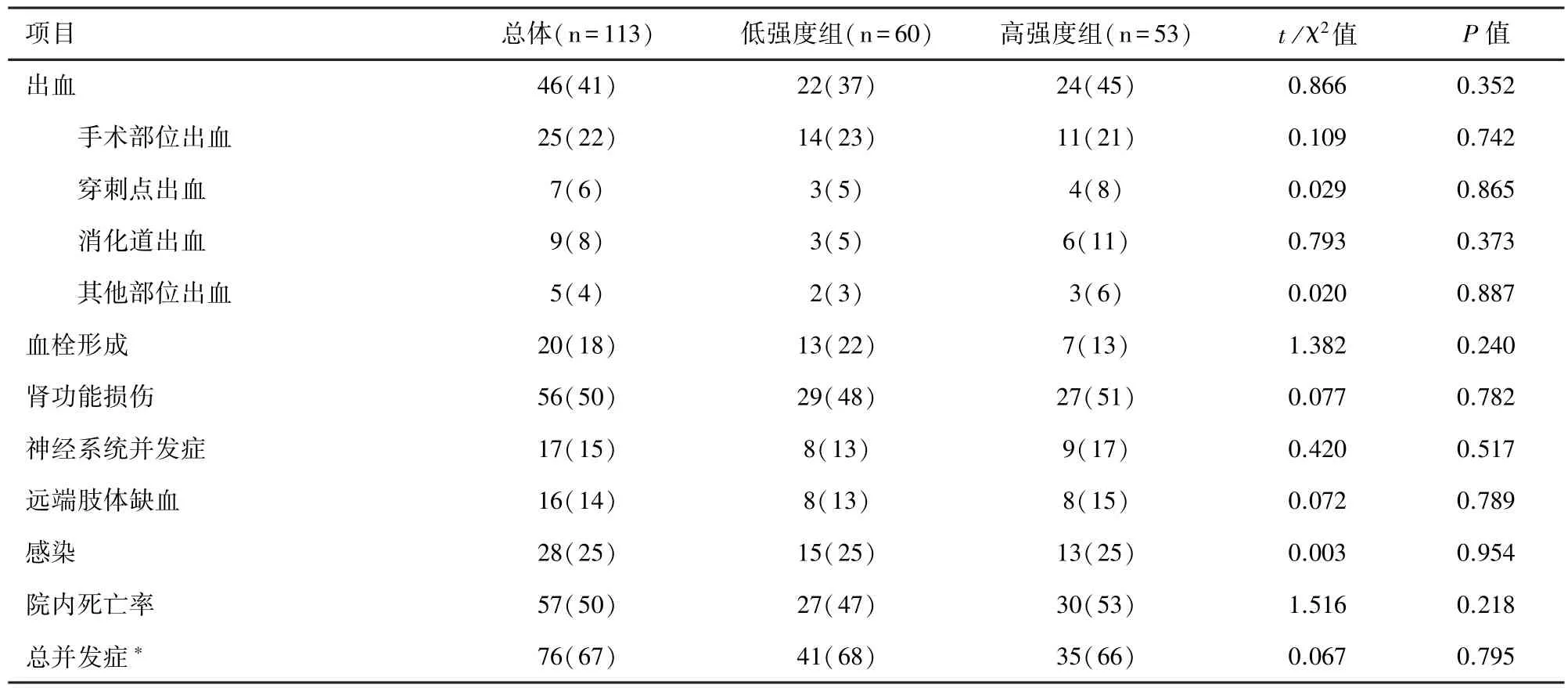
表2 患者并发症详情[n(%)]
3 讨 论
ECMO 作为一种体外循环发展而来的生命支持技术,可以为常规治疗失败的心脏衰竭、呼吸衰竭及其他危重症患者提供生命支持。 但目前依然存在技术复杂、并发症多、专业性强等亟待解决的问题。ECMO 相关并发症包括:出血和血栓、感染、神经并发症、肢体缺血以及肾损伤等。 目前,低强度抗凝作为尝试解决出血等多种并发症的新方案,已在国内外逐渐应用于临床。 Aubron 等[15]最近报道了 42 例患者在接受V-V 或V-A ECMO 治疗同时给予低剂量肝素治疗(期间常中断抗凝治疗)后,获得了69%的极好生存率。 最近的一项随机对照研究比较了两组ECMO 患者接受两种不同 APTT 靶点(50 ~70 s vs. <45 s) 普通肝素抗凝的患者[16],其结果提示两组出血并发症发生率、输血需求或血栓并发症发生率无明显差异,与本研究的结论一致。 同时,有越来越多的未使用或使用少量肝素的案例报道[17-18]。
出血和血栓形成是ECMO 最常见且最重要的并发症。 已有文献报道,约27%~60%的成年患者接受ECMO 治疗过程中发生各种出血[19]。 各研究报道的出血发生率相差显著可能与出血的定义不同有关。出血是导致不良预后的重要因素,以ECMO 插管部位或手术切口较常见,也可出现身体其他部位出血,如消化道、肺、腹膜后、心包等部位。 本研究中最主要的出血来源于手术部位出血、其次为ECMO 插管点及消化道出血,这与之前的研究一致[2],相比于高强度组,低强度组出血并发症有减少的趋势(37%vs. 45%,P=0.352),这与之前的报道结果相似[10],可能需要更大规模的研究来得出不同抗凝强度间的统计学意义。 出血的原因可能与凝血功能异常、抗凝过度、ECMO 运行中凝血因子和血小板消耗减少、血小板功能降低、肝素诱导的血小板减少等有关[20-22]。 一项对成人 ECMO 出血事件危险因素预测研究提示,出血前较高的APTT 是出血的独立危险因素,提示更好地控制APTT(通过更好地控制凝血功能或抗凝)可能改善患者的预后[2]。 因此在ECMO 前评估患者出血风险、个体化肝素治疗、精细化抗凝管理、密切监测凝血功能是有效的预防出血措施。 ECMO 患者也有血栓形成的高风险,其尸检的发生率远高于临床[23],部分原因是血液与人工膜和 ECMO 回路接触,导致凝血激活[24]。 Cheng 等[19]对1 866 例成人V-A ECMO 应用的报道中提示,动脉血栓的发生率为4.2%~19%,静脉血栓的发生率为1.1%~17%,心内血栓的发生率为 0.8%~6.3%。本研究中总共发生20 例(18%)血栓事件,其中最常见的为深静脉血栓形成(59%)。 应用低强度抗凝策略,理论上存在增加血栓事件的风险,但本研究结果提示,低抗凝组患者的血栓发生率与传统抗凝组并无统计学差异。 目前广泛采用肝素抗凝预防血栓形成,肝素涂抹管路技术、生物相容性管路及离心泵的使用可以减少血栓的发生,但仍无法避免血栓形成[25]。 有效的抗凝是预防血栓形成的必要条件,但目前还没有普遍接受的标准用于V-A ECMO 患者。大多数中心倾向于将 APTT 水平提高 1.5 ~ 2 倍[26],但其他指南由于出血的风险建议预防性抗凝[27]。合理的抗凝方案及抗凝监测可能有助于减少出血与血栓的发生,但目前为止没有一个公认的方案。 本中心的经验是联合多种实验室指标监测抗凝,维持APTT 目标值40~50 s,对于有出血倾向的患者这一值可以更低。
神经系统并发症在成人V-A ECMO 中比较常见,发生率约为 9.9% ~ 17.7%[18],且与死亡率正相关[28]。 在本研究中,两组患者神经系统并发症发病率尽管无统计学差异,但出现并发症者均有较高的死亡率(89%),故应引起临床医师重视,尽早预防及干预。 肾功能损伤同样是ECMO 的常见并发症,其发生率约为 35.5% ~ 74.0%[19],机制可能与患者原发病、ECMO 运行中的溶血相关。 急性肾功能衰竭(acute renal failure, ARF)的发生与进展可导致接受ECMO 治疗的患者住院期间死亡率增加[29]。 故在危重患者中成功预防ARF 仍然具有挑战性,持续肾脏替代治疗是首选的治疗方式。 对于远端肢体缺血而言,低强度组与传统抗凝组患者远端肢体缺血发生率分别为 13%和 17%(P>0.05),与之前报道相似[19]。 放置远端肢体灌注管是较为有效的预防手段。 感染的发生与患者基础疾病、手术方式及ECMO转机时长以及侵入性的操作有关。 有研究表明,VA ECMO 模式下更容易发生感染[30]。 本研究中总的感染发生率为28%,两个抗凝组无统计学差异(P>0.05)。 本中心的经验是对于怀疑有感染的患者尽可能早的行痰培养、血培养明确病原菌,在药敏试验指导下使用抗生素。 不建议为预防感染做监测培养,因为缺乏支持其使用的证据,而且不太可能具有成本效益[31]
尽管本研究提示应用低强度抗凝策略并未减少接受V-A ECMO 患者并发症的发生率,但并不意味着该策略不具有临床意义,原因有二。 其一,低强度抗凝与高强度抗凝策略属于天平两端,对应着血栓-出血风险的平衡,低强度抗凝在出血和血栓发生事件上无统计学差异,但其出血发生率有减少趋势,这属于潜在获益;其二,低强度抗凝的最佳参数范围尚不明确(本中心目前的抗凝策略为ACT 140 ~180 s、APTT 40~50 s),故本研究仅能提示在成人V-A EC⁃MO 低强度抗凝的策略下,未能改善并发症的发生情况,同时从侧面亦提示该策略的应用相对安全。
4 结 论
ECMO 的抗凝策略一直以来是国内外临床医师关注的重点。 低强度抗凝目前作为一种尝试减少出血相关并发症的策略逐渐被应用于临床。 本研究提示采用低抗凝方案或系统性抗凝方案在接受V-A ECMO 治疗的患者中,出血、血栓、神经系统并发症、肾功能损伤、感染以及远端肢体缺血发生率并没有统计学差异。 提示低强度抗凝方案在V-A ECMO应用上,可能是一种安全可靠的抗凝策略。 更为精准、获益更高的低强度抗凝策略尚待进一步研究。

