右美托咪定对猪体外循环下心肌线粒体功能的影响
吴建江,戴晓雯,王 江
心肺转流(cardiopulmonary bypass, CPB)是心脏外科手术中常用的心脏辅助技术,同时可引发全身性炎症反应综合征并影响患者预后,其炎症反应包括激活血小板、嗜中性粒细胞、单核细胞和巨噬细胞,从而导致内皮通透性增加以及微血管损伤。 这些炎症反应与心肌缺血再灌注(Ischemia/reperfu⁃sion,I/R)损伤有关,导致心肌梗死、呼吸衰竭、肾和神经功能障碍、出血过多、肝功能改变、多器官衰竭等以及死亡[1]。 右美托咪 定 (Dexmedetomidine,Dex)是一种选择性的α2-肾上腺素能激动剂,被广泛用于CPB 下心脏手术患者的镇静和镇痛,Dex 作用于交感神经末梢的α2-肾上腺素能受体,抑制去甲肾上腺素的释放[2]。 已经显示α2-肾上腺素能激动剂可以保护缺血性心肌,Dex 抑制了再灌注后血浆去甲肾上腺素浓度的增加,表明Dex 通过直接作用于心肌而不是通过中枢神经系统介导的心肌,发挥抗 I/R 损伤的保护作用[3]。 但 Dex 对 CPB 后心肌线粒体功能的影响仍未完全阐明,本研究旨在评估Dex 是否能减轻CPB 下心肌线粒体损伤,为降低临床心脏手术后高发病率和死亡率提供理论基础。
1 材料和方法
1.1 实验动物及分组 清洁级健康小型猪体重(33±3)kg,按数字表法随机分为两组(6 只/组):CPB组(T 组)建立 CPB;CPB+Dex(D 组)麻醉诱导前给予以 1 μg/kg 的 Dex 输注,速率为 0.5 μg/(kg·h)并建立CPB。 由新疆医科大学动物实验中心提供,并依照美国国立卫生院发布的有关实验室动物饲养及使用指南(1996 年修改版)。
1.2 CPB 模型的建立 小型猪静脉注射,行气管插管后胸部正中切口,电锯劈开胸骨,切开心包,切缘吊于胸壁,静脉注射肝素3 mg/kg 系统肝素化后,分别在升主动脉、主动脉根部、上腔静脉、下腔静脉缝荷包备用。 升主动脉(12 F)、上腔静脉(10 F)、下腔静脉(12 F)予以插管并固定,连接人工心肺机。 主动脉根部荷包中央插入并固定16 号套管针,连接冷灌装置。各组均以羟乙基淀粉130/0.4 氯化钠注射液预充,预充总量 30 ~40 ml/kg,维持流量 120 ~160 ml/(kg·min),将红细胞压积保持在 0.20~0.25。 阻断升主动脉后在主动脉根部灌注4℃改良del Nido 心脏停搏液15 ml/kg,停跳 60 min 后开放升主动脉,辅助循环120 min。 复跳期间酌情使用血管活性药物维持循环稳定,如有恶性心律失常予以交流电复律。
1.3 监测时点及血流动力学指标 两组的观察时间点为麻醉前(T0)、CPB 建立后(T1)、心脏复跳后5 min(T2)、心脏复跳后 60 min(T3)和心脏复跳后120 min(T4)。 Powerlab/8SP 数据采集系统于复灌末分别记录:心率(heart rate, HR)、左室收缩峰压(left ventricular systolic pressure, LVPSP)、 左室舒张末压(left ventricular end-diatolic pressure, LV⁃EDP)、左心室内压上升最大速率(+dp/dtmax)和左心室内压下降最大速率(-dp/dtmax)。
1.4 电镜观察心肌超微结构排列形态改变 心脏灌流结束后,取下心脏,用双面刀片在左室游离壁处取材。 心室肌切成1 mm3的小块,用4℃戊二醛磷酸缓冲液固定液24 h,常规脱水、浸透、包埋、染色、制成50~70 nm 的超薄切片,透射电子显微镜(trans⁃mission electron microscopy, TEM)下,观察心肌细胞超微结构。
1.5 ELISA 法检测 利用肌酸磷酸激酶同工酶(creatine phosphokinase MB, CKMB)和心肌肌钙蛋白 I ( cardiac troponin I, cTnI) 试 剂 盒 ( Sigma -Aldrich,美国)检测血清中CKMB 和cTnI 含量。
1.6 Western blot 分析 再灌注末每组取剪取左心室缺血危险区心肌组织,立刻置于液氮保存。 提取心肌组织总蛋白,采用组织裂解液裂解,取样品30 μg,在 SDS-PAGE 凝胶系统中电泳,转膜,于37℃封闭2 h,加入兔抗猪锰-超氧化物歧化酶(manganese superoxide dismutase, Mn-SOD)1 μg/ml(Stressgen Biotechnologies,加拿大)孵育过夜(4℃),TBST 液洗膜后与辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗1 ∶5 000 室温孵育1 h,电化学发光(electro-chemi-luminescence, ECL)显色成像,应用 Quantity One 2.6.2 图像分析系统对目的蛋白条带进行灰度值分析。
1.7 心肌ATP 含量测定 ATP 测定试剂盒是基于荧光素-荧光素酶反应来定量心肌ATP 含量,通过反相高效液相色谱法测定心肌磷酸肌酸的浓度。 糖原检测试剂盒用于测定心肌中糖原的浓度[4]。
1.8 线粒体活性氧(reactive oxygen,ROS)产生的测定 通过荧光测定方法检测线粒体ROS 的产生率[5]。 在一个线粒体反应体系中,将 2.9 ml 线粒体ROS 测定培养基和0.5 mg 线粒体加入到3 ml 石英比色皿中。 在另一个线粒体反应体系中,加入5 mmol/L 2',7'-二氯荧光素二乙酸酯(DCFH-DA)3 μl 之前,使用 3.3 mmol/L 不含线粒体的琥珀酸作为底物,这一反应体系在37℃孵育15 min,测定线粒体反应体系的荧光强度(样品荧光强度)和无线粒体反应体系的荧光强度(基础荧光强度),通过从样品荧光强度中减去基础荧光强度来计算ROS 产生速率。
1.9 统计学分析 使用 GraphPad Prism 7.0(Graph⁃Pad Software,San Diego,CA)进行统计分析。 数据采用均数±标准误(D)表示,所有数据采用单因素方差分析。 两组间使用 Student'st检验。 多组间采用单因素方差分析,并进行图基(tukey)事后检验法。P<0.05 为差异有统计学意义。
2 结 果
2.1 心功能指标 与 T 组比较,D 组 LVPSP 和+dp/dtmax在 T2、T3 和 T4 各时点明显增加,-dp/dtmax在 T3 和 T4 明显增加(P<0.05),而 LVEDP 在再灌注开始时显著降低(P<0.05)。 见表 1。
表1 两组动物血流动力学变化(n=6,D)
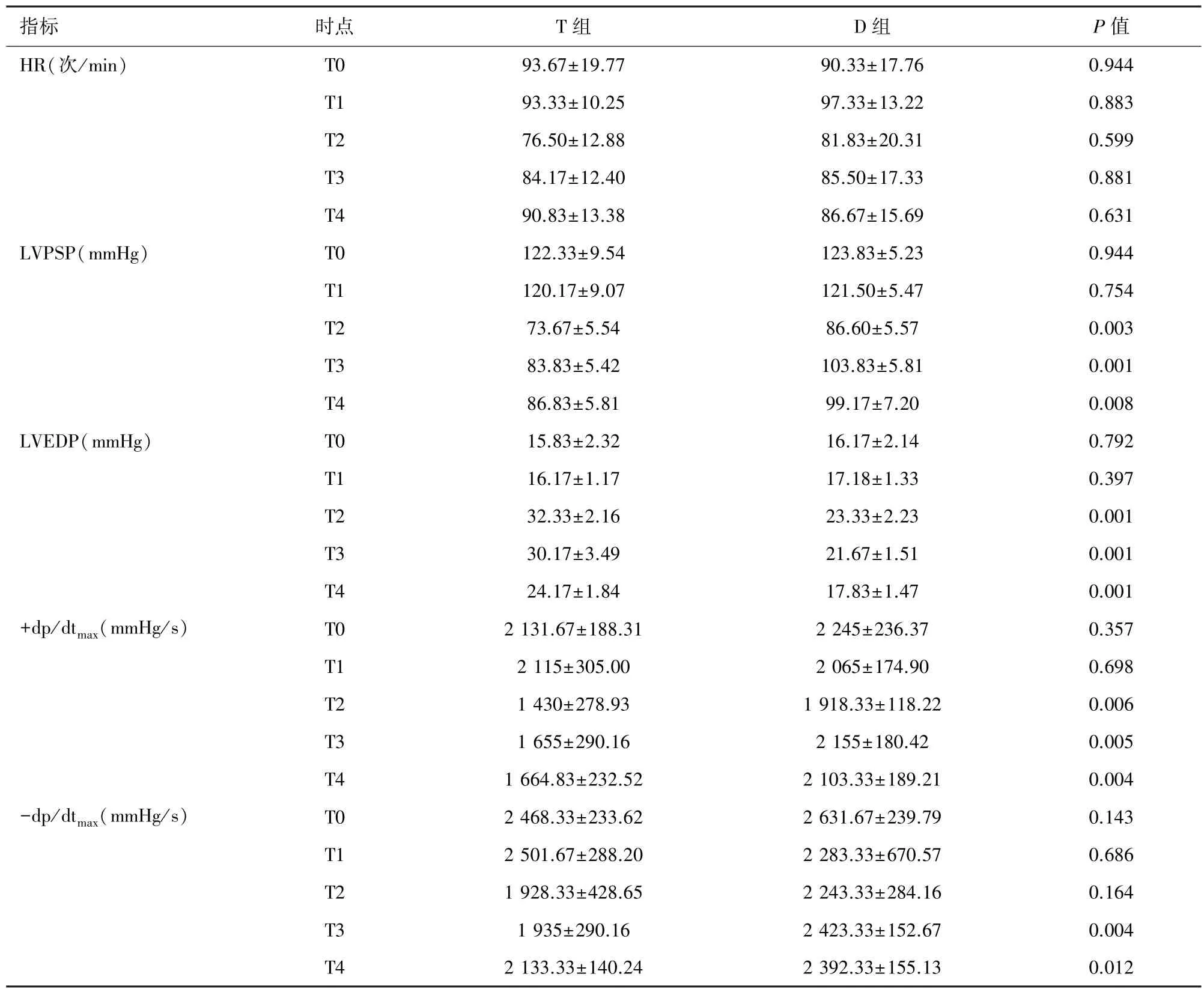
表1 两组动物血流动力学变化(n=6,D)
注:HR:心率;LVPSP:左室收缩峰压;LVEDP:左室舒张末压;+dp/dtmax:左心室内压上升最大速率;-dp/dtmax 左心室内压下降最大速率
指标 时点 T 组 D 组 P 值HR(次/min) T0 93.67±19.77 90.33±17.76 0.944 T1 93.33±10.25 97.33±13.22 0.883 T2 76.50±12.88 81.83±20.31 0.599 T3 84.17±12.40 85.50±17.33 0.881 T4 90.83±13.38 86.67±15.69 0.631 LVPSP(mmHg) T0 122.33±9.54 123.83±5.23 0.944 T1 120.17±9.07 121.50±5.47 0.754 T2 73.67±5.54 86.60±5.57 0.003 T3 83.83±5.42 103.83±5.81 0.001 T4 86.83±5.81 99.17±7.20 0.008 LVEDP(mmHg) T0 15.83±2.32 16.17±2.14 0.792 T1 16.17±1.17 17.18±1.33 0.397 T2 32.33±2.16 23.33±2.23 0.001 T3 30.17±3.49 21.67±1.51 0.001 T4 24.17±1.84 17.83±1.47 0.001+dp/dtmax(mmHg/s) T0 2 131.67±188.31 2 245±236.37 0.357 T1 2 115±305.00 2 065±174.90 0.698 T2 1 430±278.93 1 918.33±118.22 0.006 T3 1 655±290.16 2 155±180.42 0.005 T4 1 664.83±232.52 2 103.33±189.21 0.004-dp/dtmax(mmHg/s) T0 2 468.33±233.62 2 631.67±239.79 0.143 T1 2 501.67±288.20 2 283.33±670.57 0.686 T2 1 928.33±428.65 2 243.33±284.16 0.164 T3 1 935±290.16 2 423.33±152.67 0.004 T4 2 133.33±140.24 2 392.33±155.13 0.012
2.2 心肌线粒体超微结构与形态 T 组心肌结构严重受损,肌丝溶解甚至断裂;线粒体肿胀明显,嵴膜间隙增宽、破裂,肌浆网高度扩张。 D 组心肌清晰,肌丝排列尚整齐,部分肌丝及肌节间隙增宽并溶解;线粒体大多数形态完整,数量较多;嵴膜清晰可见,但未见溶解破裂。 见图1。

图1 两组心肌线粒体超微结构与形态变化(×30 000)
2.3 心肌 CKMB 和 cTnI 水平 在 T4 时,两组的CKMB 值持续增加,与 T 组相比,D 组中的 CKMB 值显著降低(P<0.05)。 在 T3 和 T4 时,两组的 cTnI值均增加,与T 组相比,D 组中的cTnI 值显著降低(P<0.05)。 见表 2。
表2 两组样本血清中CKMB 和cTnI 含量变化(n=6,D)
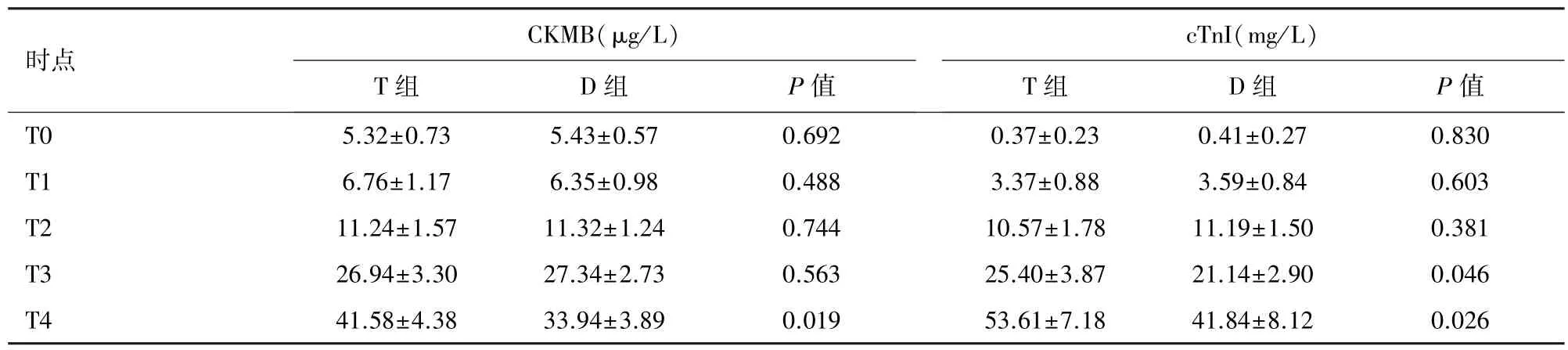
表2 两组样本血清中CKMB 和cTnI 含量变化(n=6,D)
注:CKMB:肌酸激酶同工酶;cTnI:肌钙蛋白I
CKMB(μg/L)cTnI(mg/L)时点T 组 D 组 P 值T 组 D 组 P 值T0 5.32±0.73 5.43±0.57 0.692 0.37±0.23 0.41±0.27 0.830 T1 6.76±1.17 6.35±0.98 0.488 3.37±0.88 3.59±0.84 0.603 T2 11.24±1.57 11.32±1.24 0.744 10.57±1.78 11.19±1.50 0.381 T3 26.94±3.30 27.34±2.73 0.563 25.40±3.87 21.14±2.90 0.046 T4 41.58±4.38 33.94±3.89 0.019 53.61±7.18 41.84±8.12 0.026
2.4 心肌 Mn-SOD、ROS 产生率和 ATP 含量 在 T4时检测心肌 Mn-SOD、ROS 产生率和 ATP 含量,T 组的线粒体 ROS 产生率明显高于 D 组(P<0.001),与T 组相比,D 组中的 Mn-SOD 和 ATP 含量显著升高(P<0.001)。 见表 3。
表3 两组样本心肌Mn-SOD、ROS 产生率和ATP 含量变化(n=6,D)

表3 两组样本心肌Mn-SOD、ROS 产生率和ATP 含量变化(n=6,D)
注:Mn-SOD:锰超氧化物歧化酶;ROS:活性氧
指标 T 组 D 组 P 值Mn-SOD 0.22±0.12 0.76±0.17 <0.001 ROS 产生率 [U/(s·mg)]13.05±2.31 6.95±0.97 <0.001 ATP 含量(nmol/g) 2.66±0.78 7.23±1.02 <0.001
3 讨 论
本研究发现Dex 能减轻CPB 导致的心肌缺血/再灌注损伤,稳定心肌线粒体结构和功能,减少线粒体ROS 产生,增加线粒体ATP 含量,从而减少心肌细胞 I/R 损伤。
前期研究证实Dex 可以保护心肌并调节冠状动脉血流量,Dex 对冠状动脉张力具有调节作用,尤其较低浓度的Dex 的冠状动脉舒张作用可能与内皮完整性,一氧化氮合成和大电导钙激活钾通道激活有关,从而起到心肌保护作用[6]。 然而,遗憾的是CPB下心肌细胞受损严重,那么Dex 能否在实施CPB 的心脏手术中减轻心肌线粒体功能受损? 临床工作中,尽管多种方法能有效改善I/R 损伤,但在接受心脏手术的患者中,死亡率和发病率仍居高不下。
CPB 技术是心脏手术最为有效的辅助手段,但存在快速恢复冠脉缺血区血流量,而再灌注可能会诱发心肌I/R 损伤。 为了证实上述假设,笔者观察健康小型猪实施CPB 中使用Dex 能否减轻心肌I/R损伤,能否上调并稳定心肌线粒体结构和功能,减少线粒体ROS 产生,增加线粒体ATP 含量,从而减轻心肌细胞氧化应激损伤。 研究结果显示:与T 组相比,D 组血清中 CKMB 和 cTnI 降低,心肌细胞超微结构稳定,Mn-SOD 水平升高,线粒体 ATP 含量增加、线粒体ROS 产生率降低,表明CPB 中使用Dex能获得更好的心肌保护效果。
前期研究显示Dex 具有多种器官保护作用,可以保护心肌并调节冠状动脉血流量[6]。 Dex 以剂量依赖性方式降低脑电双频指数值、平均动脉血压、心率、心输出量和混合静脉血氧饱和度[7]。 Dex 减少了胆碱能电场刺激诱导的豚鼠气管收缩和乙酰胆碱释放,同时也减弱了外源性乙酰胆碱引起的收缩和C-纤维介导的收缩,提示Dex 具有直接气道平滑肌作用和抑制咳嗽的潜在机制[8]。 在败血症动物中使用Dex 后,心率降低,平均动脉压降低得到缓解,脓毒症动物的中心静脉压稳定,并改善脓毒症引起的肺功能异常[9]。 但是,大剂量静脉注射 Dex 可引起中度局部冠状动脉血管收缩,而在幼小家猪中没有代谢性心肌缺血迹象,同时在全身循环中出现明显的血管收缩反应[10]。 本结果显示,CPB 中静脉使用小剂量Dex 能明显稳定心肌线粒体超微结构和形态,同时,D 组中 Mn-SOD 水平升高表明,减少心肌I/R 损伤期间ROS 升高引起的心肌组织损伤。
本研究结果表明,CPB 中静脉使用小剂量Dex能发挥良好的心肌保护作用。 然而,本研究存在一定局限性,只观察到Dex 在CPB 心肌保护机制中线粒体功能和形态的变化,而未涉及关键信号通路的作用机制研究。

