外源NO和ABA处理对马铃薯块茎创伤周皮中软木脂积累的影响
张梅花,杨 芳,马 露,宋嘉驰,申亚桐
(云南农业大学农学与生物技术学院,云南 昆明 650201)
【研究意义】马铃薯(SolanumtuberosumL.)是茄科茄属一年生草本植物,具有较强的适应性,且产量较高,富含多种营养物质,可用作多种产品的加工原料,是重要的粮菜兼用及经济性作物之一。全球每年生产马铃薯近4亿t,与小麦、水稻、玉米统称为世界4大粮食作物[1-2]。随着中国马铃薯产业的快速发展,目前中国已成为世界马铃薯第一生产大国,马铃薯种植面积和产量均占世界的 1/4[3],居于首位。马铃薯作为中国重要的粮食作物,分布广,可周年生产,经济效益好,对于保证中国食物安全、促进贫困地区脱贫增收和地区经济振兴崛起意义重大[4]。但是,马铃薯块茎在收获、运输和储藏等过程中均易受到各类机械损伤,若不及时修复,会造成含水量下降,并且为病原的侵染提供了路径,增加感病率,加速马铃薯块茎品质的退化,造成严重的经济损失[5]。因此,如何加速薯块创伤后的愈合成为一个亟待解决的问题。【前人研究进展】块茎损伤或受到外界压力时,损伤细胞会释放多种信号,刺激产生各种保护性或创伤诱导的反应,其中就包括木栓化[6-7]。木栓化的组织能够将薯块内部组织与外界环境隔离开,抑制水分的快速散失和病原菌的进一步侵染。软木脂是块茎创伤后木栓化过程中合成的重要物质。研究发现损伤愈合和受环境胁迫的组织中,如因非生物胁迫和微生物侵染等造成损伤的部位含有大量的软木脂。软木脂是由甘油、脂肪酸与酚类化合物形成的高分子杂聚物,它可以控制水分和溶质的流出,在植物抵抗环境胁迫和病原微生物侵染等胁迫过程中发挥重要作用[8]。硝普酸钠(sodium nitroprusside,SNP)是“自发”的一氧化氮(nitric oxide,NO)供体,在水溶液溶解中就可释放NO。2-(4-羧基苯基)-4,4,5,5,-四甲基-1,3-二氧咪唑啉钾盐(Carboxy-PTIO potassium salt,cPTIO)为NO专用清除剂,广泛用于消除植物中NO的累积。是植物发育和病理生理过程中必不可少的信号分子和调节分子。在植物生长发育过程中,NO在抵御各种生物和非生物胁迫中发挥着不同的生理作用。Pari′s等研究证明NO参与了马铃薯叶片的伤口愈合反应,诱导细胞壁葡聚糖的沉积,并且对创面细胞胼胝质的累积有促进作用,创伤相关基因如苯丙氨酸解氨酶(phenylalanin ammonia-lyase,PAL)、伸展蛋白的表达经SNP处理呈现转录水平上调,增加的NO水平可能增强植物的愈合反应,加快受损组织的恢复[9]。PAL是软木脂形成过程中所需木质素合成的关键酶,其转录水平的上升可能暗示NO与创伤后软木脂的累积有关联。脱落酸(Abscisic acid,ABA)是植物体内重要的激素,它能抑制植物生长发育和细胞分裂、伸长,同时也促进脱落、衰老和休眠,调节气孔开闭,提高植物的抗逆性,是一种重要的胁迫激素[10]。研究表明ABA能提高植物对干旱和高温等非生物胁迫的抗性,它通过调节气孔的开闭以及小分子有机化合物的积累,降低水势,维持较高的渗透压,从而抑制水分的散失[11-13]。Cottle等用ABA处理马铃薯培养细胞发现ABA能使软木脂生物合成过程中软木脂、蜡质的积累增加[14]。此外,ABA 处理能促进块茎愈伤闭合层的形成和愈伤周皮的成熟,木质素和闭合层细胞联接成矩形网状结构,增加细胞壁强度和厚度[15]。【本研究切入点】影响薯块创伤后愈合的因素有很多,主要包括内部因素和外部因素两方面,内部因素包括品种和生理年龄等,外部因素主要包括温度、湿度、创伤程度和外源化学试剂等。由于不同的因素使得块茎创伤愈合的效果和速率及形成软木脂的成分存在较大差异,其中外源NO和ABA具有提高植物抗逆性和形成愈伤的重要作用,但目前有关二者协同原生周皮在调节不同品种马铃薯薯块创伤后软木脂积累方面的研究较少。【拟解决的关键问题】采用2个不同品种的马铃薯来探讨外源NO和ABA以及原生周皮对薯块创伤后软木脂积累的影响,进一步丰富薯块创伤后的愈合机制,同时为加快马铃薯创伤愈合的方法提供理论支撑和数据支持。
1 材料与方法
1.1 材料
供试马铃薯品种“网纹108”和“滇薯47号”(分别以“W108”和“D47”表示)由云南农业大学薯类研究所提供。“W108”薯块椭圆形,薯皮白色,薯肉黄色,薯块表面呈网纹状开裂;“D47”薯块圆形,薯皮白色,薯肉白色,薯块表面光滑。采收时挑选形态、大小一致,薯皮完整,无机械损伤、无病虫害的块茎,装入塑料网袋,每袋约10 kg。采后于常温下放置14 d后储存在2~8 ℃条件下的冷库内。实验前从仓库取出后在常温条件下平衡2 d,再进行后续实验。
1.2 实验方法
将准备好的马铃薯用清水将薯皮洗净,每个品种挑选40个马铃薯,将马铃薯分成两等份,一份去除原周皮,一份保留。后将每个马铃薯用刀平均切成8等份(10~15 g),用纯水将薯块表面游离的淀粉颗粒洗去,以切面为创面。NO和ABA处理浓度均通过前期试验进行筛选。实验共分为5个试剂处理:对照(超纯水,CK);处理1(1 mmol·L-1SNP);处理2(2 mmol·L-1SNP);处理3(0.13 mmol·L-1cPTIO);处理4(0.1 mmol·L-1ABA)。
将切好的马铃薯小块分成5等份分别放入5个处理烧杯中浸泡1 h,每20 min更换一次处理液。处理后用定性滤纸将伤口表面的处理液除去,整齐放在覆盖有保鲜薄膜的磁盘上,放置在温度为22 ℃,相对湿度为90%的恒温恒湿培养箱中进行创伤愈合。在块茎创伤后24、72、120和168 h随机取样,进行切片染色观察。实验共重复3次。
软木脂的积累观察参考LuLai等的方法并修改[16]。每个处理随机选取3个薯块,用不锈钢刀片将愈伤块茎垂直于创面切成厚 0.2~0.3 mm的切片,蒸馏水洗去切片表面的淀粉颗粒,用0.05%的甲苯胺蓝染液染色60 min,染色过程中每10 min轻微震荡一次,以使染色均匀。后分别用75%乙醇和超纯水脱染3次。脱染后再用0.1%中性红染液复染90 s,再用75%乙醇和超纯水分别脱染3次,将脱染后的切片放于载玻片上制成临时水封片,于荧光显微镜(型号:Leica MD 3000)下观察,记录拍照。用软件LAS Version 4.6.2测量有明显荧光的组织厚度(图1)。

A:保留原周皮的块茎创面;B:去除原周皮的块茎创面;C:左为保留原周皮的块茎,右为去除原周皮后的块茎
1.3 数据统计与分析
数据分析采用SAS 9.3计算机程序包(SAS Institute Inc.,Cary,NC)的通用线性模型(GLM)程序进行分析。文中显示的数据均取3个数字的统计平均值,统计显著性为P<0.05。
2 结果与分析
2.1 不同试剂处理对马铃薯块茎创伤周皮中软木脂积累的影响
由表1可知,试剂、处理时间以及二者互作效应对2个品种马铃薯去皮和不去皮薯块软木脂积累均有显著性影响(P<0.05)。
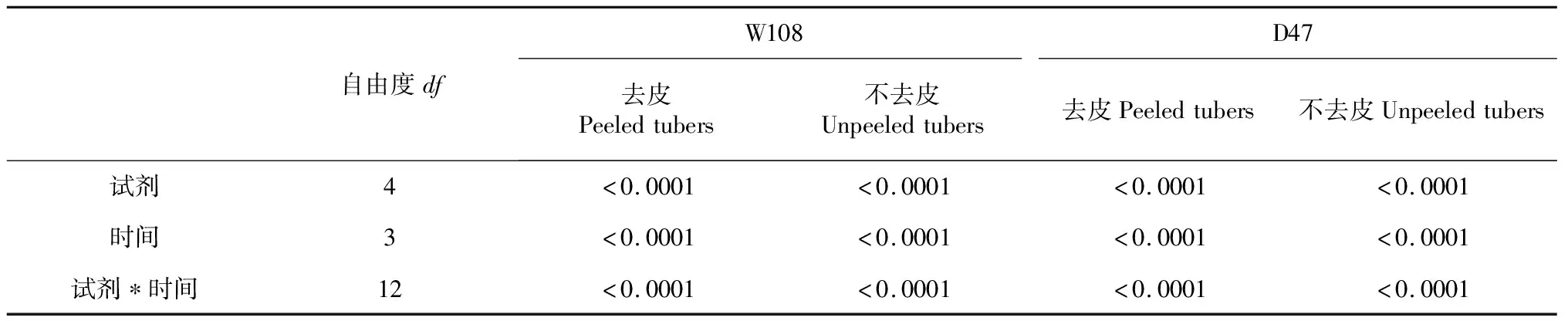
表1 试剂、时间以及二者互作效应对2个品种马铃薯薯块软木脂积累影响的方差分析
由图2可知,马铃薯块茎创伤后24 h时均未观察到软木脂累积,至72 h在块茎创面下约2~3层细胞可观察到软木脂累积,之后各处理的软木脂积累随着时间的延长均呈现整体增加的趋势,总体表现为前72 h快速增加,随后增长减缓。

A:“W108”不去皮薯块软木脂的积累;B:“W108”去皮薯块软木脂的积累;C:“D47”不去皮薯块软木脂的积累;D:“D47”去皮薯块软木脂的积累。图中比例尺为200 μm
2.1.1 不同试剂处理对“W108 ”创伤周皮中软木脂积累的影响 表3-A表明,“W108”不去皮块茎在创伤愈合期间,ABA处理、SNP处理较CK均表现出显著促进软木脂累积,cPTIO处理对块茎软木脂积累具有抑制作用,并在72和168 h较CK表现为显著性抑制作用。ABA处理在创伤后至120 h软木脂累积优与其他处理,后期增长变缓,在168 h软木脂厚度与120 h比较仅增长10.35%,而2 mmol·L-1SNP处理在创伤168 h后软木脂厚度为569.31 μm,与120 h比较增长了45.38%,比同期的ABA处理高6.49%。
表3-C表明,“W108”去皮块茎在创伤愈合期间,ABA和SNP处理较CK均表现出显著促进软木脂累积。ABA处理在120 h软木脂快速累积,在各处理中累积厚度最大(565.893 μm),相比24 h增长142.47%,之后增长幅度变缓,在168 h累积厚度为597.18 μm,比120 h仅增长5.53%;2 mmol·L-1SNP处理始终保持较快的增长,其72 h的软木脂厚度(294.18 μm)在各处理中最高,比ABA处理高26.05%,在创伤168 h,2 mmol·L-1SNP处理软木脂积累最高(639.41 μm)。在创伤愈合期间cPTIO处理软木脂累积最少,在处理前期cPTIO处理值较CK没有显著性差异,但在168 h时表现出显著性抑制。
2.1.2 不同试剂处理对“D47”创伤周皮中软木脂积累的影响 由图3-B可知,“D47”不去皮块茎在创伤愈合期间,ABA处理较快促进软木脂的累积,其72 h的软木脂累积厚度为311.05 μm,比2 mmol·L-1SNP处理高12.98%,较CK高42.88%。2 mmol·L-1SNP处理在创伤72 h后软木脂快速累积,其168 h的软木脂累积厚度为512.47 μm,较同时间ABA处理高6.60%。在处理72~168 h内,2 mmol·L-1SNP和ABA处理较CK呈显著促进作用;1 mmol·L-1SNP处理值较CK高,二者在120~168 h差异显著;创伤期间cPTIO处理的软木脂积累最低,较CK对薯块软木脂积累具有显著的抑制作用。
由图3-D可知,“D47”去皮块茎在创伤愈合期间,ABA处理较快促进软木脂的累积,在72 h软木脂累积厚度为306.73 μm,比2 mmol·L-1SNP处理高20.72%,较CK高68.62%,之后软木脂积累保持缓慢增长,在168 h软木脂增长27.52%。而2 mmol·L-1SNP处理在创伤72 h后软木脂快速累积,在168 h软木脂累积厚度为454.52 μm,高于其余各处理,与72 h相比软木脂增长78.89%。在处理72~168 h期间,SNP和ABA处理较CK呈显著促进作用。在处理168 h后,cPTIO处理的软木脂积累最低,但与CK无显著差异。
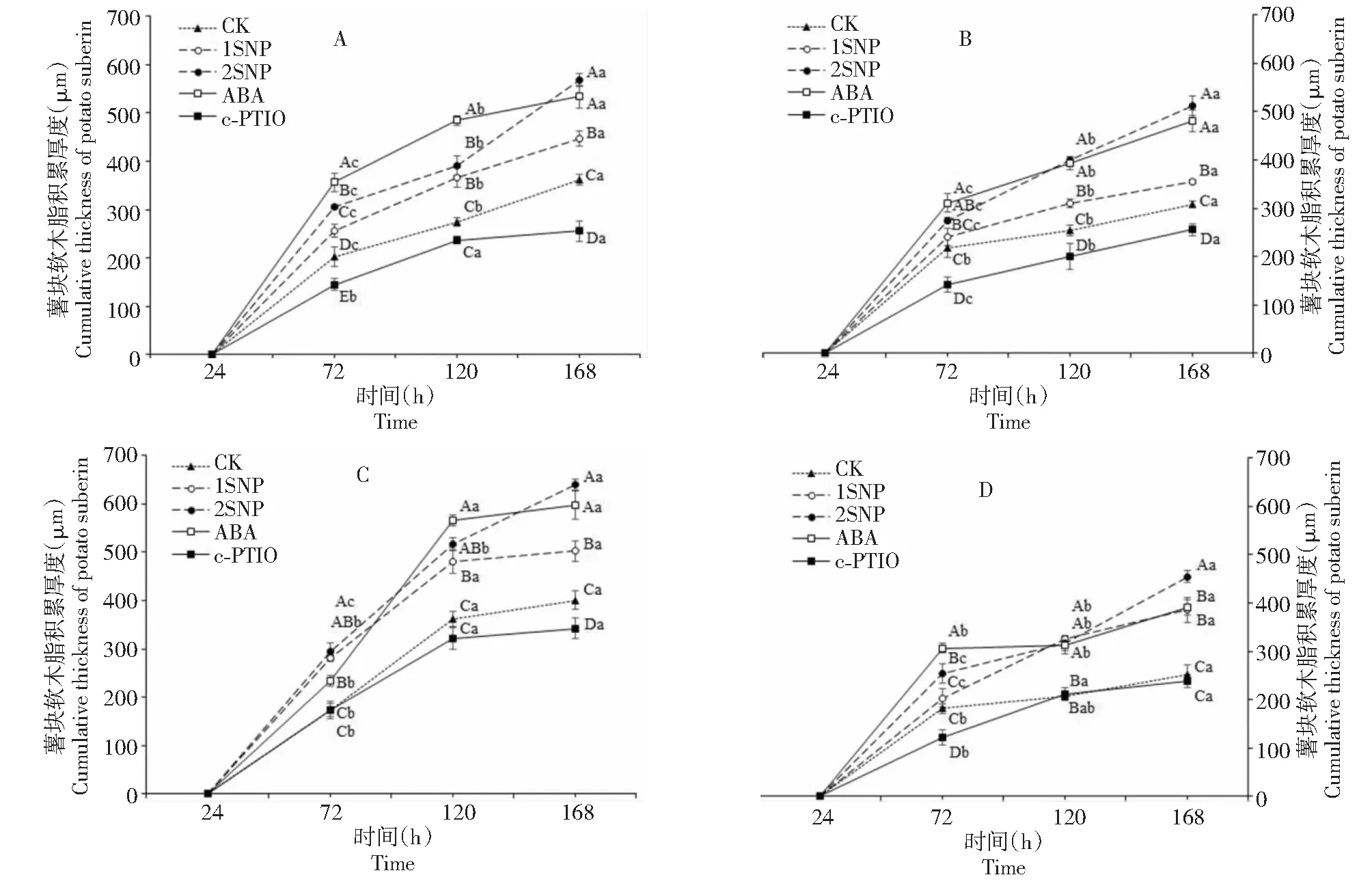
A:“W108”不去皮薯块软木脂的积累厚度;B:“D47”不去皮薯块软木脂的积累厚度;C:“W108”去皮薯块软木脂的积累厚度;D:“D47”去皮薯块软木脂的积累厚度。大写字母表示同一时间不同试剂处理的差异显著性(P<0.05),小写字母表示同一试剂处理下不同时间的差异显著性(P<0.05),误差线为平均值±标准差
2.1.3 不同试剂处理对马铃薯块茎创伤周皮中软木脂积累速率的影响 在24~120 h内,块茎创伤周皮中软木脂累积厚度的增长速率依次为ABA>2 mmol·L-1SNP>1 mmol·L-1SNP>CK>cPTIO,其中24~72 h内增长速率范围为2.53~7.43 μm·h-1,72~120 h内增长速率范围为0.10~6.93 μm·h-1;在120~168 h,整体增长速率依次为2 mmol·L-1SNP>ABA>CK>1 mmol·L-1SNP>cPTIO,增长速率范围为2.54~11.28 μm·h-1。
2.2 马铃薯品种和原生周皮对块茎创伤周皮中软木脂积累的影响
由表2可知,在相同时间、相同试剂和相同去皮处理下,2个品种马铃薯薯块软木脂的累积有显著性差异(P<0.05);在相同时间、相同试剂和相同品种下,去除原周皮对块茎创伤周皮中软木脂的累积有显著影响(P<0.05)。

表2 试剂、时间、品种、去皮、不去皮以及它们互作效应对薯块软木脂积累的方差分析
2.2.1 马铃薯品种对块茎创伤周皮中软木脂积累的影响 图4表明,对不同品种块茎去皮后用相同试剂处理,结果表明1 mmol·L-1SNP,2 mmol·L-1SNP,cPTIO,CK 4种处理下,“W108”的软木脂累积显著高于“D47”,在120 h时差异最大,分别比“D47”高出47.62%,63.45%,52.46%,74.88%;ABA处理后“W108”的软木脂累积在120~168 h内显著高于“D47”,而在72 h时“D47”的累积显著高于“W108”,以120 h差异最大,高出81.56%。
对不同品种的块茎保留原周皮后用相同试剂处理,试验结果表明“W108”的软木脂累积显著高于“D47”。CK处理在72~120 h时2品种软木脂累积无显著差异,在处理168 h时,“W108”的软木脂累积显著高于“D47”,高出17.52%;1 mmol·L-1SNP处理在72 h时2个品种软木脂的累积无显著差异,在120~168 h时“W108”的软木脂累积显著高于“D47”,以168 h时差异最大,高出26.37%;2 mmol·L-1SNP
处理在72和168 h时,“W108”的软木脂累积显著高于“D47”,以168 h差异最大,高出26.37%,在120 h时两品种无显著差异;ABA处理在72~168 h内“W108”的软木脂累积均显著高于“D47”,以120 h时差异最大,高出23.24%;cPTIO处理后,在72和168 h时2个品种软木脂累积均没有显著差异,而在120 h时“W108”的累积极显著高于“D47”,高出17.95%。
2.2.2 原生周皮对块茎创伤周皮中软木脂积累的影响 由图4可知,不同试剂处理 “W108”结果表明,去皮的薯块软木脂累积均显著高于不去皮的薯块。在1 mmol·L-1SNP、2 mmol·L-1SNP、ABA、CK和cPTIO试剂处理后在120 h时差异最大,去皮薯块的软木脂分别比不去皮薯块的软木脂厚度增加31.15%,31.98%;34.81%,32.35%,36.13%;不同试剂处理 “D47”结果表明,CK处理不去皮薯块软木脂的累积均显著高于去皮薯块;2 mmol·L-1SNP和ABA处理,在72 h时去皮和不去皮薯块软木脂累积无显著差异,在120~168 h内不去皮的软木脂累积显著高于去皮薯块,在120 h时差异最大,分别比去皮薯块高出26.54%,26.12%;cPTIO试剂处理后,在72~168 h内去皮和不去皮薯块软木脂累积均无显著差异。

A:CK;B:处理1(1 mmol·L-1 SNP);C:处理2(2 mmol·L-1 SNP);D:处理4(0.1 mmol·L-1 ABA);E:处理3(0.13 mmol·L-1 cPTIO)。字母表示同一培养时间下的显著差异性(P<0.05),误差线为平均值±标准差
3 讨 论
NO在抵抗生物和非生物胁迫中发挥着重要的生理作用。研究表明,NO对马铃薯创伤后软木脂的累积有促进作用,而不同浓度的SNP处理对软木脂累积促进效果不同,无论是累积厚度还是累积速率,2 mmol·L-1SNP效果均较1 mmol·L-1SNP 好。研究中SNP促进块茎创伤周皮中软木脂的快速累积,进而加块伤口愈合,与Pari′s等研究证明NO参与了马铃薯叶片的伤口愈合反应的结论一致[9]。同时,cPTIO处理后软木脂的累积被抑制,进一步印证了NO参与了创伤周皮中软木脂的累积。
ABA是植物体内重要的胁迫激素之一,对植物抗胁迫反应至关重要。研究表明,ABA能显著促进薯块软木脂的累积,Cottle 等[14]和李雪等[15]的研究也有类似结果。2 mmol·L-1SNP和ABA都能促进薯块创伤后软木脂的积累,但2种试剂的响应并不完全一致,ABA在前期(72 h)较好,而2 mmol·L-1SNP是在后期(168 h)响应较高。
NO作为信号分子与ABA调控植物生理生化作用有很多联系,Scuffi等研究证实NO产生受ABA诱导,并作为ABA的下游信号分子诱导调控气孔关闭[17]。Freschi等[18]研究认为在幼小的凤梨中,NO被认为是ABA上调景天酸代谢信号通路中的关键组分。研究中呈现ABA和NO的响应高效时间的不一致,是否与2种试剂的内在偶联有关还有待探讨。
薯块创伤后的愈合能力受多种因素影响,品种差异就是内因之一。不同品种块茎的创伤应激能力不同,Lulai等研究表明黄褐皮基因型比红皮基因型块茎的愈伤周皮成熟快[20]。Baritelle等[19]则认为高比重的块茎有较低的损伤阈值,损伤抗性较低。研究中,2个供试品种在薯块的肉色、原生周皮、抗病性等方面都存在差异,受创后“W108”的软木脂累积显著高于“D47”,说明2个马铃薯品种创伤愈合能力有差异,与前人研究一致。
此外,研究结果表明,软木脂的累积受原周皮的影响,但效应因品种而异,“D47”不去皮的薯块软木脂累积更多,而“W108”去皮的薯块软木脂累积更多。
4 结 论
研究显示外源NO和ABA处理对薯块创伤后软木脂的累积有显著影响,表明外源NO和ABA处理可有效促进马铃薯创伤愈合过程。1 mmol·L-1SNP、2 mmol·L-1SNP和ABA均能促进软木脂的积累,2 mmol·L-1SNP的促进效果较1 mmol·L-1SNP好。不同品种间软木脂的累积存在显著差异,“W108”软木脂的累积显著高于“D47”。另外,去除原周皮对薯块软木脂的累积有影响,但在2个品种中呈现的效应和趋势不一致,在多数情况下,“D47”不去原周皮的薯块软木脂累积更多,而“W108”则去除原周皮的累积更多。
——去皮

