产4-乙烯基愈创木酚细菌的筛选及酚酸脱羧酶基因的克隆与表达
巩园园,毛 豪,晋湘宜,冯向东,陈茂彬,方尚玲*
(1.湖北工业大学 生物工程与食品学院 教育部发酵工程重点实验室,湖北 武汉 430068;2.湖北稻花香酒业股份有限公司,湖北 宜昌 443000)
白酒作为世界六大蒸馏酒之一,其风味物质的种类与不同含量比对白酒的品质有着巨大的影响。与其他国家的蒸馏酒相比,中国白酒的呈香呈味物质量的含量与种类居于首位[1]。白酒作为一种新生代的养生保健食品,频繁被媒体作为热点关注。为了倡导科学养生,健康饮酒,各大酒厂开始挖掘白酒中的功能性风味物质来作为衡量保健效果好坏的指标[2]。
4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)是一种丁香类香味的特殊挥发性成分,具有烘焙香、坚果香以及辛香,感官阈值低,为0.3 mg/L,其不仅是白酒中的主要香味成分之一,也是医药合成中间体,具有健康功能性[3-5]。研究表明,4-VG可以通过阻滞细胞周期和诱导细胞凋亡对癌细胞生长产生抑制作用[6],因此4-VG在食品中的含量及代谢途径备受关注。现有研究报道,4-VG的生物合成法有微生物发酵法、植物细胞培养法和酶法[7]。相较于其他两种,微生物发酵法以其避免使用重金属,有机溶剂以及强酸和强碱,成本低、环保的优势成为近年来生产4-VG的研究趋势。产4-VG的微生物主要有细菌和真菌[8-9]。但是,真菌的代谢途径比较复杂,且生长周期长,成本高,且细菌代谢合成4-VG是最经济的一条途径,因此筛选高产4-VG的细菌是当务之急[10-11]。
细菌产4-VG的主要途径是以阿魏酸为底物,经酚酸脱羧酶将阿魏酸脱羧形成4-VG[12]。酚酸脱羧酶是细菌中产4-VG的关键酶,由于4-VG在工业中巨大的潜在商业价值,酚酸脱羧酶被广泛关注,寻找适用于工业生产的酶资源已成为必然需求[13-14]。但是,由于酶易失活、酶活力受环境变化影响较大,寻找一种酶活较高的酚酸脱羧酶解决4-VG产率低的问题急需解决。
本研究采用传统筛选方法对酒醅中产4-VG细菌筛选,利用形态学和分子生物学进行菌种鉴定,对产4-VG相关的酚酸脱羧酶基因进行克隆与表达,探究酚酸脱羧酶的表达水平,并采用微生物发酵法应用到白酒发酵过程,以期为实现提高白酒中4-VG含量提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
发酵酒醅:湖北某酒厂。
1.1.2 试剂
大肠杆菌(Escherichia coli)感受态细胞DH5α、E.coliBL21(DE3):天根生化试剂有限公司;质粒pMD18-T和ExTaq聚合酶:日本Takara公司;质粒pET28a(+):德国Novagen公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒、质粒提取试剂盒:美国Biomiga公司;限制性内切酶NcoI-HF(20 000 U/mL)、XhoI(20 000 U/mL)、T4 DNA连接酶(400 000 U/mL):美国New England Biolabs公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒:上海碧云天生物技术有限公司;4-VG(色谱级):上海源叶生物技术有限公司;对香豆酸、咖啡酸、芥子酸、阿魏酸、异丙基β-D-半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)(均为分析纯):上海阿拉丁生化科技股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
分离纯化培养基[15]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂粉20 g,蒸馏水1 L。121 ℃高压蒸汽灭菌20 min,使用前加入终质量浓度为25 μg/mL的制霉菌素。
种子培养基[15]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 L。121 ℃高压蒸汽灭菌20 min。
发酵培养基[16]:粗麸皮10 g,蒸馏水20 mL。121 ℃高压蒸汽灭菌20 min。
LB液体培养基[17]:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 L。121 ℃高压蒸汽灭菌20 min。
LB固体培养基:在LB液体培养基中加入琼脂粉15 g。121 ℃高压灭菌20 min。
1.2 仪器与设备
S1000梯度聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:联想生物技术有限公司;JY961N超声波细胞粉碎机:宁波新芝生物科技有限公司;E6156 MiniProGel蛋白制胶与电泳系统:上海碧云天生物技术有限公司;Ulti-Mate 3000高效液相色谱(high performance liquid chromatography,HPLC)仪:赛默飞世尔科技(中国)有限公司;7890B-5977B气相色谱-质谱联用(gaschromatography-massspectrometer,GC-MS)仪:安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 发酵酒醅中菌株的分离纯化
采用无菌生理盐水按10倍梯度稀释酒醅,纱布过滤,取稀释度为10-3~10-6的稀释液100 μL均匀涂布于分离纯化培养基中,37 ℃静置培养24 h,挑取单菌落进行分离纯化[18]。
1.3.2 发酵酒醅中产4-VG菌株的筛选
将分离纯化的菌株接种于种子培养基中,37℃、180r/min条件下培养24 h,以10%(V/V)的接种量接入发酵培养基中,37 ℃、180 r/min条件下发酵7 d,每组做3组平行。取5 g(湿质量)发酵产物加入50 mL蒸馏水,摇匀30 min,1 000 r/min离心10 min。取10 mL上清液于顶空瓶中,加入20 μL乙酸正戊酯(17.104 g/L)作为内标,55 ℃条件下平衡15 min,55 ℃条件下吸附30 min,220 ℃条件下解吸5 min,采用GC-MS检测4-VG含量[19]。
1.3.3 产4-乙烯基愈创木酚菌株的鉴定
形态学鉴定:将筛选得到的菌株接种于分离纯化培养基,37 ℃静置培养18 h,观察菌落形态,挑取单菌落革兰氏染色,采用油镜观察细胞形态[20]。
分子生物学鉴定:将筛选得到的菌株委托华大基因科技有限公司进行16S rRNA基因序列测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)搜索,选取同源性较高的模式菌株的16S rRNA基因序列进行比对,采用MEGA7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 酚酸脱羧酶基因的TA克隆与异源表达
根据NCBI上的酚酸脱羧酶的基因序列设计该基因的特异性引物,上游引物为P(Bs)NcoI(5'-CATGCCATGGCCATGGAAAACTTTATCGGAAGCCACA-3'),下游引物为P(Bs)xhoI(5'-CCGCTCGAGTAATTTTCCCGCGCGAATAT CGTCT-3')。采用细菌DNA试剂盒提取筛选菌株的基因组DNA,以其为模板PCR扩增酚酸脱羧酶基因,PCR扩增体系(25 μL):双蒸水(ddH2O)17.2 μL,10×ExTaqBuffer(Mg2+Plus)2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(10 mmol/L)2.0 μL,引物P(Bs)NcoI和P(Bs)xhoI(20 mmol/L)各1 μL,基因组DNA 1 μL,ExTaq(5 U/μL)0.3 μL。PCR扩增条件:94 ℃预变性1 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。将PCR扩增产物纯化后与pMD18-T载体连接,转染至感受态细胞E.coliDH5-α,然后涂布于LB平板(加1%的100 mg/mL氨苄抗生素),37 ℃条件培养16 h,挑取阳性菌株进行测序。提取克隆成功的菌株的质粒,采用核酸内切酶NcoI-HF、XhoI对该质粒及载体pET-28a分别进行双酶切,酶切产物纯化后进行连接,转染至感受态细胞E.coliBL21,然后涂布于LB平板(加入1%的40 mg/mL硫酸卡那霉素),37 ℃条件培养16 h,挑取单菌落进行测序验证,测序成功的菌株为重组工程菌。将重组工程菌接种于100 mLLB液体培养基(加入1%的40 mg/mL硫酸卡那霉素)中,37 ℃、180 r/min条件下扩大培养至OD600nm值为0.8时,添加100 μL IPTG(浓度为500 mmol/L),在20 ℃、180 r/min诱导表达16 h[21]。
1.3.5 4-乙烯基愈创木酚含量的测定
采用GC-MS检测4-VG含量。
气相色谱条件:DB-WAx色谱柱(30 m×0.25 mm×0.25 μm);进样口温度280 ℃;升温程序为初始柱温65 ℃,保持3min,以5℃/min升温至150 ℃,保持2 min,再以10℃/min升温至280 ℃,保持4 min;载气为高纯氦气(He)(纯度≥99.999%),流速0.8 mL/min;进样方式为分流进样,分流比20∶1;进样量为1 μL。
质谱条件:电离方式为电子电离(electron ionization,EI)源;全扫描模式,质量范围45~400 amu;电子能量70 eV;离子源温度230 ℃;四级杆温度150 ℃;溶剂延迟时间3 min。
定性分析:采用美国国家标准技术研究所(NIST)谱库检索,对发酵产物进行定性分析。
定量分析:以乙酸正戊酯(34.74 μg/mL)为内标,采用内标法定量。
1.3.6 酚酸脱羧酶酶活的测定
取50 mL诱导表达后的菌液在8 000 r/min条件下离心5 min,弃上清,加入10 mL 50 mmol/L Tris-HCl(pH 7.0)摇匀,70%功率超声破壁15 min,离心取上清,得到粗酶液,将粗酶液进行镍柱纯化。
取50 mmol/L阿魏酸为底物,进行酶活力的测定。反应体系:Na2HPO4-柠檬酸缓冲液(pH 5.0)0.8 mL,50 mmol/L阿魏酸0.1 mL,酶液0.1 mL;反应条件:37 ℃水浴反应5 min后加2 mL甲醇终止反应。空白对照为Na2HPO4-柠檬酸缓冲液(pH 6.0)0.9 mL,50 mmol/L阿魏酸0.1 mL[22]。
采用HPLC测定酶液中4-VG的含量。HPLC色谱条件:HypersilGOLD C18色谱柱(3 μm,4.6 mm×250 mm)。流动相为甲醇∶0.1%乙酸=60∶40(V/V),流速1.0 mL/min,柱温30 ℃,进样量20μL,检测波长280 nm[14]。根据4-VG的生成量计算酚酸脱羧酶酶活,其计算公式如下:

式中:e为所加酶液的量,mL;x为4-VG含量,mmol/L;v为酶促反应体系的最终体积,mL;t为酶促反应时间,min。
酚酸脱羧酶酶活定义:每分钟生产1 μmol 4-VG所需要的酶量为1个单位酶活力(IU/mL)。
1.3.7 酚酸脱羧酶分子质量的测定
参照王勋等[23]的方法采用镍柱亲和层析纯化重组菌发酵液,纯化的酶液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,测定酚酸脱羧酶的分子质量。
2 结果与分析
2.1 产4-乙烯基愈创木酚菌株的分离及筛选
从发酵酒醅中共分离纯化出23株细菌,其中5株细菌产4-VG,4-VG产量见表1。

表1 5株菌株的4-乙烯基愈创木酚产量Table 1 4-vinylguaiacol yield of 5 strains
由表1可知,菌株NF1的4-VG产量最高,达到0.301 mg/g,高于王少磊等[24]从中高温大曲中筛选到的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的4-乙基愈创木酚产量(32.89 μg/g)。故将菌株NF1作为目的菌株进行形态学观察及分子生物学鉴定。
2.2 菌株NF1的鉴定
2.2.1 形态学观察
菌株NF1的菌落及细胞形态见图1。
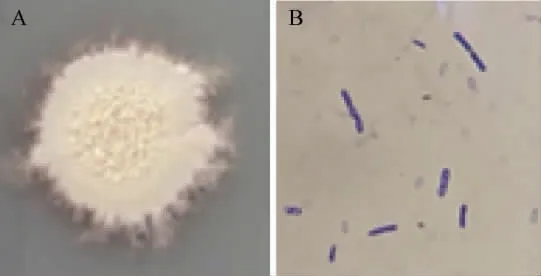
图1 菌株NF1的菌落(A)及细胞(B)形态Fig.1 Colony (A) and cell (B) morphology of strain NF1
由图1可知,菌株NF1的菌落表面粗糙不透明,呈污白色,外形不规则,外圈毛糙,内有褶皱。在显微镜下观察,细胞无荚膜,呈长杆状,周边有芽孢,芽孢呈椭圆或柱状,革兰氏染色为紫色,故为革兰氏阳性菌。因此,初步鉴定该菌株为芽孢杆菌属(Bacillussp.)。
2.2.2 分子生物学鉴定
由图2可知,菌株NF1与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近,因此,鉴定菌株NF1为枯草芽孢杆菌(Bacillus subtilis)。
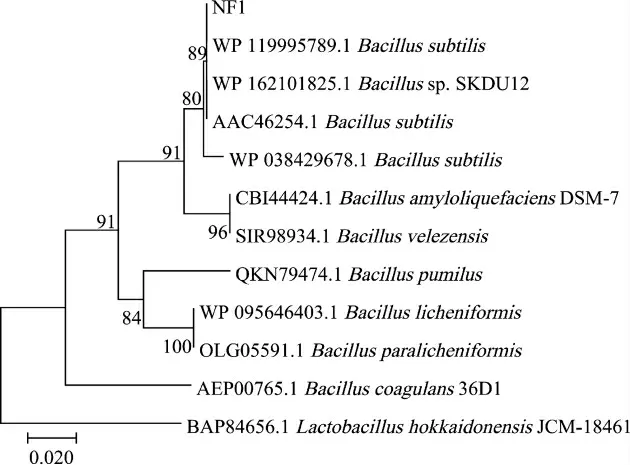
图2 基于16S rRNA基因序列菌株NF1的系统发育树Fig.2 Phylogenetic tree of strain NF1 based on 16S rDNA gene sequences
2.3 酚酸脱羧酶基因的克隆及表达
2.3.1 酚酸脱羧酶基因的PCR扩增
以NF1基因组DNA为模板,利用设计的引物进行PCR扩增,将PCR扩增产物进行琼脂糖凝胶电泳,结果见图3。由图3可知,目的基因片段碱基长度为483 bp,与预期结果相符,共编码161个氨基酸。
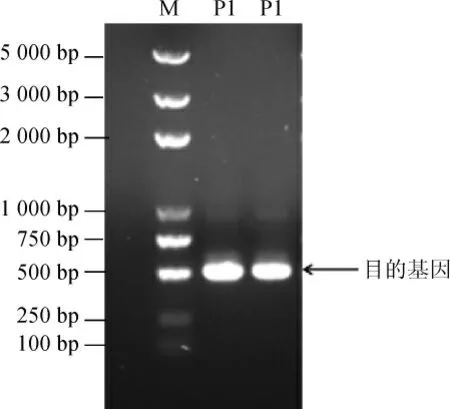
图3 目的基因的琼脂糖凝胶电泳分析结果Fig.3 Results of agarose gel electrophoresis analysis of the target gene
2.3.2 酚酸脱羧酶酶活及分子质量测定
采用HPLC 测定纯化后的发酵液的4-VG 含量为11.123 mmol/L,通过计算得到酚酸脱羧酶酶活力为66.741 IU/mL。采用SDS-PAGE测定酚酸脱羧酶的分子质量,结果见图4。
由图4可知,与pET28a空载相比,重组蛋白成功表达,其蛋白分子质量大小约为20 kDa。该结果与文献报道的解淀粉芽孢杆菌[14]、地衣芽孢杆菌[22]、短小芽孢杆菌[25]、植物乳杆菌[26]中的酚酸脱羧酶的分子质量大小是一致的。

图4 重组蛋白的SDS-PAGE结果Fig.4 SDS-PAGE results of recombinant protein
3 结论
本研究从发酵酒醅中筛选出一株高产4-乙烯基愈创木酚的细菌NF1,其4-VG产量为0.301 mg/g。通过形态观察及分子生物学技术鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis)。从该菌株中成功克隆得到酚酸脱羧酶基因,并在大肠杆菌(Escherichia coli)表达系统中进行诱导表达,以50 mmol/L的阿魏酸为底物时,酚酸脱羧酶酶活力为66.741 IU/mL,经SDS-PAGE检测,该酶的分子质量约为20 kDa。本研究通过掌握产特殊风味物质的功能菌,以期对白酒中的特定风味物质的含量及比例进行调控,进而提升白酒的风味物质。对产特定风味物质的关键酶进行探究,为未来酶的开发及利用提供一定的参考依据,旨在解决酶产率低、不耐高温等劣势。

