甘蔗组培苗2种污染细菌的分离与鉴定
刘红坚 李松 何为中 刘俊仙 刘丽敏 卢曼曼 游建华 黄诚华 林善海


摘 要:细菌污染是甘蔗组培苗生产上的一个主要问题。为明确甘蔗组培中常出现的污染细菌的种类,本研究通过梯度稀释的方法分离污染细菌,结合生化特性、16S rRNA和phaC基因序列比对及系统发育分析鉴定其分类地位。结果表明,共分离获得2种不同类型污染细菌,除了甘露醇,其余9个生化指标完全一致。基因序列比对发现,2种类型分离物的种内2个基因序列完全一致,而种间16S rRNA序列只有2个碱基差异,种间phaC序列有23个碱基差异。2个基因序列构建的系统发育树显示,2种细菌遗传距离较近,并均能形成独立的2个分支。结合生化特征、序列比对及系统发育树,将2种污染细菌分别鉴定为巨大芽孢杆菌(Bacillus megaterium)和阿氏芽孢杆菌(B. aryabhattai),且首次报道阿氏芽孢杆菌为甘蔗组织培养中的污染细菌。本研究揭示了巨大芽孢杆菌可能来源于甘蔗的内生菌,而阿氏芽孢杆菌来源于环境。
关键词:甘蔗;组培苗;污染细菌;芽孢杆菌;系统发育树
Abstract: Contamination is a main issue in sugarcane tissue culture. The purpose of this study was to determine the contaminative bacteria frequently occurred during the production of sugarcane tissue culture. The gradient dilution method was used to isolate bacteria, and the toxonomic position was identified combining the biochemical, sequence alignment of 16S rDNA and phaC genes, phylogeomic analysis. The results showed that two type contaminative bacteria were obtained from the sugarcane tissue culture nutrient solution, and nine tested biochemical characters were the same between the two bacteria except mannitol utilization. Sequence alignment showed that intraspecific sequences of 16S rDNA and phaC genes were completely uniformity respectively in the two bacteria, but the difference of the two nucleotide bases in 16S rDNA and 23 in phaC sequences existed between the two bacteria. The phylogenic tree constructed based on 16S rDNA and phaC genes sequences respectively also indicated that the two bacteria were closest each other and clustered into two absolutely independent branches. Combining the biochemical characters, sequence alignment and phylogenetic analysis, the two contaminative bacteria were identified as Bacillus megaterium and B. aryabhattai, respectively. This is the first report of B. aryabhattai as the contaminative bacterium in sugarcane tissue culture. This study revealed that B. megaterium probably came from endophyte and B. aryabhattai from environment.
Keywords: sugarcane; tissue culture seedling; contaminative bacterium; Bacillus; phylogenetic tree
甘蔗(Saccharum officinarum L.)是热带和亚热带气候种植的重要经济作物之一,占全球产糖量的80%左右。甘蔗在广西农业、工业作物中占据了极其重要的位置。许多工业和工厂都依赖于甘蔗及其副产品提供的原材料。它被认为是将太阳能转化为有价值且可应用的化学能的主要作物之一,如蔗糖和生物质。甘蔗主要通过种茎进行无性繁殖,但长年无性繁殖容易引起线虫、真菌、细菌和病毒等引起的系统性病害,导致种性退化、产量损失[1-2]。组织培养技术因为种苗质量在遗传变异方面保持稳定,可得到无病害植株,生产时间相对较短,土地需求量低,加速植物繁殖等優点而成为甘蔗繁殖的最佳方法[3-5]。
微生物污染是影响甘蔗体外培养的主要障碍。污染的主要来源是植物组织上的内生和附生微生物、培养基中的空气污染物、组织培养工作中处理不良的污染物等[6]。因此,对甘蔗污染的微生物进行分离、鉴定,是进一步提高组织培养快速繁殖的重要基础。在植物组织培养中,污染菌主要包括真菌、细菌和酵母三大类,而细菌引起的污染最严重。前人已经报道了很多污染植物组培苗的细菌,其中假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、葡萄球菌属(Staphylococcus)和乳酸菌属(Lactobacillus)等多个属的细菌污染频率最高[7-8]。目前已报道的甘蔗组培苗污染细菌有人苍白杆菌(Ochrobactrum anthropi)、蜡样芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(B. mega terium)、短小芽孢杆菌(B. pumillus)、枯草芽孢杆菌(B. subtilis)、嗜麦芽黄单胞菌(Xanthomonas maltophilia)、唐菖蒲伯克霍尔德菌(Burkholderia gladioli)以及肠杆菌科(Enterobacteriacea)的一些种[9-12]。近年来,随着甘蔗种植良种化、标准化进程的推进,甘蔗健康种苗需求量不断上升。而细菌污染是影响组培苗工厂化生产最主要的限制因素之一。组培苗的污染微生物种类主要与环境有较大的关联[6],国外对组培苗污染微生物已开展了很多研究,但国内鲜有报道,主要集中在组培苗污染的防控方面。因此,有必要对甘蔗组培苗生产过程中常见的污染细菌种类进行分离鉴定。从实验室生产组培苗过程各个环节中收集常见的细菌污染样本,通过分离、纯化,并进行生理生化及分子鉴定,为后期制定合理的防控措施提供科学依据。
1 材料与方法
1.1 污染材料
在实验室生产的‘桂糖44号‘桂糖46号‘桂糖47号‘桂糖48号等4个品种甘蔗组培苗中挑选培养基浑浊的样本,观察和记录污染症状、颜色及类型。为了排除单一污染源的影响,从组培室中收集了不同接种时间、不同操作人员、不同超净台的各种污染形态的培养物,根据污染的颜色、组培苗的大小分成三大组,每组10瓶培养物。再根据相同污染颜色、不同时期各选取3瓶,分为A组和B组。
1.2 污染菌株分离
通过对腐烂组织块及培养基进行研磨处理,把样品均质化,保证污染的组培物表面及内部的污染菌都会得到分离培养。通过梯度稀释,采用划线单菌落的方法进行分离纯化。以每瓶为1个样本,在超净台中各取少量组培苗组织于2 mL无菌EP管中,用快速组织冷冻研磨仪(JXFSTPRP-CL,上海净信实业发展有限公司)对组织块进行低速研磨,得到均质组织后,加入1 mL灭菌水,振荡混匀,混合液稀释103倍,各取10 μL涂布LA培养基平板(8 g NaCl,8 g胰蛋白胨,4 g酵母提取物,12 g琼脂,1 L dH2O),每个样本涂布3个平板,于28 ℃倒置培养。挑取形态不同的单菌落于新的LA培养基平板中划线培养,经3次以上分离纯化最终得到纯化菌株。
1.3 生化鉴定
挑取每个分离物平板上的单菌落至2 mL无菌生理盐水的试管中,用移液器混匀菌落制成菌悬液,然后往生化鉴定条中每孔加入100 μL的菌悬液,36 ℃培养24~72 h。根据每种生化鉴定的特点,进行判断每个菌株的生化分解能力。采用生化鉴定管(青岛海博)鉴定的10种生化指标包括硝酸盐利用能力、淀粉水解能力、西蒙氏柠檬酸盐利用能力、葡萄糖蛋白胨分解能力(MR-VP)、葡萄糖利用能力、甘露醇利用能力、溶菌酶实验、动力实验、明胶水解能力、过氧化氢分解能力。具体操作方法见产品说明书。
1.4 DNA提取
挑取分离纯化后的单菌落,接种于LB液体培养基(8 g NaCl,8 g胰蛋白胨,4 g酵母提取物,1 L dH2O)中,37 ℃震荡培养至OD600=2.0。取1 mL菌液,8000 r/min离心1 min,去除上清培养基,加入1 mL无菌水进行洗涤,8000 r/min离心1 min,去除上清得到菌体。使用博日科技细菌基因组DNA提取试剂盒(Biospin, #BSC12S1)按照说明书进行菌株基因组DNA提取。琼脂糖核酸电泳进行所得基因组DNA完整度检测,NanoDrop ND-2000超微量核酸蛋白测定仪(美国NanoDrop公司)检测OD260/280后进行评估DNA纯度检测。
1.5 16S rRNA基因鉴定
16S rRNA基因扩增引物为:27F: 5-GAGTTT GATCCTGGCTCAG-3和1492R: 5-GTTACCTTG TTACGACTT-3[13]。PCR反应条件为:94 ℃变性5 min,94 ℃ 30 s、65 ℃ 30 s、72 ℃ 30 s扩增30个循环,72 ℃延伸5 min。预期的PCR产物片段长度为1 465 bp。通过1.0%浓度的琼脂糖核酸电泳检测后,使用ABI Genetic Analyzer 3730xl(Applied Biosystems)进行Sanger测序(南宁国拓生物科技有限公司)。获得的序列使用Vector NTI 11.0软件(Invitrogen)进行Assemble拼接,所得的Contigs序列采用BLAST软件(https://blast. ncbi.nlm.nih.gov/Blast.cgi)进行比对分析。
1.6 phaC基因PCR擴增与测序
phaC基因扩增引物为BmphaC015F: 5-CGT GCAAGAGTGGGAAAAAT-3和BmphaC931R: 5- TCGCAATATGATCACGGCTA-3[14],反应条件为:94 ℃变性5 min,94 ℃ 1 min、63.9 ℃ 1 min、72 ℃ 2 min 扩增30个循环,72 ℃延伸5 min。预期的PCR产物片段长度为0.9 kb,通过1.0%浓度的琼脂糖核酸电泳检测后,进行克隆双向Sanger测序。
1.7 进化分析
用于进化分析的序列包括经测序所得菌株的16S rRNA和phaC基因序列,其他用于建树的序列均来自美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的GenBank数据库(https://www.ncbi.nlm.nih.gov/)。使用CLUSTALW软件进行序列比对,使用Mega ediors对序列进行编辑。使用MEGA 4.0软件,采用NJ(Neighbor Joining)和ME(Minimum Evolution)算法,分别构建16S rRNA和phaC基因序列系统发育树。其中,自展值(Bootstrap值)选择为1000,检验所计算的进化树分支可信度。
2 结果与分析
2.1 污染症状及菌落形态
被细菌污染的组培苗培养液浑浊,组培苗生长受到不同程度影响,污染轻的造成组培苗生长羸弱,叶片黄绿色,先长出来的叶片发黄、腐烂,污染严重的直接造成愈伤组织或组培苗死亡。从污染培养液看,2种菌均呈浅橘红色,A组污染的颜色较浅,菌液较为透明些,有棉絮状的菌苔形成(图1A);而B组污染的颜色较深,菌液均匀,无棉絮状菌苔形成(图1B);健康的组培苗培养液清澈,组培苗或愈伤组织生长良好,叶片浓绿(图1C)。在稀释涂布的平板中,2种菌株的菌落均呈圆形、突起、表面光滑、有光泽、粘稠,在表型上均非常相似,形态上无明显差异(图1D,图1E)。
2.2 分离菌株生化鉴定
单株分离A组获得17株细菌,B组获得5株细菌。从A组和B组分别挑取3株作为代表菌株用于生化指标测定及后续的分子鉴定。从测试的10种生化指标分析结果发现,从甘蔗污染组培苗中分离的A、B 2组菌株,其组内各菌株的生化指标完全一致。A组的甘露醇均为阳性,而B组菌株均为阴性,其余9个生化指标完全相同,说明这些菌株相似度很高(表1)。从生化特征初步判断A组菌株为巨大芽孢杆菌(B. megaterium),B组菌株为阿氏芽孢杆菌(B. aryabhattai)。
2.3 分子鉴定及序列分析
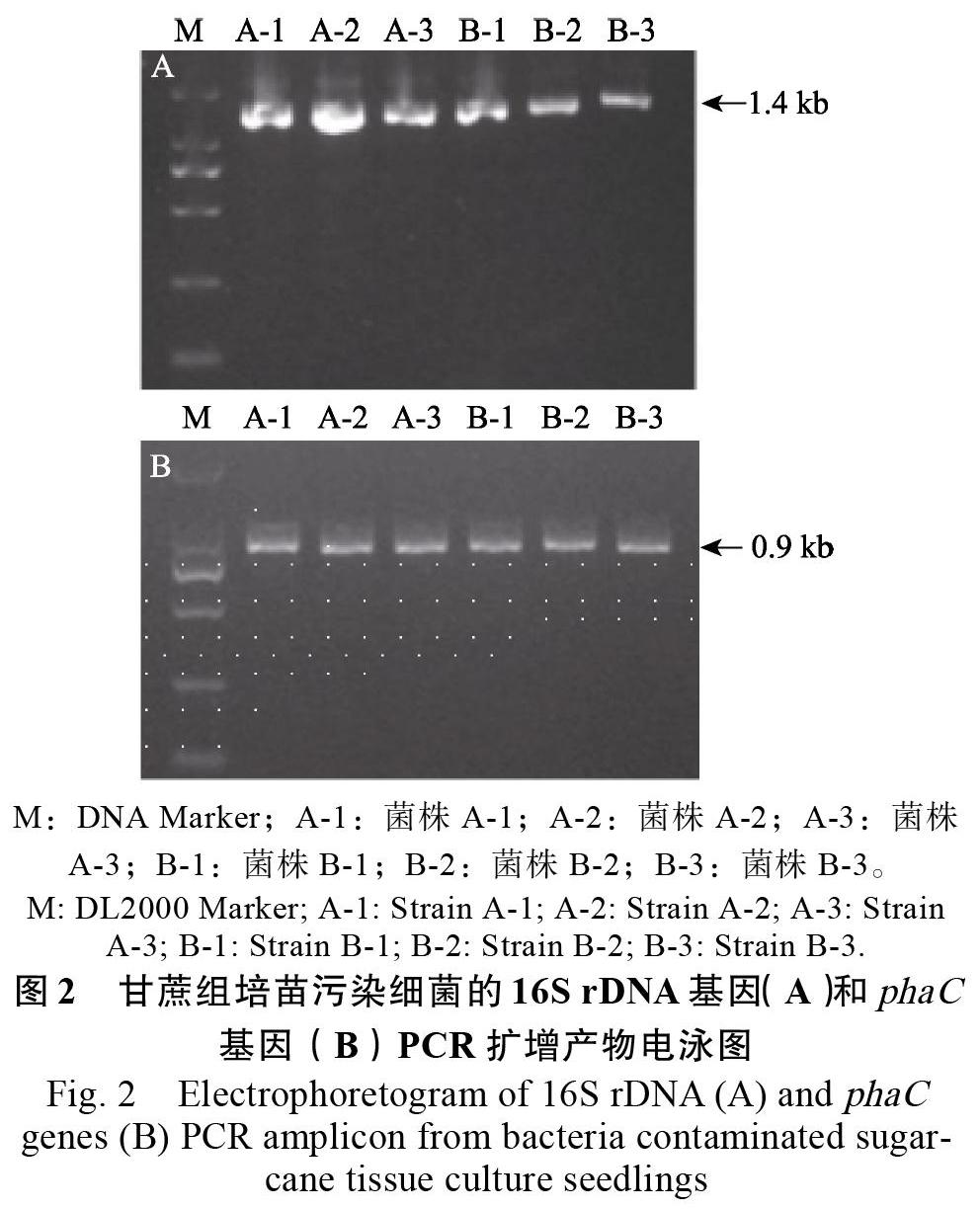
6株菌株经16S rDNA序列PCR扩增所得片段约为1.4 kb(图2A),phaC基因PCR扩增获得片段约0.9 kb(图2B)。将测序获得的序列进行了BLAST比对分析(https://blast.ncbi.nlm.nih.gov/Blast. cgi)。比对结果显示,6个菌株均与B. megaterium、B. aryabhattai具有较高的同源性。A组菌株的16S rDNA序列与B. megaterium KNU-01(CP041066)相似度最高(100%);B组菌株的16S rDNA序列与B. aryabhattai S22(MN062621)相似度最高(100%)。而A组菌株的phaC序列与B. megaterium SF4(KY855378)相似度最高(99%);B组菌株的phaC序列与B. aryabhattai KNU10(CP041519)相似度最高(99%)。
将6个菌株序列进一步比对分析显示,6个菌株的16S rDNA基因片段同一个组内的菌株序列完全一致,只在904 bp和1007 bp的2个碱基上有差异,其中A组菌株分别为A和T,而B组菌株为G和C(图3)。6个菌株的phaC基因片段同一个组内的菌株序列也完全一致,但A组和B组之间出现23个碱基的差异(图4),说明2组菌株之间在phaC基因序列上的遗传关系差异较为显著。将6个菌株登记在GenBank数据库,分别获得A1、A2、A3、B1、B2、B3菌株的16S rDNA序列登记号为MT026568、MT026569、MT026570、MT026571、MT026572、MT026573,phaC基因的登记号为MT052024、MT0520245、MT052026、MT052027、MT052028、MT052029。
2.4 遗传分析
为了进一步区分2组菌株的遗传关系,分别用16S rDNA和phaC基因序列构建了系统发育树。进化树使用NJ法(Neighbor-joining),自展值(Bootstrap值)为1 000。在以16S rDNA序列构建的系统发育树中,芽孢杆菌属(Bacillus)的所有菌株与其他属的细菌明显形成不同的分支,A组菌株与巨大芽孢杆菌(B. megaterium)形成一个独立的分支,B组菌株与阿氏芽孢杆菌(B. aryabhattai)形成一个独立的分支,2个种具有较为相近的遗传关系(图5)。A、B 2组菌株的分类地位在以phaC基因序列构建的系统发育树与16S rDNA序列构建的系统发育树具有较高的一致性,A组菌株与巨大芽孢杆菌(B. megaterium)形成一个独立的分支,B组菌株与阿氏芽孢杆菌(B. aryabhattai)形成一个独立的分支(图6)。2个基因片段分别构建的系统发育树的一致性进一步证明了2种甘蔗组培苗污染细菌的分类地位。
3 讨论
甘蔗组培苗污染细菌种类方面的报道较少,Klayraung等[9]利用间歇浸没式方法(temporary immersion bioreactor system, TIBS)研究了甘蔗和水稻组培苗的污染细菌情况,结果表明不同植物种类、不同容器大小的细菌数量、种群均不一样。其中使用20 L的TIBS容器时甘蔗的污染细菌为解淀粉芽孢杆菌(Bacillus amyloliquifaciens)、短小芽孢杆菌(B. pumilus)和枯草芽孢杆菌(B. subtilis),但使用70 L的TIBS容器时,污染细菌为甲基营养细菌(Methylobacterium sp.)、类芽孢杆菌(Paenibacillus sp.)和鞘氨醇单胞菌属(Sphingomonas sp.)。而Moutia等[10]采用蔗芽经过表面消毒后培养获得了13个污染细菌菌株,分别为4个芽孢杆菌属(Bacillus)菌株(B. cereus、B. megaterium、B. pumilus和B. subtilis)、7个肠杆菌科(Enterobacteriaceae)、嗜麦芽黄单胞菌(Xanthomonas maltophilia)和唐菖蒲伯克霍尔德菌(Burkholderia gladioli)。Yelenys等[11]也首次报道了人苍白杆菌(Ochrobactrum anthropi)为甘蔗组培苗的污染细菌。目前除了甘蔗组培苗,未见巨大芽孢杆菌(B. megaterium)在任何植物的组培苗上有污染的报道,也未见阿氏芽孢杆菌(B. aryabhattai)在任何植物組培苗有污染的报道。
芽孢杆菌是组培苗污染菌中最常见的一类细菌,除了环境,植物内生菌是主要的来源。巨大芽孢杆菌是甘蔗等多种植物中常见的内生细菌,且部分菌株对甘蔗[10]、南苜蓿[15]、巴拉圭茶[16]和麻疯树[17]等植物的生长具有促进作用。而已报道的阿氏芽孢杆菌主要来源于植物的根际土壤[18-20]。目前,尚无阿氏芽孢杆菌作为甘蔗内生菌的报道。说明甘蔗组培苗污染细菌中巨大芽孢杆菌很有可能是来源于甘蔗的内生菌,而阿氏芽孢杆菌来源于环境。
生理生化特征是鉴定细菌种属的一个重要手段。尽管巨大芽孢杆菌和阿氏芽孢杆菌2个种进化关系上较为相近,但也存在磷酸酶、脂酶、甲基红、V-P测定、甘露醇产酸、苯丙氨酸脱氨酶、脲酶和精氨酸脱氢酶等生理生化特性的差异[21-23]。但也有研究表明这2个种的脂酶、甲基红、V-P等生化指标存在差异[21, 22, 24],且同一个种内的不同菌株也有一些指标上的差异[14]。因此,即使同一个种,由于来源不同而具有丰富的遗传多样性。本研究对6个测试菌株开展了10个重要的生化指标测定,虽然未检测脂酶、甲基红2个指标,但其余指标的结果与前人[23]的报道基本一致。此外,脂肪酸组成和基因组DNA的G+C含量与模式菌株的比较也可作为鉴别2个种的一个分类手段[21, 22, 25]。
巨大芽孢杆菌和阿氏芽孢杆菌是细胞形态上非常相近、通过BLAST同源性比对以及构建系统发育树也较难区分的2个种[26]。本研究结果显示,从16S rDNA和phaC基因序列的进化树分析,A组和B组菌株均被聚集到了同一个簇中,并与芽孢杆菌属其他种明显分开,也说明了巨大芽孢杆菌和阿氏芽孢杆菌之间的进化关系较近。但是2个基因序列分别构建的系统发育树均能使2个种分开并形成独立的分支,证明2个种虽然遗传距离较近,但还是存在差异。Rao等[21]通过对巨大芽孢杆菌(DSM 32T)和阿氏芽孢杆菌(DSM 21047T)2个菌株形态学、生化指标、基因组系统发育树及全基因组分析,均具有较高的一致性,并建议将阿氏芽孢杆菌重新分类为巨大芽孢杆菌的异名种。尽管如此,2个菌株在碱性磷酸酶、亮氨酸酰胺酶、缬氨酸胺酶、胱氨酸芳胺酶、胰蛋白酶等多个表型性状上却是相反的。说明2个种虽然具有较为相近的遗传性状,但还是存在多方面的差异特性。本研究结果表明,2种细菌的16S rDNA基因序列仅有2个碱基的差异,通过BLAST比对分析,2个基因片段均与2个菌的同源性较高。为了进一步在种的层面上鉴定这些分离物,我们用更具有碱基分辨率的phaC基因进行这些分离菌株的进化分析,目前PHA合酶C(phaC)基因被广泛应用于鉴定芽孢杆菌属内种[14, 27, 28]。从phaC基因序列比对结果显示,2种细菌种内碱基序列分别具有高度的一致性,而种间碱基序列则具有23个碱基的差异。说明phaC基因能较好地区分这2个种。
参考文献
Dobrzanski T, Gravina F, Steckling B, et al. Bacillus megaterium strains derived from water and soil exhibit differential responses to the herbicide mesotrione[J]. PLoS One, 2018, 13(4): e0196166.
刘丽敏, 李 松, 戴友铭, 等. 甘蔗茎尖脱毒培养技术研究[J]. 中国糖料, 2009(2): 18-20.
Suriyan C, Nguyen T T H, Chalermpol K. Disease-free production of sugarcane varieties (Saccharum officinarum L.) using in vitro meristem culture[J]. Biotechnology, 2006, 5(4): 443-448.
李 松, 刘红坚, 刘 欣, 等. 甘蔗開放式组织培养快繁技术研究[J]. 湖南农业科学, 2016(9): 1-3.
李 松, 余坤兴, 刘丽敏, 等. 甘蔗茎尖胚状体脱毒苗快繁技术研究[J]. 中国糖料, 2010(4): 1-5, 8.
Reed B M, Tanprasert P. Detection and control of bacterial contaminants of plant tissue cultures: A review of recent literature[J]. Plant Tissue Culture and Biotechnology, 1995, 1(3): 137-142.
Leifert C, Cassells A C. Microbial hazards in plant tissue and cell cultures[J]. In Vitro Cellular & Developmental Biology - Plant, 2001, 37(2): 133-138.
Orlikowska T, Nowak K, Reed B. Bacteria in the plant tissue culture environment[J]. Plant Cell, Tissue and Organ Culture, 2017, 128(3): 487-508.
Klayraung S, Niamsup P, Poonnoy P, et al. Diversity and control of bacterial contamination of plants propagated in temporary immersion bioreactor system[J]. Acta Horticulturae, 2017, 1155: 439-445.
Moutia M, Dookun A. Evaluation of surface sterilization and hot water treatment on bacterial contaminants in bud culture of sugarcane[J]. Experimental Agriculture, 1999, 35: 265-274.
Yelenys A C, Nayanci P G, Leyanis G A, et al. Ochrobactrum anthropi, contaminants of in vitro culture of sugarcane cells and tissues[J]. Biotecnologia Vegetal, 2007, 7(4): 211-214.
周俊辉, 周厚高, 刘花全. 植物组织培养中的内生细菌污染问题[J]. 广西植物, 2003, 23(1): 41-47.
Frank J A, Reich C I, Sharma S, et al. Critical evaluation of two primers commonly used for amplification of bacterial 16S rRNA genes[J]. Applied Environmental Microbiology, 2008, 74(8): 2461-2470.
Nayak P K, Mohanty A K, Gaonkar T, et al. Rapid identification of polyhydroxyalkanoate accumulating members of Bacillales using internal primers for phaC gene of Bacillus megateriu[J]. ISRN Bacteriology, 2013, doi: 10.1155/ 2013/562014.
Chinnaswamy A, Pena T C, Stoll A, et al. A nodule endophytic Bacillus megaterium strain isolated from Medicago polymorpha enhance growth, promotes nodulation by Ensifer medicae and alleviates salt stress in alfalfa plants[J]. Annals of Applied Biology, 2018, 172: 295-308.
Grunennvaldt R, Degenhardt-Goldbach J, Tomasi JC, et al. Bacillus megaterium: an endophytic bacteria from callus of Ilex paraguariensis with growth promotion activities[J]. Biotecnologia Vegetal, 2018, 18(1): 3-13.
Sousa L P, Silva M J. Differential growth of Jatropha curcas L. by different strains of endophytic Bacillus sp.[J]. International Research Journal of Agricultural Science and Soil Science, 2012, 2(8): 306-311.
Park Y G, Mun B G, Kang S M, et al. Bacillus aryabhattai SRB02 tolerates oxidative and nitrosative stress and promotes the growth of soybean by modulating the production of phytohormones[J]. PLoS One, 2017, 12(3): e0173203.
Ray S, Datta R, Bhadra P, et al. From space to earth: Bacillus aryabhattai found in the Indian subcontinent[J]. Bioscience Discovery, 2012, 3(1): 138-145.
鄧 超, 杜秀娟, 黄 涛, 等. 碳氮比对固氮菌株WN-F合成胞外多糖的影响[J]. 生物技术通报, 2018, 34(3): 194-199.
Rao M P N, Dong Z Y, Liu G H, et al. Reclassification of Bacillus aryabhattai Shivaji et al. 2009 as a later heterotypic synonym of Bacillus megaterium de Bary 1884 (Approved Lists 1980)[J]. FEMS Microbiology Letter, 2019, 366(22), DOI: 10.1093/femsle/fnz258.
Shivaji S, Chaturvedi P, Begum Z, et al. Janibacter hoylei sp. Nov., Bacillus isrnonensis sp. Nov. and Bacillus aryabhattai sp. Nov., isolated from cryotubes used for collecting air from the upper atmosphere[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(12): 2977-2986.
易浪波, 彭清忠, 何齐庄, 等. 高效钾长石分解菌株的筛选、鉴定及解钾活性研究[J]. 中国微生态杂志, 2012, 24(9): 773-776, 785.
Bhutani N, Maheshwari R, Negi M, et al. Optimization of IAA production by endophytic Bacillus spp. from Vigna radiata for their potential used as plant growth promoters[J]. Israel Journal of Plant Sciences, 2018, 65(1): 83-96.
冯 玮, 张 蕾, 宣慧娟, 等. 西藏土壤中耐辐射阿氏芽胞杆菌T61的分离和鉴定[J]. 微生物学通报, 2016, 43(3): 488-494.
Jooste M, Roets F, Midgley G F, et al. Nitrogen-fixing bacteria and oxalis-evidence for a vertically inherited bacterial symbiosis[J]. BMC Plant Biology, 2019, 19(1): 441.
Berekaa M M, Genotypic detection of polyhydroxyalkanoate-producing Bacilli and characterization of phaC synthase of Bacillus sp. SW1-2[J]. Life Science Journal, 2012, 9(4): 518-527.
P?rn?nen K, Karkman A, Virta M, et al Discovery of bacterial polyhydroxyalkanoate synthase (phaC) - encoding genes from seasonal Baltic Sea ice and cold estuarine waters[J]. Extremophiles, 2015, 19(1): 197-206.
责任编辑:谢龙莲

