Th1/Th2平衡对寒凝血瘀证原发性痛经大鼠血清PG、COX⁃2、AVP及OT的影响
翟凤婷,王东梅,马 青,曹卫平,王丹丹,李广文
(1.山东中医药大学附属医院,山东 济南 2 50014;2.山东中医药大学,山东 济南 2 50355)
原发性痛经(primary dysmenorrhea,PD)是指伴随月经发生的周期性下腹疼痛而无生殖器官器质性病变的疾病,严重者可导致晕厥等症状,是最常见的妇科疼痛性疾病。反复发作的经期疼痛可导致中枢神经系统敏感化,增加远期其他慢性疼痛性疾病的易感性,并使患者丧失信心,容易引发焦虑、烦躁、抑郁等负面情绪。长期严重的PD,可导致经血逆流,增加子宫内膜异位症的发生率,进而导致不孕症的发生[1,2]。据统计,不同国家原发性痛经的患病率在45%~90%之间[3-5],国内PD的发生率在40%~80%之间[6]。在美国,因PD造成的经济损失每年高达20亿美元[7,8],在瑞典,50%的女性会因痛经每年缺勤至少1次,造成23万个工作日损失[9,10]。由此可见,PD给全球带来了巨大的经济损失。目前治疗PD的一线药物为非甾体类抗炎药,其主要作用为即时止痛,缺乏远期疗效,究其原因与PD的发病机制未完全明确有关。因此,探讨PD的发病机制具有重要意义。目前研究已证实,PD患者存在免疫功能异常。笔者前期研究亦证实,寒凝血瘀证PD大鼠模型中存在Th1/Th2平衡偏移现象[11,12],本研究基于内分泌-免疫系统之间的关系,探讨Th1/Th2失衡在寒凝血瘀证PD发病中的作用,进一步揭示PD的发病机制。
1 材料与方法
1.1 实验动物及饲养条件
成熟雌性Wistar大鼠32只,未交配,体重200~220 g,7~8周龄,购于济南朋悦实验动物繁育有限公司,动物合格证号:SCXK(鲁)20190003。实验大鼠饲养于山东中医药大学附属医院实验室动物中心,室温23℃~25℃,相对湿度50%~60%,日光灯光照,明暗各12 h交替,自由摄食、饮水。实验方案已通过山东中医药大学附属医院动物伦理委员会审核(伦理批件号:AWE-2019-011)。
1.2 实验药物
苯甲酸雌二醇注射液(宁波第二激素厂生产,规格:2 mL∶4 mg,批号:181214);缩宫素注射液(马鞍山丰原制药有限公司生产,规格:1 mL∶5 IU/支,批号:180912-1);细胞因子Rat IL-4(PeproTech,规格:20μg/包,批号:0310111);细胞因子Rat IFN-γ(PeproTech,规格:20μg/包,批号:0316109)。
1.3 主要试剂及仪器设备
大鼠脾脏淋巴细胞分离液试剂盒(Biolegend,200 mL/kit)、Cell Activation Cocktail(with Brefeldin A)(Biolegend,100μL)、APC anti-rat CD4 Antibody(Biolegend,50μg 250μL)、FITC anti-rat IFN-gamma Antibody(Biolegend,100 tests 500μL 5μL/test)、PE anti-rat IL-4 Antibody(Biolegend,25μg 125μL)、Intracellular Fixation Buffer(Invitrogen,125 mL)、Permeabilization Buffer 10X(Invitrogen,100 mL),大鼠血清前列腺素F2α(prostaglandin F2α,PGF2α)、前 列 腺 素E2(prostaglandin E2,PGE2)、6-酮-前 列 腺 素F1α(6-Keto-Prostaglandin F1α,6-Keto-PGF1α)、血 栓 素B2(thromboxane B2,TXB2)、环氧合酶-2(cyclooxygenase-2,COX-2)、血管加压素(arginine vasopressin,AVP)及缩宫素(oxytocin,OT)ELISA试剂盒(江苏晶美生物科技有限公司,96T)。流式细胞仪(美国Beckman coulter公司,Epics XL型),酶标仪(芬兰Labsystems Multiskan MS公司,352型)。
1.4 实验方法
1.4.1 动物分组方法 所有大鼠适应性饲养1周后,按随机数字表法随机分为空白对照组、模型对照组、Th1偏移组和Th2偏移组,每组各8只,分别用苦味酸标记。
1.4.2 各组大鼠模型建立方法及造模成功指标
寒凝血瘀证PD大鼠模型:采用寒冷刺激联合苯甲酸雌二醇以及缩宫素建立。除空白组外,其余各组大鼠每日固定时间置于冰块上20 min,1次/d,连续12 d,同时,每天给予大鼠皮下注射苯甲酸雌二醇注射液0.4 mg/只,第1天和第12天各0.8 mg/只,末次注射苯甲酸雌二醇1 h后腹腔注射缩宫素2 IU/只。
Th1偏移组:自寒凝血瘀证PD大鼠造模第7天起,腹腔注射Rat IFN-γ(2μg/mL),1 mL/次,1次/d,连续6 d;空白组及模型组大鼠同时间腹腔注射生理盐水,1 mL/次,每日1次,连续6 d。
Th2偏移组:自寒凝血瘀证PD大鼠造模第7天起,腹腔注射Rat IL-4(200 ng/mL),1 mL/次,1次/d,连续6 d。
1.4.3 指标检测 注射缩宫素后,观察各组大鼠扭体反应潜伏时间及30 min内扭体次数。末次给药1 h后,腹腔注射10%水合氯醛0.3 mL/100 g麻醉,腹主动脉取血,注入促凝管颠倒混匀,静置30 min后分离血清。肉眼观察大鼠脾脏,摘取大鼠脾脏组织。流式细胞术法检测各组大鼠脾脏Th1细胞、Th2细胞比例,ELISA法检测各组大鼠血清中PGF2α、PGE2、6-Keto-PGF1α、TXB2、COX-2、AVP及OT含量。
1.5 统计学处理
采用SPSS 25.0统计软件进行数据处理,统计资料以均数±标准差(±s)表示,当数据满足正态性和方差齐性时,组间比较采用单因素方差分析,否则,组间比较采用秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠脾脏Th1/Th2细胞比值
图 中P4(APC anti-rat CD4、FITC anti-rat IFN-γ抗体标记)为Th1细胞,P3(APC anti-rat CD4、PE anti-rat IL-4抗体标记)为Th2细胞。Th1细胞所占比例与Th2细胞所占比例做比值比较,由高到低分别为空白组、Th1偏移组、模型组、Th2偏移组。与空白组比较,各组大鼠Th1/Th2细胞比值降低,差异具有统计学意义(P<0.01);与模型组比较,Th1偏移组Th1/Th2细胞比值升高,Th2偏移组Th1/Th2细胞比值降低,差异均具有统计学意义(P<0.01)。证实造模成功。见图1及表1。
表1 各组大鼠脾脏Th1/Th2细胞比值(n=8,±s)Tab 1 The ratio of Th1/Th2 cells in spleen of rats in each group(n=8,±s)
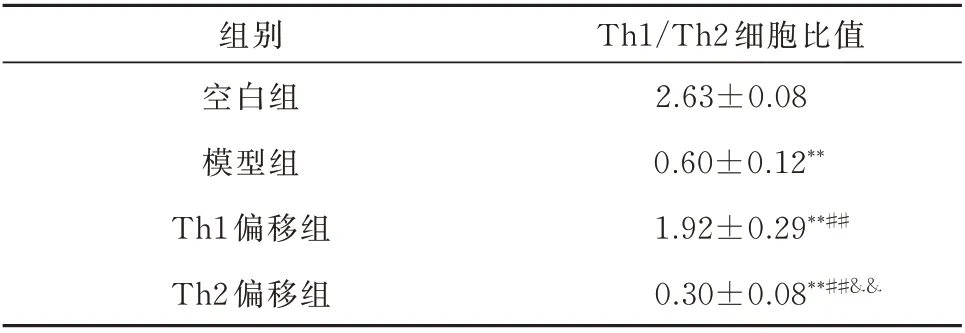
表1 各组大鼠脾脏Th1/Th2细胞比值(n=8,±s)Tab 1 The ratio of Th1/Th2 cells in spleen of rats in each group(n=8,±s)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与Th1偏移组比较,&&P<0.01。
组别空白组模型组Th1偏移组Th2偏移组Th1/Th2细胞比值2.63±0.08 0.60±0.12**1.92±0.29**##0.30±0.08**##&&
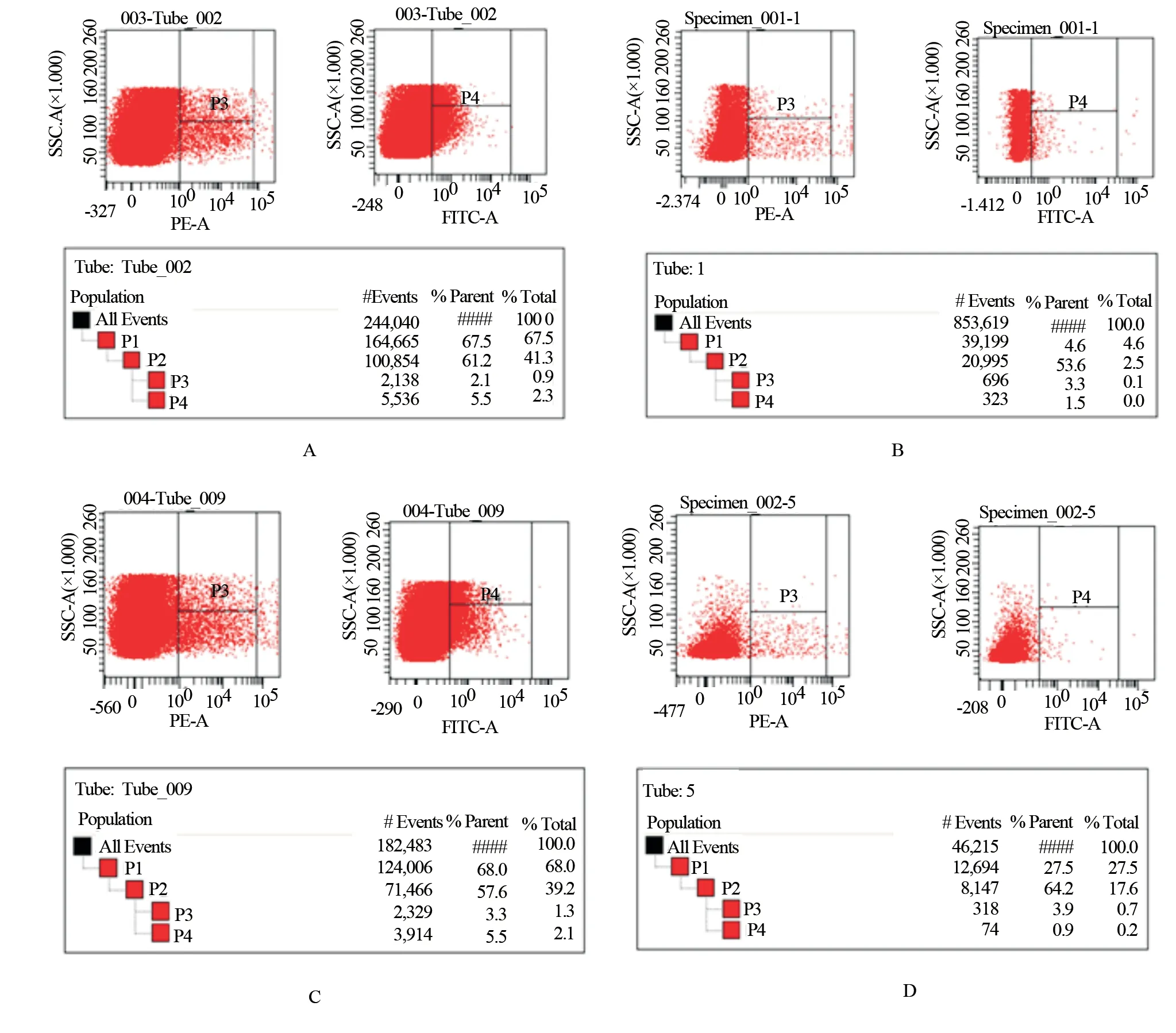
图1 各组大鼠脾脏Th1/Th2细胞比值Fig 1 The ratio of Th1/Th2 cells in spleen of r ats in each gr oup
2.2 各组扭体潜伏时间及扭体次数比较
Th1、Th2偏移组扭体潜伏时间与模型组比较,差异均无统计学意义(P>0.05);Th2偏移组较Th1偏移组扭体潜伏时间缩短,差异具有统计学意义(P<0.05)。
与模型组比较,Th1偏移组30 min内扭体次数明显减少,而Th2偏移组30 min内扭体次数明显增加,差异具有统计学意义(P<0.01)。见表2。
表2 各组大鼠扭体潜伏时间及扭体次数比较(n=8,±s)Tab 2 Comparison of writhing latency and writhing times of rats in each group(n=8,±s)
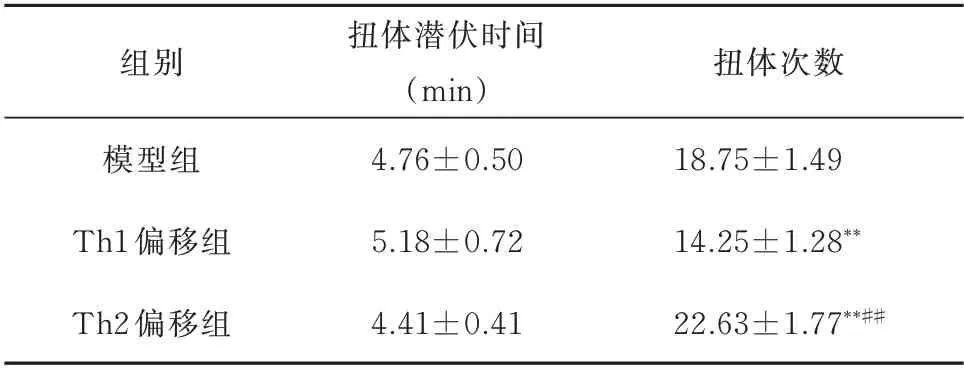
表2 各组大鼠扭体潜伏时间及扭体次数比较(n=8,±s)Tab 2 Comparison of writhing latency and writhing times of rats in each group(n=8,±s)
注:与模型组比较,**P<0.01;与Th1偏移组比较,##P<0.01。
组别模型组Th1偏移组Th2偏移组扭体潜伏时间(min)4.76±0.50 5.18±0.72 4.41±0.41扭体次数18.75±1.49 14.25±1.28**22.63±1.77**##
2.3 各组PGF 2α、PGE 2、6-Keto-PGF 1α、TXB2含量比较
与空白组比较,各组PGF2α、TXB2含量均升高,差异具有统计学意义(P<0.01);与模型组比较,Th1偏移组PGF2α、TXB2含量均降低,而Th2偏移组PGF2α、TXB2含量均升高,差异均具有统计学意义(P<0.05);与Th1偏 移 组 比 较,Th2偏 移 组PGF2α、TXB2含量均升高,差异具有统计学意义(P<0.01)。
与空白组比较,各组PGE2、6-Keto-PGF1α含量均降低,差异具有统计学意义(P<0.01);与模型组比较,Th1偏移组PGE2、6-Keto-PGF1α含量升高,而Th2偏移组PGE2、6-Keto-PGF1α含量降低,差异均具有统计学意义(P<0.01);与Th1偏移组比较,Th2偏移组PGE2、6-Keto-PGF1α含量降低,差异具有统计学意义(P<0.01)。见表3。
表3 各组大鼠PGF2α、PGE2、6⁃Keto⁃PGF1α、TXB2含量比较(n=8,±s)Tab 3 Comparison of the contents of PGF 2α、PGE2、6⁃Keto⁃PGF1αand TXB2 of rats in each group(n=8,±s)

表3 各组大鼠PGF2α、PGE2、6⁃Keto⁃PGF1α、TXB2含量比较(n=8,±s)Tab 3 Comparison of the contents of PGF 2α、PGE2、6⁃Keto⁃PGF1αand TXB2 of rats in each group(n=8,±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与Th1偏移组比较,&&P<0.01。
组别空白组模型组Th1偏移组Th2偏移组PGF 2α(ng/L)223.72±8.44 267.21±17.01**253.27±11.40**#349.20±3.05**##&&PGE2(ng/L)559.69±16.77 464.71±19.16**496.20±18.11**##324.20±12.64**##&&6-Keto-PGF 1α(ng/mL)112.20±2.28 83.51±5.05**95.99±3.48**##73.28±2.67**##&&TXB2(ng/L)316.99±12.45 390.00±10.90**376.96±4.98**#476.89±8.05**##&&
2.4 各组COX-2、AVP、OT含量比较
与空白组比较,各组COX-2、AVP、OT含量均升高,差异具有统计学意义(P<0.05)。与模型组比较,Th1偏移组COX-2、AVP含量降低,差异具有统计学意义(P<0.05);OT含量亦降低,但差异无统计学意义(P=0.056)。与模型组比较,Th2偏移组含量均升高,差异具有统计学意义(P<0.01)。与Th1偏移组比较,Th2偏移组各指标含量均升高,差异具有统计学意义(P<0.01)。见表4。
表4 各组大鼠COX⁃2、AVP、OT含量比较(ng/L,n=8,±s)Tab 4 Comparison of the contents of COX⁃2、AVP and OT of rats in each group(ng/L,n=8,±s)
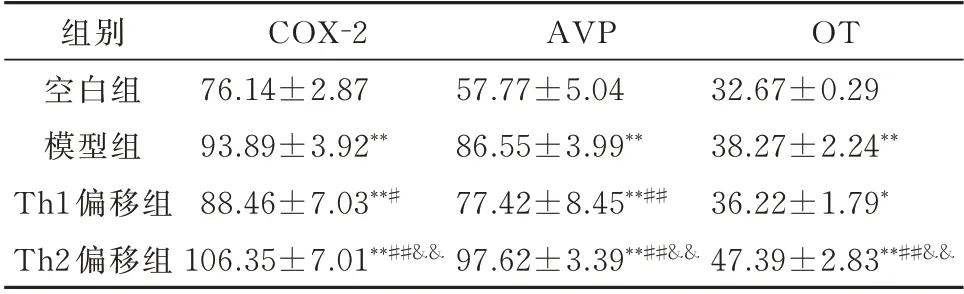
表4 各组大鼠COX⁃2、AVP、OT含量比较(ng/L,n=8,±s)Tab 4 Comparison of the contents of COX⁃2、AVP and OT of rats in each group(ng/L,n=8,±s)
组别空白组模型组Th1偏移组Th2偏移组COX-2 76.14±2.87 93.89±3.92**88.46±7.03**#106.35±7.01**##&&AVP 57.77±5.04 86.55±3.99**77.42±8.45**##97.62±3.39**##&&OT 32.67±0.29 38.27±2.24**36.22±1.79*47.39±2.83**##&&
3 讨论
PD是妇科常见病。中医学认为,PD的发生主要在于邪气内伏或精血素亏,更值经期前后冲任二脉气血的生理变化急骤,导致胞宫的气血运行不畅,“不通则痛”;或冲任、胞宫失于濡养,“不荣则痛”。临床常见证型有:气滞血瘀证、寒凝血瘀证、湿热蕴结证、肾气亏损证及气血虚弱证。现代流行病学调查研究显示,寒凝血瘀证在PD的中医证型分布中所占比例最高[13]。基于数据挖掘分析王东梅教授治疗PD的中药配伍规律,结果表明治疗药物以甘温、辛温为主,常用方剂组合以少腹逐瘀汤为主,主要发挥温经散寒、活血止痛之功,进一步验证了寒凝血瘀证在PD中所占比例最高[14]。《诸病源候论》云:“妇人月水来腹痛者,由劳伤气血,以致体虚,受风冷之气客于胞络,损冲、任之脉……其经血虚,受风冷,故月水将来之际,血气动于风冷,风冷与血气相击,故令痛也”的论述,提出痛经的产生是由寒凝胞宫而致。寒凝血瘀证中,寒凝为本,血瘀为标。患者久居寒凉之地,或贪凉饮冷,经期不注重保暖,寒克于胞宫、冲任,经血凝结,且经前、经期气血下注冲任,子宫气血更加壅滞,导致“不通则痛”;或患者身体素虚,阴寒内生,冲任二脉及胞宫失于温煦,难以鼓动血脉运行,血滞而成瘀,进而发展为痛经[15]。由此可见,寒凝血瘀导致的“不通则痛”是PD的主要病机。
西医学关于PD的发病机制存在多种学说,但目前公认PD的发生主要与子宫内膜前列腺素有关。其中,PGF2α含量升高引起子宫痉挛性收缩,局部缺血缺氧而出现痛经,而PGE2能够抑制子宫平滑肌的自发收缩。笔者前期研究亦证实,PD大鼠模型PGF2α/PGE2比值升高[16]。另外,非妊娠子宫肌层还能够合成具有血管活性的前列腺素,包括血栓 素A 2(thromboxane A 2,TXA2)和PGI2。其 中TXA2能够收缩血管、促进血小板聚集,而PGI2能够抗血小板聚集、舒张血管。但TXA 2及PGI2在体内很不稳定,因此目前实验多测定其相对稳定的代谢产物TXB2和6-Keto-PGF1α含量来反映二者的代谢情况[17]。COX-2是一种催化花生四烯酸转化为PGs的关键酶,可以导致子宫痉挛性收缩,从而引发PD[18]。AVP作为加重PD相关因子,一方面能够通过作用于子宫上的相应的受体,使子宫收缩加剧及肌肉运动,导致子宫血量减少,引起PD;另一方面,AVP亦能够促进PGs合成,并增加子宫对缩宫药物的敏感度,引起PD[19]。OT又名“催产素”,主要作用于子宫的平滑肌,使其兴奋,致使子宫收缩加速,激活磷酸,调节某一部分细胞的PGs含量,从而加重PD[20]。本研究结果显示,寒凝血瘀证PD大鼠模型PGF2α及TXB2含量均升高,6-Keto-PGF1α及PGE2含量降低,且寒凝血瘀证PD大鼠模型存在COX-2、AVP及OT含量的升高。
除上述内分泌因素外,目前已有研究证实,PD患者存在免疫功能异常,内分泌-免疫网络失调是PD的发病原因之一[13]。在Th细胞中,Th1细胞及Th2细胞是最为经典的两个亚群。Th1细胞主要分泌IL-2、γ-干扰素(interferon-gamma,IFN-γ)等细胞因子,介导细胞毒素和炎症反应;Th2细胞主要分泌IL-4、IL-10等调节性细胞因子,参与体液免疫应答及诱导免疫耐受。Th1细胞分泌的IFN-γ可促进Th1亚群的分化,但却抑制Th2亚群的增殖。反之,Th2细胞分泌的IL-4可促进Th2亚群的分化,但却抑制Th1细胞的活化。生理状态下,Th1和Th2细胞处于动态平衡,维持机体正常的免疫功能;当机体受到异己抗原攻击或机体内部免疫平衡发生异常时,可导致Th1/Th2平衡失调,表现为Th2过度表达,Th1/Th2平衡向Th2偏移。笔者前期研究发现寒凝血瘀证PD模型大鼠较正常大鼠子宫组织上清液中IFN-γ水平明显降低,而IL-4水平显著升高,证实寒凝血瘀证PD大鼠存在Th1/Th2平衡失调[12,13]。
本研究结果表明,与模型组比较,Th1偏移组PD大鼠PGF2α、TXB2、COX-2及AVP含量均降低,OT差异虽无统计学意义,但其含量亦成下降趋势,不排除与造模时腹腔注射缩宫素有关,6-Keto-PGF1α、PGE2含量升高;而Th2偏移组PD大鼠PGF2α、TXB2、COX-2、AVP及OT含量均升高,6-Keto-PGF1α、PGE2含 量 降 低。说 明Th1细 胞、Th2细 胞 能 够 调 节PGF2α/PGE2、TXB2/6-Keto-PGF1α比值及COX-2、AVP、OT含量。进一步证实了Th1/Th2平衡偏移在寒凝血瘀证PD发病中的作用。
作者贡献度说明:
翟凤婷:动物实验的操作及数据分析,文章的写作;王东梅:项目(山东省自然科学基金)负责人,负责整个科研项目的设计,对文章进行审校;马青、王丹丹:参与实验实施;曹卫平:参与数据整理与分析;李广文:进行理论指导。

