筋膜导向腹腔镜直肠癌根治术的临床效果分析*
易小江,刁德昌,廖伟林,汪佳豪,李洪明,卢新泉,冯晓创,陈昭宇
广东省中医院(广州中医药大学第二附属医院)结直肠外科 广东广州510120
遵循全直肠系膜切除术(total mesorectal excision,TME)原则的腹腔镜直肠癌根治术技术已趋于成熟和规范,手术步骤也已标准化[1]。但是目前关于直肠周围筋膜结构的认识仍存在一定争议,如肠系膜下动脉根部直肠系膜的切除范围、直肠后方和前方手术操作的正确间隙、直肠前方Denonvilliers筋膜的保留问题和直肠侧方韧带离断时侧方盆丛神经的保护。如何通过手术更好地提高肿瘤根治效果和更好地保护患者术后性功能和排尿功能,需要术者对直肠周围筋膜和神经的解剖关系进行进一步探索,以寻找更佳的腹腔镜直肠癌根治手术方法。
与传统层面导向腹腔镜直肠癌根治术比较,筋膜导向手术方法在以下技术要点方面进行改进:(1)完全显露并根部离断直肠系膜;(2)直肠后方间隙沿直肠固有筋膜和腹下神经前筋膜之间间隙进行游离,对腹下神经进行结构上和功能上的完全保护;(3)在精囊腺中部或底部打开Denonvilliers筋膜进入直肠固有筋膜与Denonvilliers筋膜之间间隙进行游离;(4)紧贴直肠固有筋膜离断直肠侧方韧带,保护神经血管束和盆丛神经。
本文回顾性分析广东省中医院2017年1月1日至2019年12月31日行腹腔镜直肠癌根治术的147例患者的临床资料,比较筋膜导向与传统层面导向腹腔镜直肠癌根治术的临床疗效差异,现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性分析广东省中医院2017年1月1日至2019年12月31日行腹腔镜直肠癌根治术的147例患者的临床资料,根据手术方式的不同,分为筋膜导向组(n=77)和层面导向组(n=70)。所有患者中男性82例,女性65例;年龄31~85岁,平均为(61.5±12.3)岁。两组性别、年龄、BMI、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、合并基础疾病情况、既往腹部手术史、术前血红蛋白、白蛋白、癌胚抗原(carcinoembryonic antigen,CEA)、CA19-9(carbohydrate antigen 19-9,CA19-9)和甲胎蛋白(alpha fetoprotein,AFP)水平等一般资料比较差异均无统计学意义(均P>0.05),具有可比性,见表1。
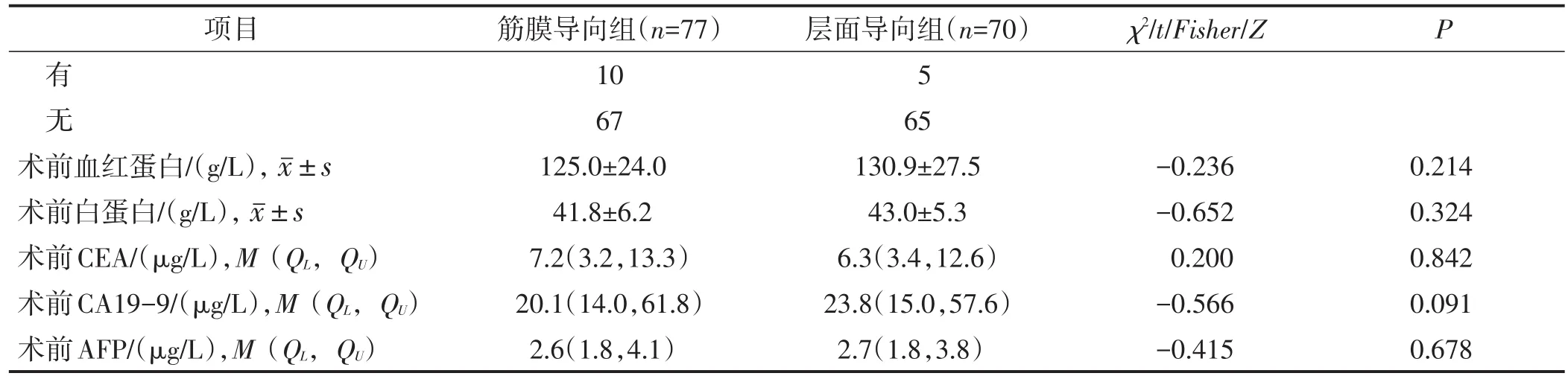
表1 (续)
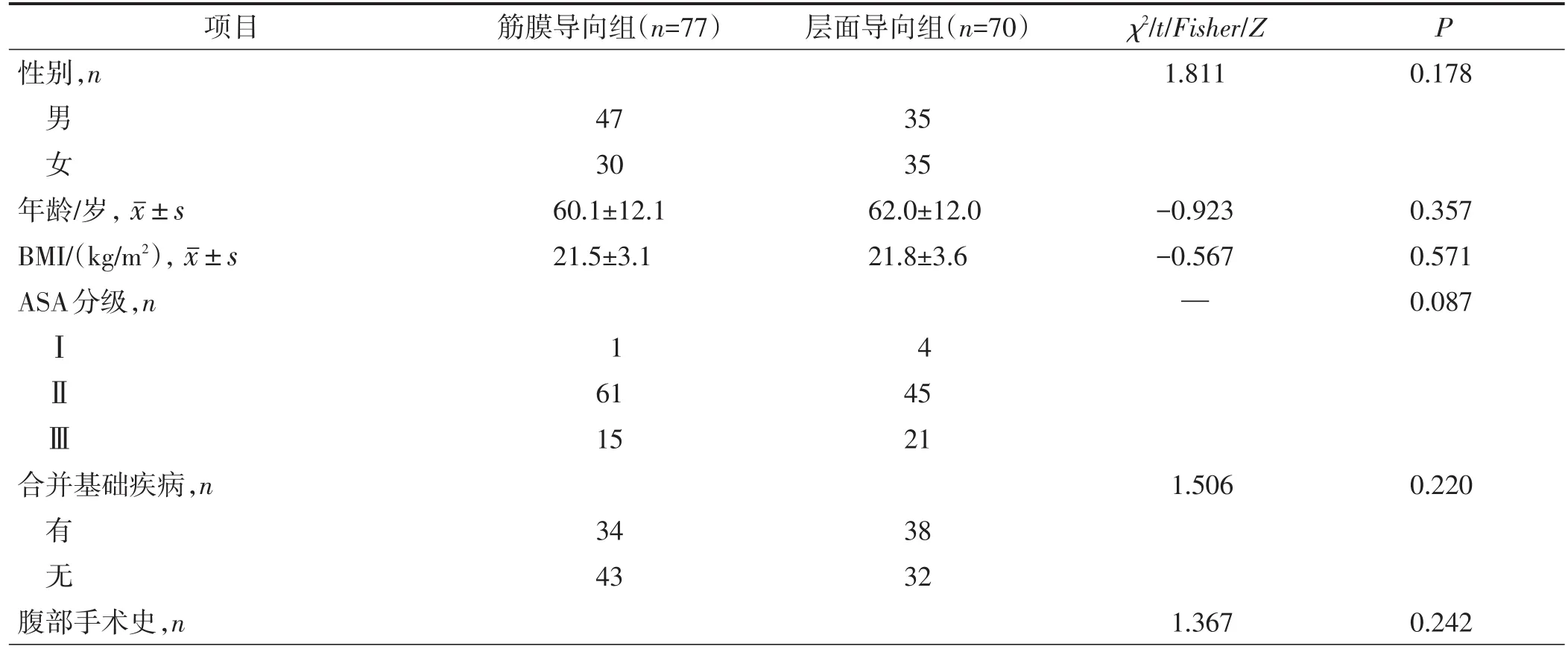
表1 两组一般资料比较
1.2 纳入与排除标准
纳入标准:(1)根据术前CT/MRI和肠镜活检病理学结果证实为直肠癌;(2)手术方式为Dixon术式;(3)择期手术。排除标准:(1)术前发现远处转移、周围脏器浸润;(2)急诊手术病例(合并急性肠梗阻、出血、穿孔等);(3)妊娠期、危重病或有其他手术禁忌证。
1.3 手术过程
1.3.1 筋膜导向组 切开直肠系膜内侧膜桥(图1A),进入Toldt间隙,显露直肠固有筋膜。沿着直肠固有筋膜,先向直肠远端拓展直肠后间隙。直肠后间隙是指直肠固有筋膜与腹下神经前筋膜间潜在间隙(图1B),游离过程注意保持直肠固有筋膜和腹下神经前筋膜的光滑完整性,远端游离至S2水平。转向头侧游离,在乙状结肠背侧系膜后方继续拓展Toldt间隙,注意保持乙状结肠背侧系膜和Gerota筋膜的光滑完整性(图1C),直到直肠系膜根部。拓展小肠系膜和直肠系膜之间的融合筋膜间隙,切开膜桥,完全显露直肠系膜根部(图1D),并在直肠系膜根部离断,同时完成对肠系膜下动脉的高位结扎。紧贴降结肠系膜背侧叶继续向外侧和头侧拓展Toldt间隙,直到降结肠系膜外侧膜桥处。返回在平行肠系膜下动脉根部水平离断肠系膜下静脉,接着裁剪系膜。转向直肠系膜外侧,切开膜桥(图1E),向头侧游离至脾结肠韧带处,打开显露脾脏,向尾侧游离至腹膜返折处。再次回到直肠后间隙,继续紧贴直肠固有筋膜往下拓展,直到S4水平,离断Waldeyer筋膜(图1F),进入肛提肌上间隙。转向直肠前方,在腹膜返折上5 mm处打开腹膜,进入Denonvilliers筋膜前间隙,紧贴Denonvilliers筋膜往下拓展,直到精囊腺中部或底部水平。环行横断Denonvilliers筋膜(图1G),紧贴直肠固有筋膜拓展直肠前间隙。在直肠系膜两侧,紧贴直肠固有筋膜切开直肠侧韧带(图1H),同时切断韧带内的神经和血管,从而完成直肠系膜的完全游离,部分患者可见“系膜终点线”(图1I),也被认为是直肠固有筋膜和盆膈上筋膜的返折线。根据肿瘤的位置,在肿瘤下缘远端5 cm处或直肠系膜末端横断系膜,裸化肠管,距离肿瘤下缘3 cm处横断肠管。
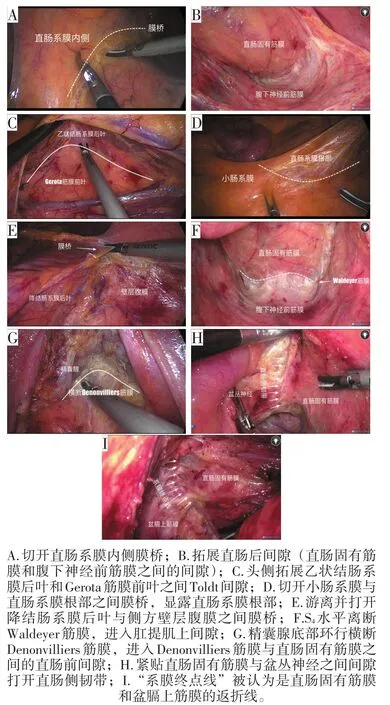
图1 筋膜导向组手术过程
1.3.2 层面导向组 切开直肠系膜内侧腹膜,进入Toldt间隙,沿该间隙向直肠远端拓展直肠后方直至S2水平。转向头侧游离,在乙状结肠背侧系膜后方拓展,操作过程中识别并保护生殖血管和输尿管。根部裸化并离断肠系膜下动脉,清扫其周围淋巴结。向外侧和头侧继续拓展降结肠后间隙,返回离断肠系膜下静脉并裁剪系膜。接着转向打开直肠系膜外侧,向头侧游离至并打开脾结肠韧带,向尾侧游离至腹膜返折处。再次回到直肠后方,游离直至直肠系膜末端。转向直肠前方,在腹膜返折处打开腹膜,同样向下游离直至直肠系膜末端。在直肠系膜两侧,切开直肠侧韧带,从而完成直肠系膜的完全游离。整个操作过程强调间隙的显露,而非筋膜光滑完整。
1.4 观察指标
(1)手术情况:手术时间、术中出血量、预防性造口情况、术后标本直肠系膜完整性[2]、术后病理情况(肿瘤大小、肿瘤类型、肿瘤位置、T分期、N分期、肿瘤分化程度、淋巴管血管浸润、神经浸润、总获取和阳性淋巴结数目)。其中肿瘤位置根据肿瘤下缘距离肛缘距离进行定义,距离肛缘<5 cm、5~10 cm和>10 cm分别定义为低位、中位和高位直肠癌。(2)术后情况:①术后恢复情况(术后住院时间、排气和恢复进食时间、第一天盆腔引流量、拔除尿管时间、拔除盆腔引流管时间);②术后第1、3、5天C反应蛋白水平;③并发症的发生情况包括术后1个月内的排尿功能障碍情况和其他并发症的发生情况和分级[3]。
1.5 随访
采用门诊或电话方式进行随访6~12个月,了解患者术后生存、肿瘤复发和转移情况、术后排尿功能障碍发生情况和低位直肠前切除综合征发生情况(low anterior resection syndrome,LARS)。低位直肠前切除综合征发生情况采用直肠前切除综合征评分进行评价[4]。通过问卷调查方式,评分0~20分、21~29分和30~42分分别定义为无、轻度和重度LARS。
1.6 统计学分析
选用SPSS 22.0统计学软件对数据进行处理。计量资料以(±s)或M(QL,QU)表示,组间比较行t检验或秩和检验;计数资料以[n(%)]或(n)表示,组间比较行χ2检验或者Fisher检验,等级资料采用Mann-WhitneyU检验比较。以P<0.05为差异有统计学意义。
2 结果
2.1 两组手术情况比较
所有患者均顺利完成手术,无中转开腹病例。筋膜导向组的手术时间短于层面导向组,直肠系膜完整性优于层面导向组,总获取淋巴结数目多于层面导向组,差异均有统计学意义(均P<0.05)。余手术情况比较差异均无统计学意义(均P>0.05)。见表2。
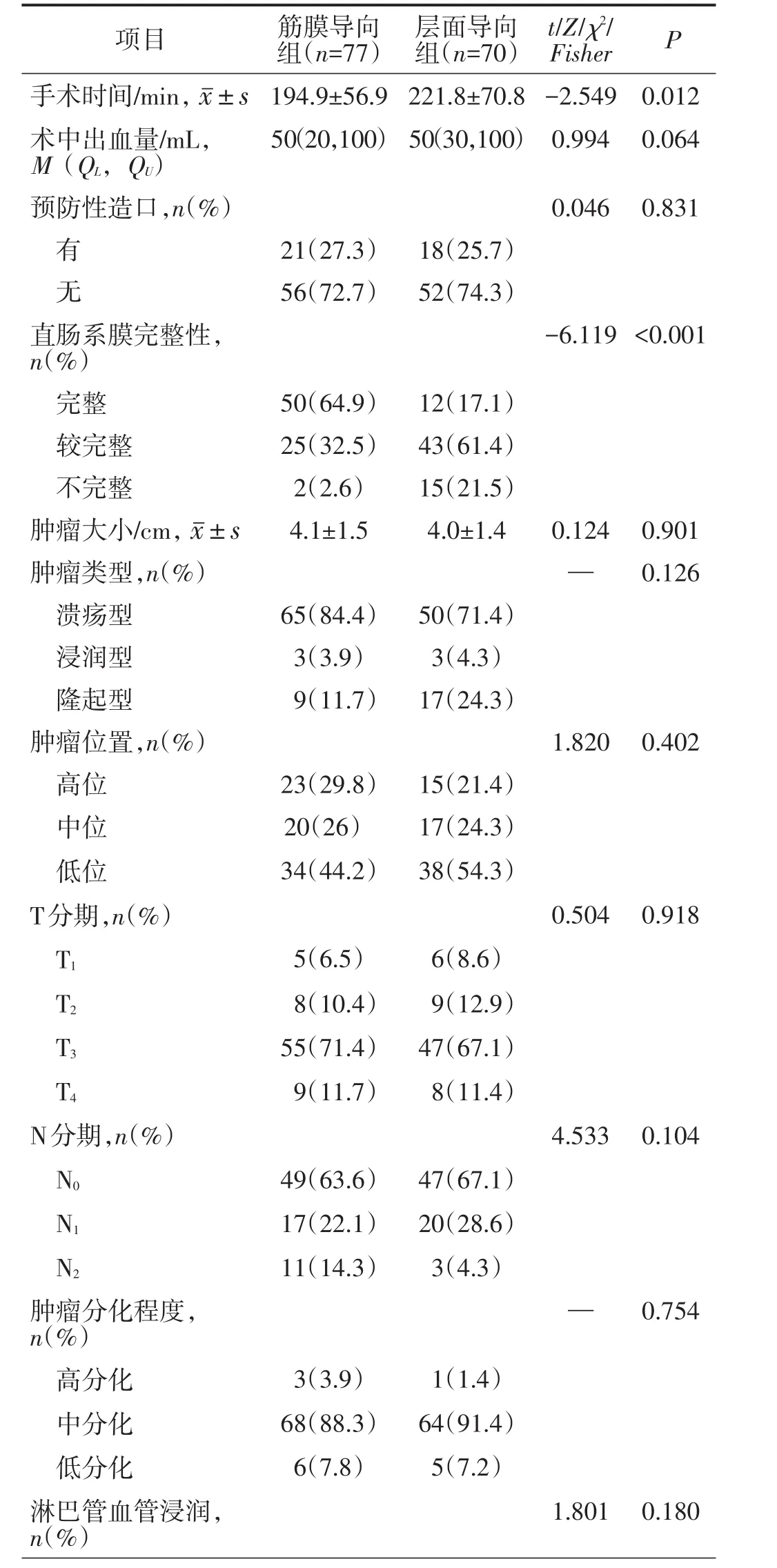
表2 两组手术情况比较
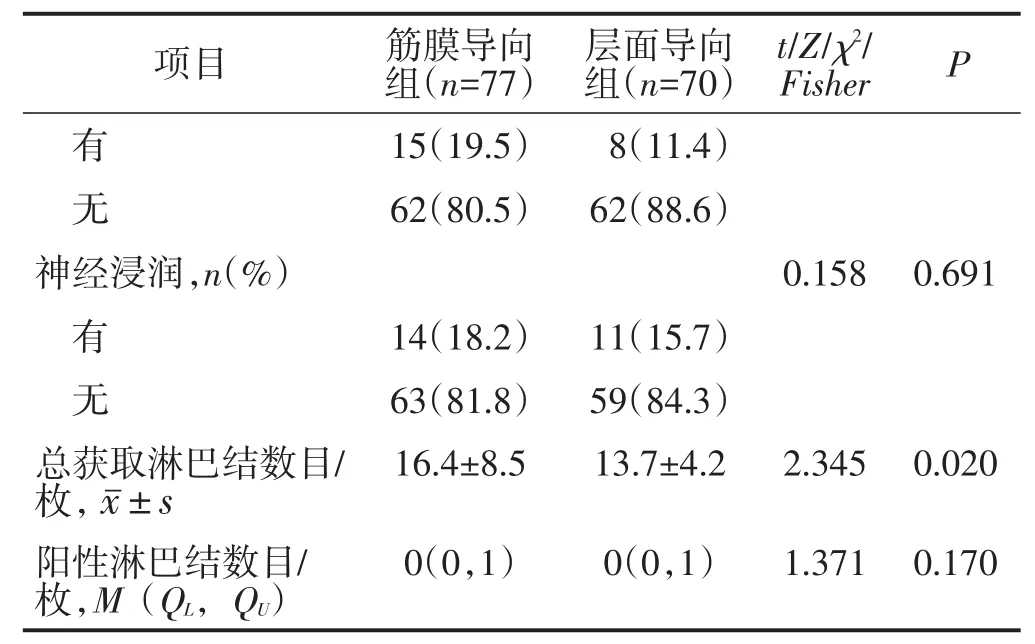
表2 (续)
2.2 两组术后情况比较
2.2.1 两组术后恢复情况比较 筋膜导向组的住院时间、拔除盆腔引流管时间短于层面导向组,第一天盆腔引流量少于层面导向组,差异均有统计学意义(均P<0.05)。余术后恢复情况比较差异均无统计学意义(均P>0.05)。见表3。
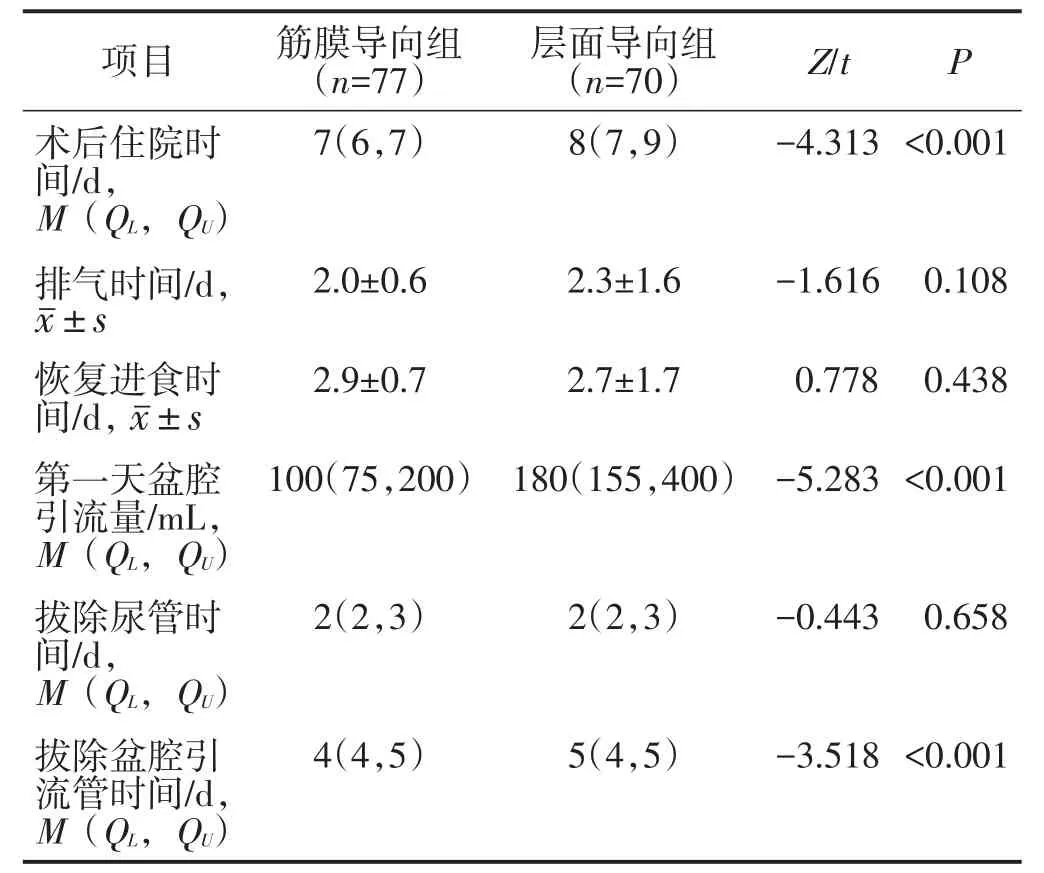
表3 两组术后恢复情况比较
2.2.2 两组术后不同时点CRP水平比较 两组术后不同时点CRP水平比较差异均无统计学意义(均P>0.05)。见表4。
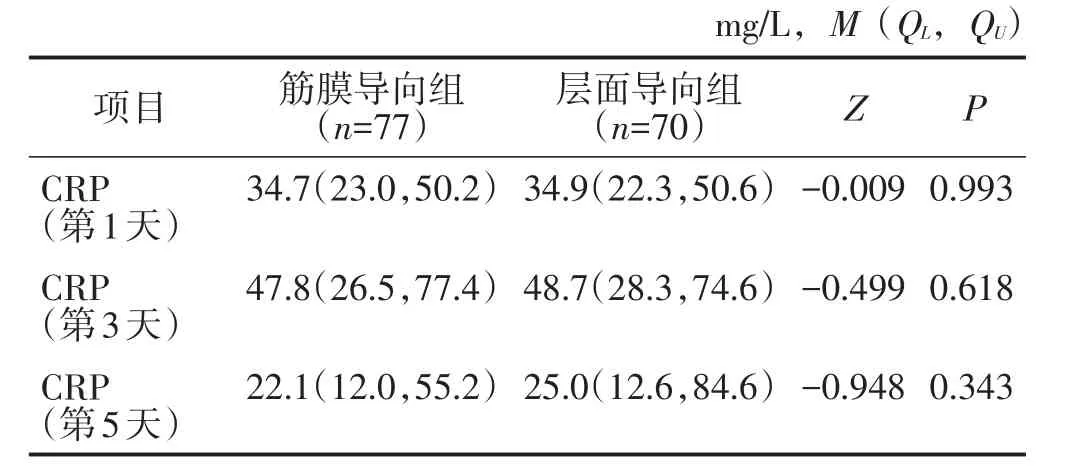
表4 两组术后不同时点CRP水平比较
2.2.3 两组术后并发症发生情况比较 筋膜导向组术后1个月排尿功能障碍的发生率为19.5%(15/77),低于层面导向组的34.3%(24/70),差异有统计学意义(χ2=4.123,P=0.042)。两组其他并发症总发生率及并发症分级比较差异均无统计学意义(均P>0.05)。见表5、表6。
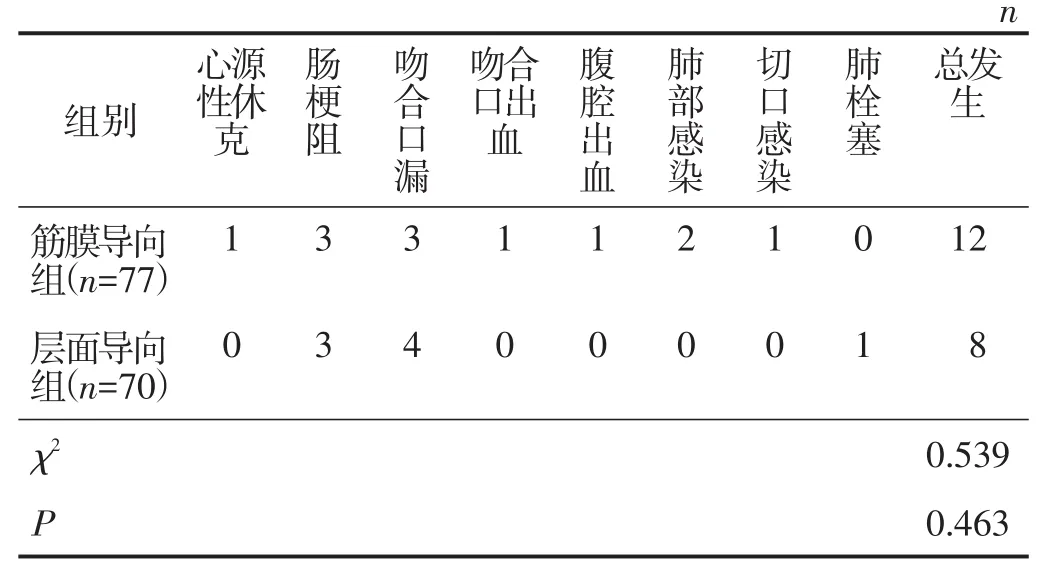
表5 两组其他并发症发生情况比较
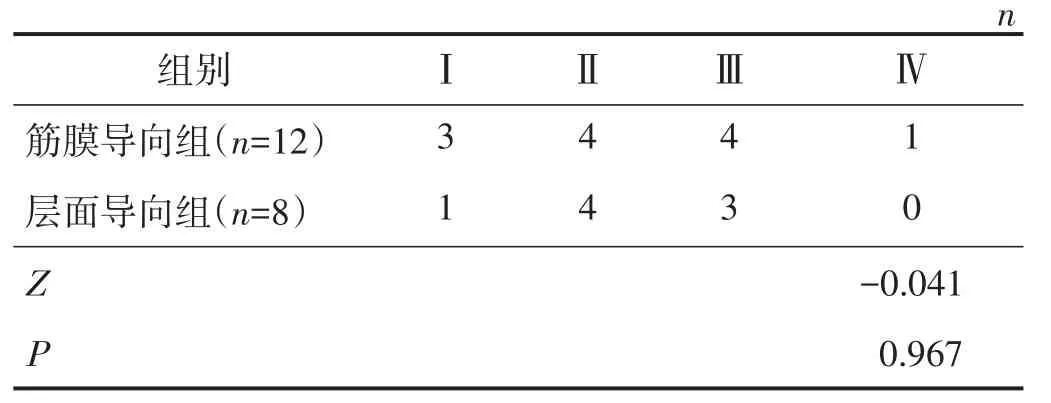
表6 两组其他并发症分级比较
2.3 术后随访情况
2.3.1 随访概况115例患者获得术后随访,随访率为78.2%(115/147),其中筋膜导向组62例,层面导向组53例。术后随访时间为6~12个月,中位随访时间为7个月。随访期间,无肿瘤复发、转移,无肿瘤相关死亡病例。
2.3.2 排尿功能障发生情况比较 筋膜导向组排尿功能障碍的发生率为19.4%(12/62),层面导向组为34%(18/53),两组比较差异无统计学意义(χ2=3.162,P=0.075)。
2.3.3 低位直肠前切除综合征发生情况比较 筋膜导向组排除21例因行预防性回肠造口及3例因术后吻合口漏行二次造口患者,最终38例纳入分析;层面导向组排除18例因行预防性回肠造口及3例因术后吻合口漏行二次造口患者,最终32例纳入分析。其中筋膜导向组29例发生低位直肠前切除综合征,层面导向组25例发生低位直肠前切除综合征,两组低位直肠前切除综合征发生率及严重程度比较差异均无统计学意义(均P>0.05)。见表7。

表7 两组低位直肠前切除综合征发生情况比较
3 讨论
1982年,Heald等[5]在直肠癌中提出直肠全系膜切除术(TME),使得患者远期生存率得到大幅提高。然而,直肠癌手术容易损伤直肠周围血管和神经,术中大出血、术后性功能和排尿功能障碍等问题一直困扰着外科医师。Heald等[1]认为直肠固有筋膜与周围筋膜之间存在一无血管和神经的安全间隙,在此间隙内分离可减少手术并发症的发生,但对这一间隙的明确组成与形态特点未有明确定义,也存在着争议。
关于直肠周围筋膜结构的认识是一个循序渐进的过程。Fernandez-represa、Heald 和 Davies等[6-8]最初认为直肠周围筋膜主要分为两层,将直肠固有筋膜一度命名为“直肠筋膜鞘”或“脏器筋膜”,同时将壁层骨盆筋膜称为“壁层筋膜”或“骶前筋膜”。直到2007年,日本学者Kinugasa等[9]通过术中解剖和术后病理切片显微观察,正式将直肠周围筋膜自腹侧向背侧命名为现在熟知的直肠固有筋膜、腹下神经前筋膜和壁层骶前筋膜。在直肠后方,手术层面在腹下神经前筋膜与直肠固有筋膜间进行可以精准地保护腹下神经和保持直肠系膜的光滑,若是在腹下神经前筋膜与壁层骶前筋膜间进行则容易损伤神经。国内常毅等[10]认为97%的直肠固有筋膜可以完整显露,向下约在S4水平处与腹下神经前筋膜融合成为Waldeyer筋膜,打开此筋膜后为肛管上间隙,直肠固有筋膜与腹下神经前筋膜之间平面非常明显,表现为无血管的疏松结缔组织。
关于直肠前方筋膜层次争议颇多。Heald等[1]认为直肠固有筋膜在前方延伸为Denonvilliers筋膜,TME层次应在Denonvilliers筋膜前方。而Kinugasa等[11]认为Denonvilliers筋膜为壁层骶前筋膜与腹下神经前筋膜在直肠前方的融合筋膜,Denonvilliers筋膜实际上位于直肠固有筋膜的前方,双侧盆丛的左右交通支直接走行于Denonvilliers筋膜前面,其侧面的延续分隔泌尿生殖神经血管束(NVB)和直肠固有筋膜,学者据此认为手术层次应在Denonvilliers筋膜后方。
笔者团队根据目前对于直肠周围筋膜结构的主流认识,同时结合本中心在临床实践中总结的经验,提出筋膜导向直肠癌根治术,其核心思路是沿直肠固有筋膜进行直肠系膜的解剖和游离,确保直肠后间隙前后两层筋膜的光滑完整,既能有效保护神经功能,也能达到完整切除直肠系膜的目的。我们的数据显示,与传统层面术式对比,筋膜导向术式术后直肠标本系膜完整性更优,可更好地达到肿瘤根治效果。筋膜导向组总获取淋巴结数目为(16.4±8.5)枚,多于传统层面导向组的(13.7±4.2)枚。正确的筋膜解剖层面使得手术流程化,在不增加术中出血量的同时缩短了手术时间。
Ishii等[12]通过尸体解剖观察证实盆丛发出的血管神经束穿过Denonvilliers筋膜和直肠固有筋膜支配下段直肠。在中段直肠,盆丛发出的直肠支穿过直肠周围筋膜构成了所谓“侧韧带”,然而并未观察到明显的韧带样结构。王枭杰等[13]通过活体检查和尸体解剖也认为“侧韧带”由盆丛直肠支和相伴行细小血管组成。交感神经纤维起源于T12至L2的腹交感神经节,绕行肠系膜下动脉根部在腹主动脉前形成上腹下丛,在腹主动脉分叉处形成左、右腹下神经(控制射精功能),沿骨盆壁和髂内动脉内侧进入盆丛后上角。副交感神经起源于S2至S4的内脏传入纤维,经骶前孔进入盆丛下角,称盆内脏神经(控制勃起和排尿功能)。腹下神经、盆内脏神经构成盆丛位于腹膜返折下直肠两侧,呈菱形或三角形的网状神经板,盆丛发出分支以支配盆腔泌尿生殖器官。
研究表明TME术中保护盆丛神经,术后排尿和性功能障碍发生率均有下降,但仍然有一定发生率[14]。保护盆丛神经的难度在于直肠侧方间隙非常狭窄,尤其是肥胖患者,往往很难进入精准的手术层面。以直肠固有筋膜作为导向进行直肠系膜解剖,遵循了盆腔筋膜的解剖学原理,能确保手术在正确的侧方平面。本研究结果显示,筋膜导向手术对比传统层面导向手术有效地降低了术后1个月排尿功能障碍的发生率。
与传统层面导向腹腔镜直肠癌根治术相比,筋膜导向术式明显缩短了手术时间,更好地保持直肠系膜完整性和增加了总淋巴结清扫数目。与此同时并未增加术中出血量。在术后恢复情况方面,筋膜导向术式未增加术后并发症的发生,缩短了术后住院和盆腔引流管拔除时间以及减少了盆腔引流管第一天引流量,同时降低术后1个月内排尿功能障碍的发生率。基于以上结果,笔者团队认为该术式更为符合直肠肿瘤的外科筋膜和神经解剖学原理,具有可靠的安全性和开展的可行性。