LncRNA人浆细胞瘤变体易位1介导miR-148b调控脂多糖诱导巨噬细胞自噬的机制研究
曹蔚堂,王文欣
0 引 言
脓毒症是由感染导致器官功能障碍的临床综合征,是导致危重症患者死亡的重要原因之一[1]。尽管抗感染治疗、重症监护及器官保护措施显著降低了脓毒症患者死亡率,然而患者长期预后仍然较差[2]。因此,研究影响脓毒症发病机制相关因素至关重要。炎症反应的过度激活导致的免疫功能障碍是脓毒症的主要发病机制[3]。巨噬细胞是针对微生物入侵防御的第一道防线,在先天性免疫系统中有重要的作用。自噬与炎症反应和免疫密切相关,脓毒症中自噬的激活能够通过负调控异常巨噬细胞的活化、减少炎症小体的活化和炎症因子的释放等途径发挥保护作用[4]。LncRNA人浆细胞瘤变体易位1(LncRNA-plasmacytoma variant translocation 1,LncRNA-PVCT1)是一种长链非编码RNA,研究表明PVT1与脓毒症大鼠炎症反应、心脏功能障碍及急性肾损伤的发生有关[5-6]。目前LncRNA-PVT1在脂多糖(LPS)诱导的巨噬细胞自噬的相关机制尚不清楚。因此,本研究通过LPS体外刺激巨噬细胞,并转染PVT1 siRNA重组质粒,探讨脓毒症中PVT1在巨噬细胞自噬中的可能作用机制,为脓毒症发病机制的研究提供理论依据。
1 材料与方法
1.1 药品与试剂小鼠巨噬细胞株RAW264.7购自于中国科学院细胞库;DMEM、Glutamax、Sodium Pyruvate(11360070)、Lipofectamine 3000试剂盒购自美国Invitrogen公司;胎牛血清购自美国Gibco公司;Alexa Fluor 488 anti-rabbit IgG购自美国Thermo Fisher公司;RNAiso plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTM II购自日本TAKARA公司;肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)、酶联免疫吸附(ELISA)试剂盒购自美国BD Bioscience;兔抗鼠自噬微管相关蛋白轻链3(LC3)、Beclin-1、ATG12、p62一抗、β-actin、辣根过氧化物酶标记羊抗兔二抗、细胞计数试剂盒(CCK-8)、蛋白提取试剂盒、BCA蛋白定量试剂盒、双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术公司;PVT1 mRNA、PVT1、PVT1-NC、PVT1 siRNA、si-NC、miR-148b、miR-148b mimics、miR-NC、U6、GAPDH,生工生物工程(上海)股份有限公司合成。
共聚焦激光扫描显微镜LSM710购自德国Zeiss;实时荧光定量PCR(qRT-PCR)仪ABI7300购自美国ABI公司;酶标仪(Multiskan FC)购自美国Thermo Fisher公司;蛋白凝胶成像仪(ChemiDoc XRS)购自美国BIO-RAD公司。
1.2实验方法
1.2.1 细胞培养与处理巨噬细胞株RAW264.7,培养于含DMEM完全培养液(DMEM 88 mL,Glutamax 1 mL,Sodium Pyruvate 100nmol/L,FBS 10 mL)中,37 ℃、5% CO2培养箱中进行培养。2~3 d更换一次培养液,3~5 d进行一次传代,传代时,吸走部分营养液,留下少许营养液,无菌细胞刮拭培养表面细胞,吹打后接种至新培养瓶内。
收集上述巨噬细胞RAW264.7,调整浓度为1×105个/mL,吸取100 μL细胞悬液加至96孔板中,37 ℃、5% CO2培养箱中进行培养,细胞融合度达到90%时,培养液更换为含有10 μg/mL的LPS,培养4 h[7]。
1.2.2细胞转染及分组收集1.2.1中LPS细胞RAW264.7,调整细胞浓度为6×105个/孔接种至6孔板中,细胞融合度达到80%时,更换为含10μg/mLLPS的无血清DMEM培养基。利用Lipofectamine 3000进行对RAW264.7进行转染,操作严格按照试剂说明书进行。将细胞分为LPS组(细胞不进行转染)、LPS+si-NC组(转染PVT1质粒阴性对照)、LPS+PVT1 siRNA转染组(转染PVT1 siRNA质粒)、LPS+miR-NC组(转染miR-148b mimics 阴性对照)、LPS+miR-148b mimics组(转染miR-148b mimics)、LPS+PVT1-NC+miR-148b mimics组(转染PVT1阴性对照和miR-148b mimics)、LPS+PVT1+miR-148b mimics组(转染PVT1和miR-148b mimics),上述各组均经过LPS处理。同时设置空白组,空白组RAW264.7细胞既不进行LPS处理也不进行转染。
1.2.3qRT-PCR检测细胞中LncRNA-PVT1、miR-148b的表达RNAiso Plus试剂盒提取1.2.2中空白组、LPS组、LPS+si-NC组及LPS+PVT1 siRNA组细胞RNA,反转录试剂盒将提取到的RNA反转录呈cDNA,并进行qRT-PCR反应,反应条件为预变性 95 ℃ 30 s,变性 95 ℃ 30 s,退火 60 ℃ 45 s,延伸72 ℃ 30 s,共计40个循环。分别以GAPDH和U6作为内参基因,采用2-ΔΔCt方法计算各组巨噬细胞RAW264.7中LncRNA-PVT1、miR-148b的相对表达量。引物设计见表1。
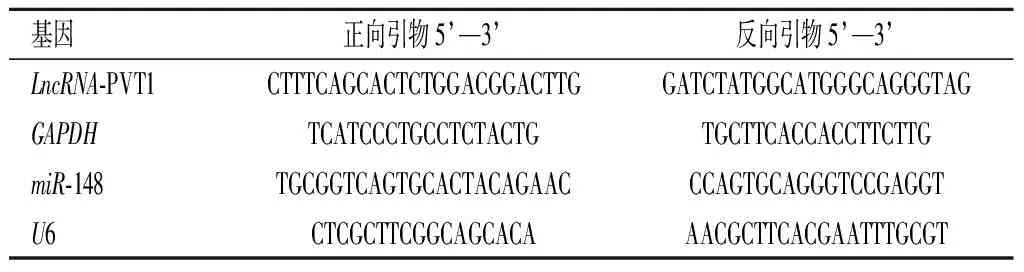
表1 引物序列
1.2.4CCK-8法检测细胞活力收集1.2.2中空白组、LPS组、LPS+si-NC组及LPS+PVT1 siRNA组RAW264.7细胞,调整细胞浓度为1×104个/孔接种至96孔板中,每组设置6个重复,同时设置调零孔仅添加细胞培养液,37 ℃、5%CO2培养箱中培养48h后,加入10 μL CCK-8试剂,37 ℃避光培养2 h,弃上清,酶标仪450nm波长处检测每孔吸光度A值,细胞活力计算公式如下:
细胞活力(%)=[(实验孔A值-调零孔A值)/(对照孔A值-调零孔A值)]×100%
1.2.5免疫荧光染色检测细胞中LC3表达收集1.2.2中各组RAW264.7细胞,室温下用4%甲醛固定15 min;5%的Tris缓冲盐水和Tween-20稀释的脱脂奶粉中孵育1 h;加入LC3一抗(1∶1000稀释),4 ℃孵育过夜,加入二抗(1∶200 稀释)室温下孵育1 h;DAPI(100 ng/mL)室温下孵育细胞30 min染色。共聚焦激光扫描显微镜观察,Image-J 1.51图像分析软件进行分析。荧光显微镜观察细胞着色,细胞核为蓝色,LC3阳性细胞的细胞质为红色。
1.2.6ELISA法检测细胞中炎症因子水平收集1.2.2中各组RAW264.7细胞,以4×104/孔浓度接种至24孔板中,培养24 h后,收集细胞上清液,每组设置3个重复,ELISA试剂盒检测细胞中TNF-α和IL-6的水平,实验操作严格按照试剂盒说明书进行。
1.2.7载体构建Starbase数据库(http://starbase.sysu.edu.cn/index.php)显示PVT1基因3’UTR含有与miR-148b的结合位点,对含结合位点PVT1区域进行扩增,并连至pGL4质粒,构建pGL4-PVT1-WT质粒;以此质粒对模板进行定点缺失(chr8:128902970-128902991位点)突变,测序确定突变成功,构建pGL4-PVT1-Del质粒。
1.2.8双荧光素酶报告系统分析测序验证成功的重组质粒pGL4-PVT1-WT、pGL4-PVT1-Del和miR-148b NC、miR-148b mimics共转染至巨噬细胞RAW264.7中,每组设置3个重复,转染6 h后,更换培养基。质粒共转染36h后,弃去培养基,PBS洗涤细胞;每孔加入50 μL的1×PLB,震荡使细胞全部裂解;不透光96孔酶标板中每孔加上述上清液10 μL,加入100 μL双荧光素酶反应试剂Ⅱ,检测荧光素酶反应强度,记为A;测定结束后加100 μLStop&Glo,检测内参海肾荧光素酶反应强度,记为B。A/B数值为荧光素酶相对活性。
1.2.9蛋白免疫印迹法检测细胞中自噬蛋白的表达收集1.2.2中各组细胞,培养48 h后调整浓度为5×105个/mL,每孔100μL加至96孔板中,弃上清,PBS洗涤2次,重悬细胞,每组设置3个重复,蛋白提取试剂盒提取细胞总蛋白,BCA试剂盒测定总蛋白浓度,蛋白样品进行SDS-PAGE凝胶电泳,电泳结束后将蛋白转移至PVDF膜上,5%脱脂奶粉遮光封闭2 h;分别加入一抗稀释液(LC3、Beclin1、p62、β-actin)均为1∶1000稀释,Beclin-1 1∶2000稀释,4 ℃孵育过夜,TBST洗膜3次,加入辣根过氧化物酶标记二抗稀释液(1∶1000稀释),室温孵育1 h,TBST洗膜3次。蛋白凝胶成像仪分析蛋白表达水平。
2 结 果
2.1 转染效率检测转染48 h后,显微镜下观察RAW264.7细胞转染情况,转染成功巨噬细胞RAW264.7均发出绿色荧光,转染效率达80%以上。见图1。
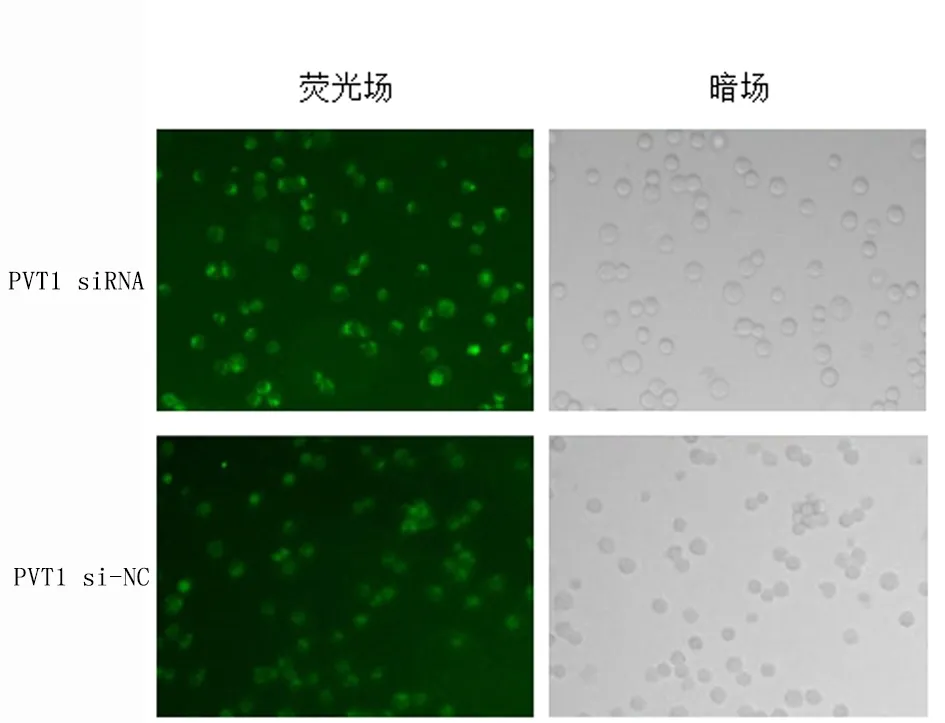
图1 倒置显微镜观察RAW264.7细胞转染情况(×200)
2.2RAW264.7细胞中LncRNA-PVT1、miR-148b表达情况qRT-PCR结果表明,与空白组比较,LPS组细胞PVT1 mRNA表达显著升高,miR-148b表达显著降低(P<0.05);与LPS组、LPS+si-NC组比较,LPS+PVT1 siRNA组细胞PVT1 mRNA表达显著降低,miR-148b表达显著升高(P<0.05)。见图2。
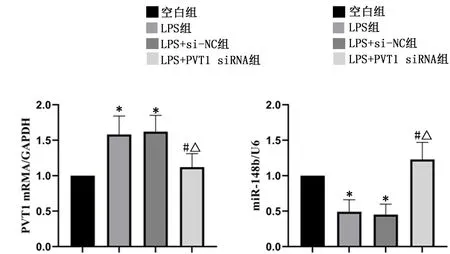
与空白组比较,*P<0.05;与LPS组比较,#P<0.05;与LPS+si-NC组比较,△P<0.05
2.3沉默LncRNA-PVT1对RAW264.7细胞活力的影响CCK-8实验结果表明,与空白组(100.00±0.00)比较,LPS组细胞活力(73.46±3.25)显著降低(P<0.05);与LPS组(73.46±3.25)、LPS+si-NC组(74.15±4.42)比较,LPS+PVT1 siRNA组细胞活力(90.38±2.16)显著升高(P<0.05)。
2.4沉默LncRNA-PVT1对RAW264.7自噬的影响免疫荧光染色实验显示,LC3阳性细胞质为红色,LPS刺激后,巨噬细胞RAW264.7中LC3阳性表达增加;LPS刺激后再转染PVT1 siRNA后,进一步增加了细胞中LC3蛋白的阳性表达。见图3。
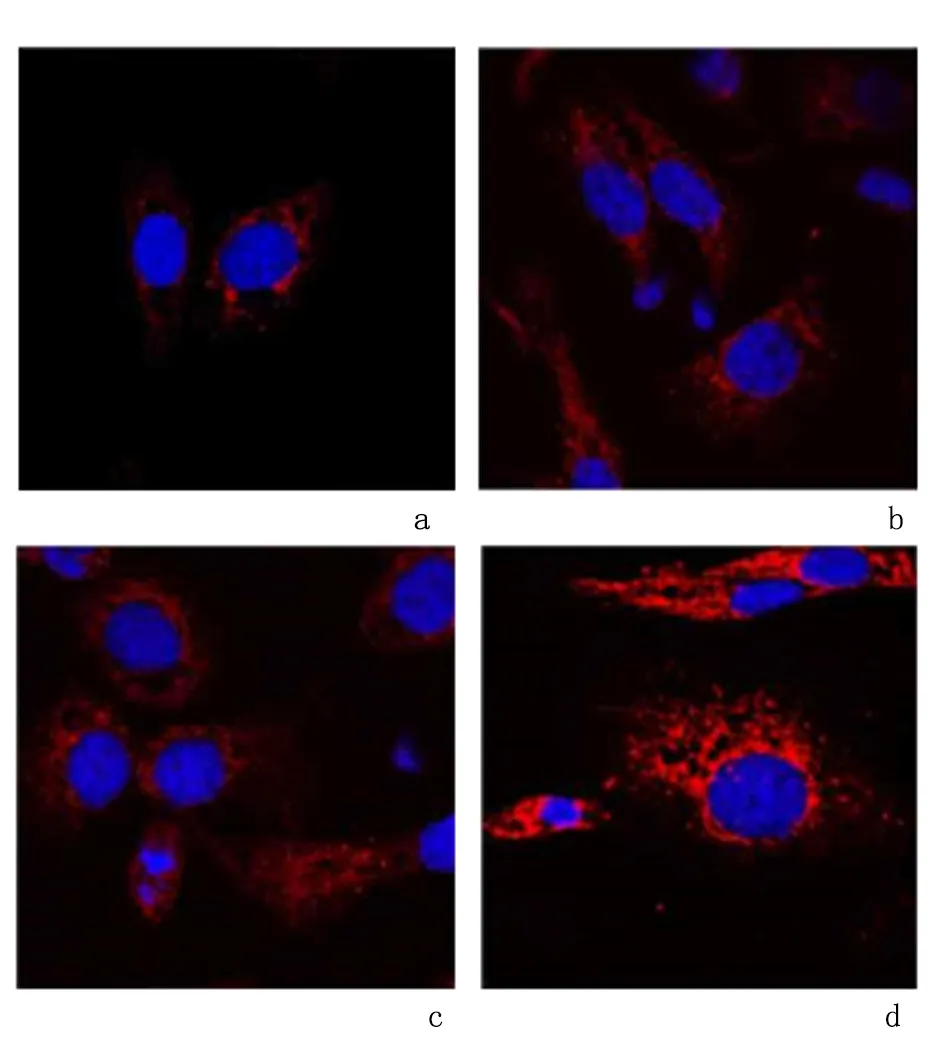
a:空白组;b:LPS组;c:LPS+si-NC组;d:LPS+PVT1 siRNA组
WB实验结果表明,与空白组比较,LPS组细胞自噬蛋白LC3-II/LC3-I、Beclin-1表达显著上调,p62表达显著下调(P<0.05);与LPS组、LPS+si-NC组比较,LPS+PVT1 siRNA组自噬蛋白LC3-II/LC3-I、Beclin-1表达显著上调,p62表达显著下调(P<0.05)。见图4,表2。
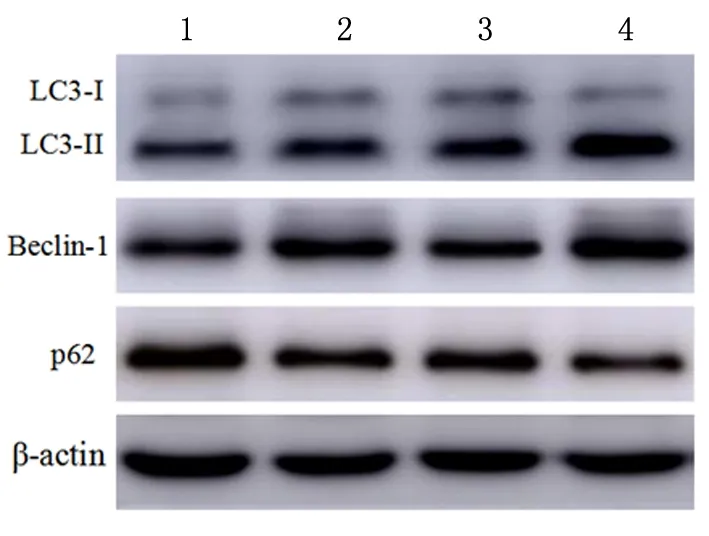
1:空白组;2:LPS组;3:LPS+si-NC组;4:LPS+PVT1 siRNA组
表2 沉默LncRNA-PVT1对RAW264.7细胞自噬蛋白表达的影响
2.5沉默LncRNA-PVT1对RAW264.7中炎症因子的影响ELISA实验结果表明,与空白组比较,LPS组细胞中TNF-α、IL-6表达水平显著升高(P<0.05);与LPS组、LPS+si-NC组比较,LPS+PVT1 siRNA组中TNF-α、IL-6表达水平显著降低(P<0.05),见图5。
2.6LncRNA-PVT1靶向调控miR-148b基因的关系验证Starbase(http://starbase.sysu.edu.cn/index.php)数据库预测结果表明,PVT1基因3’UTR区有miR-148b的结合位点,位于LncRNA-PVT1 chr8:128902970-128902991区域,见图6。荧光素酶报告基因结果表明,与转染miR NC-pGL4-WT(2.13±0.04)比较,转染miR-148b mimics-pGL4-WT荧光素酶活性(1.13±0.03)显著降低(P<0.05);而转染miR NC-pGL4-Del、miR-148b mimics-pGL4-Del荧光素酶活性(2.11±0.05、2.12±0.03)无显著性变化(P>0.05)。

图6 Starbase数据库预测LncRNA-PVT1与miR-148b具有靶向关系
2.7LncRNA-PVT1过表达抑制miR-148b过表达对RAW264.7自噬的影响免疫荧光染色实验结果表明,与LPS组、LPS+miR-NC组比较,LPS+miR-148b mimics组细胞中LC3阳性表达升高;与LPS+miR-148b mimics组、LPS+PVT1-NC+miR-148b mimics组比较,LPS+PVT1+miR-148b mimics组细胞中LC3阳性表达降低,见图7。
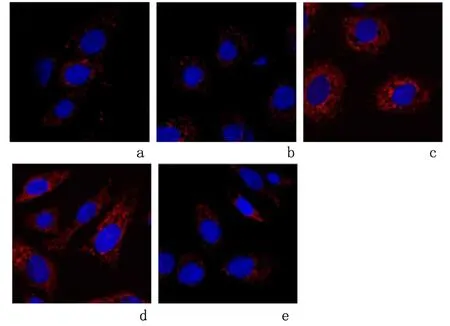
a:LPS组;b:LPS+miR-NC组;c:LPS+miR-148b mimics组;d:LPS+PVT1-NC+miR-148b mimics组;e:LPS+PVT1+miR-148b mimics组
WB实验结果表明,与LPS组、LPS+miR-NC组比较,LPS+miR-148b mimics组细胞自噬蛋白LC3-II/LC3-I、Beclin-1表达显著上调,p62表达显著下调(P<0.05);与LPS+miR-148b mimics组、LPS+PVT1-NC+miR-148b mimics组细胞比较,LPS+PVT1+miR-148b mimics组细胞LC3-II/LC3-I、Beclin-1表达显著下调,p62表达显著上调(P<0.05),见图8,表3。
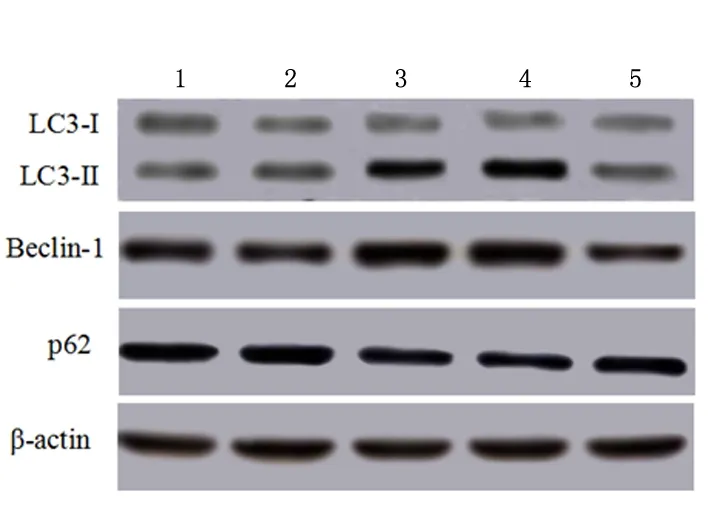
1:LPS组;2:LPS+miR-NC组;3:LPS+miR-148b mimics组;4:LPS+PVT1-NC+miR-148b mimics组;5:LPS+PVT1+miR-148b mimics组
表3 LncRNA-PVT1过表达抑制miR-148b过表达对RAW264.7自噬的影响
2.8LncRNA-PVT1过表达抑制miR-148b过表达对RAW264.7炎症的影响ELISA实验结果表明,与LPS组、LPS+miR-NC组比较,LPS+miR-148b mimics组细胞TNF-α、IL-6表达水平显著降低(P<0.05);与LPS+miR-148b mimics组、LPS+PVT1-NC+miR-148b mimics组细胞比较,LPS+PVT1+miR-148b mimics组细胞TNF-α、IL-6表达水平显著升高(P<0.05),见表4。
表4 LncRNA-PVT1过表达抑制miR-148b过表达对RAW264.7炎症因子表达的影响
3 讨 论
脓毒症是感染引起的全身炎症反应综合征,威胁人类健康并消耗大量的健康资源,具有高发病率、高死亡率和高治疗费用的三高特点[1]。脓毒症初始阶段,LPS能够诱导过度炎症反应[2]。本研究发现LPS刺激后巨噬细胞RAW264.7中炎症因子TNF-α、IL-6表达显著升高,细胞活力受到抑制。巨噬细胞是机体抗感染免疫应答过程中的主要细胞。在脓毒症中,自噬被认为是一种限制细胞损伤和凋亡的细胞适应性保护机制[8],其不仅能够消除受损的蛋白质和细胞器,还能够消除细胞质中的细菌和病原体[9]。本研究发现LPS刺激后,RAW264.7自噬活性显著升高,提示自噬在脓毒症中有一定的作用。既往研究表明自噬可能是逆转脓毒症免疫抑制的有效靶点,增加自噬可以减少器官损伤[10-11]。因此研究与自噬有关的机制可能为脓毒症的治疗提供新思路。
LncRNA是一种非编码长链RNA,可与RNA、DNA或蛋白质相互作用,调节蛋白编码基因的表达,参与肿瘤形成及炎症反应等过程[12]。LncRNA-PVT1最早发现于鼠的浆细胞异位基因中,与胃癌、非小细胞肺癌等癌症的发生有关[13-14]。有研究发现LPS诱导的脓毒症急性肾损伤小鼠模型肾脏组织中PVT1表达显著高于正常对照组[5]。本研究结果表明,LPS刺激后巨噬细胞PVT1表达显著升高,提示PVT1可能参与脓毒症的发生机制。Huang等[15]研究表明PVT1促进LPS诱导的败血性急性肾损伤,转染si-PVT1能够降低LPS诱导的HK-2细胞中TNF-α、IL-6等炎症因子水平。本研究对PVT1进行沉默并转染至RAW264.7中,结果表明PVT1 siRNA组细胞活力及自噬活性均显著升高,而炎症因子TNF-α、IL-6的表达显著降低,提示PVT1可能抑制LPS刺激后巨噬细胞的自噬,进而导致炎症因子水平的升高。
miRNA是一种内源性非编码小RNA,在不同疾病发病机制的的先天性和适应性免疫中起着重要的作用[16]。在脓毒症发病过程中miRNA的表达与脓毒症的炎症反应有关,Zhang等[17]研究表明miR-23b过表达能够降低LPS诱导的巨噬细胞THP-1炎症因子TNF-α、IL-6的水平。miR-148b属于miR-148/-152家族,Dong等[18]研究表明miR-148b可能是脓毒症的候选生物标志物。然而对miR-148b在脓毒症发病机制中的作用,目前还少有研究。本研究发现与空白组比较,LPS组RAW264.7中miR-148b水平显著降低,提示miR-148b可能参与脓毒症的发生。Liu等[19]研究表明miR-148a过表达增加了自噬活性,从而抑制了肝星状细胞LX-2的增殖并促进其凋亡。本研究发现,miR-148b mimics组细胞自噬蛋白LC3-II/LC3-I、Beclin-1表达较LPS组显著上调,p62表达、炎症因子TNF-α、IL-6表达水平则相反,提示miR-148b可能通过激活巨噬细胞自噬,减轻RAW264.7的炎症反应。miR-148b的表达受甲基化、转录因子及LncRNA等调控,在自身免疫性疾病、肿瘤发生、炎症反应等生理病理过程中有关键的作用[20]。Xi等[14]研究表明非小细胞肺癌组织中PVT1表达上调,而miR-148表达下调,PVT1通过靶向抑制miR-148促进非小细胞肺癌的增殖和迁移。Starbase数据库预测结果表明,PVT1基因3’UTR区有miR-148b的结合位点,且荧光素酶报告基因结果表明PVT1能够调控miR-148b的表达。进一步探究发现,过表达PVT1可逆转miR-148b mimics对RAW264.7细胞自噬能力的促进以及炎性反应的抑制作用,提示沉默PVT1可能通过靶向下调miR-148b表达促进巨噬细胞的自噬,降低炎症因子水平从而发挥免疫保护作用。
综上所述,LncRNA-PVT1可能通过介导miR-148b抑制脓毒症巨噬细胞RAW264.7的自噬,从而引发过度炎症反应,可能是脓毒症发生的机制。然而本研究仅在体外细胞水平上探讨了脓毒症LncRNA-PVT1、miR-148b对巨噬细胞自噬的影响机制,下一步需结合体内实验进一步炎症两者调控巨噬细胞自噬对脓毒症发展的影响。
——一道江苏高考题的奥秘解读和拓展