内镜下治疗直肠神经内分泌肿瘤的疗效评估
唐国兴,袁柏思,陆 恒,杨妙芳,刘 炯,汪芳裕
0 引 言
直肠神经内分泌肿瘤(Rectal Neuroendocrine Neoplasms,R-NENs)是一类起源于黏膜或黏膜下层的恶性潜能较低的肿瘤,当其分化程度低、侵及肌层或浸润淋巴脉管时复发和转移风险会明显增加[1]。随着结肠镜技术的普及和广泛开展,R-NENs检出率在逐年增高[2-3],内镜下治疗可用于治疗黏膜或黏膜下病变[4],目前内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已被广泛运用于治疗R-NENs,然而对两者的疗效仍有争议[5-7]。本研究回顾性分析EMR及ESD治疗的75例R-NENs患者临床病理资料,评估内镜下治疗R-NENs的效果,从而为临床医师提供参考。
1 资料与方法
1.1 临床资料回顾性分析2011年1月至2020年5月75例就诊于南京医科大学金陵临床医学院消化内科确诊为R-NENs患者的临床资料。纳入标准:临床资料完整;经内镜下治疗。排除标准:单纯门诊诊治及合并其他恶性肿瘤的患者。术前检查,20例患者(26.7%)完善腹部CT或MRI,9例(12.0%)患者完善超声内镜判断直肠病变一般情况,余患者未完善影像学检查;45例患者行粪便潜血试验,阳性率为4.4%(2/45);血清肿瘤标志物方面,癌胚抗原、神经元特异性烯化醇阳性率较低,分别为0%(0/38)和6.7%(1/15)。
1.2治疗方式根据病变形态、大小及可能侵犯深度选择内镜下黏膜切除术(endoscopic mucosal resection,EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),术前判断为黏膜层病变的采用EMR,术前判断为黏膜下病变的采用ESD。具体步骤:黏膜下注射含有肾上腺素和靛蓝的等渗盐水抬起病变,随后在EMR中进行圈套切除病变,在ESD中使用IT刀剥离病变,最后予以APC或电凝处理创面。
1.3诊断标准切除标本确诊分期,评估肿瘤切缘情况并完善免疫组织化学染色,参照2019年WHO标准根据Ki-67阳性指数进行肿瘤分期,Ki-67 <3%为G1期,3%~20%为G2期,>20%为G3期[8]。完整切除定义为内镜下完整切除病变,无论切缘病理状态。完全切除定义为完整切除后病变切缘阴性且无淋巴脉管浸润。
1.4分析指标分析指标包括:患者性别、年龄及症状等一般情况;R-NENs初次内镜下诊断、内镜下治疗、大小及表面情况等一般特征;R-NENs病理切缘状态及免疫组织化学染色结果。
1.5随访采用门诊复查和电话随访。患者在术后6个月及每年复查结肠镜及常规影像学检查(CT/MRI),随访截至2020年10月1日,平均随访(43.8±27.1)个月。结肠镜下未见复发,影像学未发现肺、肝及腹部淋巴结转移则认为无复发转移,对胸腹部以外如无特殊症状不作相应检查。
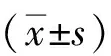
2 结 果
2.1 患者一般临床特征75例R-NENs患者,男49例,女26例,平均年龄(50.1±11.2)岁。临床表现无特异性,主要为排便习惯改变 (36.0%)、腹胀 (29.3%)、腹痛 (22.7%)。见表1。

表1 R-NENs患者一般临床特征
2.2R-NENs的内镜下特征75例患者中共检出78个R-NENs,多位于距肛缘5~10 cm处(61/78,78.2%),其中仅2例多发R-NENs。R-NENs内镜下大小3~20 mm,平均(7.6±3.5)mm,其中<10 mm占比最大(56/78,71.8%),其次10~20 mm(22/78,28.2%)。R-NENs形态无明显特征,多数为半球形隆起形态(70/78,89.7%),表面光滑(74/78,94.9%),淡黄色(73/78,93.6%)。
2.3内镜下治疗效果EMR和ESD均完整切除病变,术中术后未出现出血穿孔。ESD的完全切除率较EMR更高(P<0.01),见表2。病理提示切缘阳性的9例(11.5%)患者中1例选择追加外科手术治疗。此外,术前是否行超声内镜评估病变,内镜下治疗的完全切除率无统计学差异(P>0.05)。

表2 EMR及ESD切除R-NENs的效果
2.4病理免疫组织化学结果G1、G2期R-NENs分别有68(87.0%)和10(13%)个,均位于黏膜或黏膜下层,无淋巴脉管浸润,其中8个G1期和1个G2期R-NENs提示切缘见瘤组织。免疫组化显示,Syn、CK8/18阳性率最高(100%),其次CKpan(60/62,96.8%)、CD56(62/67,92.5%)、CDH17(10/11,90.1%)、CgA(22/72,30.6%)、CDX-2(4/21,19.1%)。
2.5随访结果75例患者中7例失访,1例随访期间因胰腺癌死亡,成功随访的67例(85.9%)患者均良好存活。共54例患者完成复查,其中47例(87.0%)术后1年及以上复查未发现R-NENs局部复发或远处转移,7例(13.0%)患者病程不足1年,术后6月复查也未发现局部复发或远处转移。此外,切缘阳性的9例患者均良好存活,7例G1期患者术后每年复查未发现复发及转移,余2例患者未复查。典型患者内镜下治疗及随访过程见图1。

a:内镜下半圆形隆起病变;b:超声内镜示黏膜下层病变;c:标记R-NENs边缘;d:黏膜下剥离R-NENs;e:剥离的R-NENs;f:术后第7年复查未见复发
3 讨 论
直肠神经内分泌肿瘤来源于肠嗜铬细胞,多位于黏膜或黏膜下层[9]。近年来R-NENs检出率逐渐增高,目前研究指出改良EMR、TEM及EFTR等技术可安全有效地应用于治疗R-NENs[10-12],而国内机构多开展传统EMR及ESD,此类技术用于治疗R-NENs的安全性及效果的研究是有必要的。本研究中R-NENs均行EMR或ESD切除,术中术后无明显并发症,完成复查的患者均未发现复发及转移。
国内共识及欧洲ENETs共识对大小<10 mm的T1期(G1/G2) R-NENs推荐行内镜下切除,若术后病理提示切缘阳性则须追加内镜下治疗或外科手术[13-14]。然而,Mo等[15]对407例大小1~22 mm的R-NENs内镜下治疗结局行回顾分析,其中148例切缘阳性或不确定,平均随访45月,发现无论何种切缘情况复发率均不足3%,与本研究结果一致。本研究中行内镜下治疗切缘阳性且未追加手术治疗的6例R-NENs患者后续复查也未发现肿瘤复发,这可能与切除R-NENs时采用APC或电凝处理切缘,肠壁残存肿瘤细胞被清除有关,也可能与G1/G2期R-NENs恶性潜能低,随访时间不足相关。与既往研究[16-17]一致,本研究表明对大小<20 mm的G1/G2期R-NENs行EMR及ESD是安全有效的,治疗后切缘阳性但未侵及肌层的R-NENs追加手术治疗并不是必需的,可根据病理情况及复查结果明确是否需要追加内镜或手术治疗。
R-NENs患者临床症状无特异性,本研究中32例患者并无症状,另外43例患者虽伴有腹痛、腹胀、大便习惯改变或肛门症状,但此类症状也可出现于肠易激综合征等其他胃肠疾病中,对R-NENs的诊断无明显提示作用。目前越来越多R-NENs在结肠癌筛查中同时被检出[18],然而结肠癌筛查中常用的检查项目如大便隐血试验及肿瘤标志物CEA在本研究中阳性率低,对R-NENs的早期发现无帮助,提示内镜医师在结肠镜检查时需提高认识和重视才能提高检出率。
R-NENs内镜下形态亦无特征性表现,易与其他直肠黏膜病变混淆。本研究中R-NENs内镜下多呈现为黏膜下层的淡黄色半圆形隆起,也有部分为扁平形态,其中多达39例患者的直肠病变在术前不被考虑为R-NENs,提示单纯的白光内镜对直肠病变的性质判断存在局限,这也是本研究中部分病变选择EMR治疗的原因。而雷蕾等[19]通过对比R-NENs及其他直肠黏膜病变EUS声像特点,发现EUS可以帮助鉴别R-NENs与其他直肠黏膜病变,对鉴别有困难的病变可完善EUS检查。但也有研究指出R-NENs病变较小时多为G1期病变,位于黏膜下层且很少侵及淋巴脉管,恶性潜能较低,EUS对R-NENs内镜下治疗指导价值有限,并不是必需检查项目[20]。本研究中仅9例患者接受术前EUS检查,但是否行EUS的内镜下治疗完全切除率无明显差异,这与术者根据活检钳推动病变判断肿瘤较表浅,可通过内镜完整切除的经验相关,EUS对形态良好、活检钳可推动的小R-NENs的必要性仍待进一步验证。
综上所述,本研究结果显示,对于大小<20 mm、局限于黏膜或黏膜下层的G1/G2期直肠神经内分泌肿瘤,行ESD及EMR治疗安全有效,且ESD可更完全切除肿瘤,但长期疗效无明显差别。本研究不足之处是一项单中心、小样本的回顾性研究,后续将进一步扩大样本量并延长复查随访时间进行研究。