壳聚糖氧化石墨烯负载冬凌草甲素对A549细胞增殖及凋亡的影响
谢谭芳 朱小勇 黄天衍


中圖分类号 R285.5;R943 文献标志码 A 文章编号 1001-0408(2021)13-1589-07
DOI 10.6039/j.issn.1001-0408.2021.13.09
摘 要 目的:研究壳聚糖氧化石墨烯载体(CS-GO)负载冬凌草甲素(CS-GO-oridonin)对人肺癌细胞A549增殖及凋亡的影响。方法:以A549细胞为对象,采用CCK-8法检测经不同质量浓度的CS-GO(3、6、12、24、48 μg/mL)和负载了等质量冬凌草甲素的CS-GO-oridonin(3、6、12、24、48 μg/mL,以冬凌草甲素质量计,下同)作用后的细胞存活率,并计算CS-GO-oridonin的半数抑制浓度(IC50);采用显微镜观察CS-GO和CS-GO-oridonin(均为32 μg/mL)作用2、4、10、24 h后的细胞形态,并采用荧光标记法观察细胞对CS-GO、冬凌草甲素、CS-GO-oridonin(均为32 μg/mL)的摄取情况;采用流式细胞术观察不同质量浓度CS-GO(16、32、64 μg/mL)和CS-GO-oridonin(16、32、64 μg/mL)作用后细胞的凋亡情况及细胞中活性氧(ROS)的含量,采用Western blot法检测细胞中抗凋亡相关蛋白[髓样细胞白血病1(Mcl-1)、Bax、Bak]蛋白的表达情况。结果:经不同质量浓度CS-GO作用后,细胞的存活率仍不低于90%;经不同质量浓度CS-GO-oridonin作用后,细胞存活率呈下降趋势,且显著低于相同质量浓度的CS-GO组(P<0.01);CS-GO-oridonin的IC50为32.61 μg/mL。经CS-GO作用后,细胞形态未见明显改变;经CS-GO-oridonin作用后,细胞出现皱缩、成团脱落、悬浮物增多等现象;当细胞摄取冬凌草甲素和CS-GO-oridonin后,其荧光均较摄取CS-GO的细胞有所增强。与空白组比较,CS-GO 16、32、64 μg/mL组细胞的凋亡率和细胞中ROS含量、凋亡相关蛋白的表达水平均无显著变化(P>0.05);而CS-GO-oridonin 16、32、64 μg/mL组细胞的凋亡率、细胞中ROS含量和Bax、Bak蛋白的表达水平均显著升高,Mcl-1蛋白的表达水平均显著降低,且上述指标水平均显著高于或低于同质量浓度CS-GO组(P<0.05)。结论:CS-GO不会影响A549细胞的增殖及凋亡;CS-GO- oridonin对细胞有明显的抑制和促凋亡作用,这种作用可能与增加细胞中ROS的产生、调控凋亡相关蛋白的表达有关。
关键词 壳聚糖氧化石墨烯载体;冬凌草甲素;A549细胞;增殖;凋亡
Effects of Oridonin-loaded Chitosan Graphene Oxide on the Proliferation and Apoptosis of A549 Cells
XIE Tanfang,ZHU Xiaoyong,HUANG Tianyan(School of Pharmacy, Guangxi University of TCM/Key Laboratory of Common Technology of Traditional Chinese Medicine Preparation in Universities of Guangxi/Modern Chinese Medicine Preparation Engineering Technology Research Center, Nanning 530022, China)
ABSTRACT OBJECTIVE: To study the effects of chitosan graphene oxide carrier (CS-GO) loaded with oridonin (CS-GO- oridonin) on the proliferation and apoptosis of human lung cancer A549 cells. METHODS: Taking A549 cells as objects, the survival rate of cells were detected by CCK-8 method after treated with different concentrations of CS-GO(3, 6, 12, 24, 48 μg/mL) and CS-GO-oridonin loaded with same mass of oridonin (3, 6, 12, 24, 48 μg/mL, by the weight of oridonin, the same below). IC50 of CS-GO-oridonin was calculated. The cell morphology were observed by microscope after treated with CS-GO and CS-GO-oridonin (both 32 μg/mL) for 2, 4, 10, 24 h. The uptake of CS-GO, oridonin, CS-GO-orionin (all 32 μg/mL) by cells was observed with fluorescence labeling method. The apoptosis of cells and the content of ROS were observed by flow cytometry after treated with different concentrations of CS-GO (16, 32, 64 μg/mL) and CS-GO-oridonin(16, 32, 64 μg/mL). The expression of anti-apoptosis related proteins (Mcl-1, Bax and Bak) were detected by Western blot. RESULTS: After treated with different concentrations of CS-GO, the survival rate of cells was still above 90%; after treated with different concentrations of CS-GO-oridonin, the survival rate of cells showed a downward trend, and was significantly lower than that of CS-GO group (P<0.01); IC50 of CS-GO-oridonin was 32.61 μg/mL. After CS-GO treatment, the cell morphology did not change significantly; after CS-GO-oridonin treatment, the cells shrunk and fell off in clusters, and the suspended matter increased; the fluorescence of oridonin and CS-GO-orionin taken up by cells was enhanced than CS-GO. Compared with blank group, there was no significant change in the apoptosis rate, the content of ROS and the expression of apoptosis-related protein in 16, 32, 64 μg/mL CS-GO groups (P>0.05); apoptosis rate, the content of ROS, the protein expression of Bax and Bak in 16, 32, 64 μg/mL CS- GO-oridonin groups were increased significantly, while the protein expression of Mcl-1 were decreased significantly. Above indexes were significantly higher or lower than the same concentration CS-GO group (P<0.05). CONCLUSIONS: CS-GO dose not affect the proliferation and apoptosis of A549 cells; CS-GO-oridonin has obvious inhibition and apoptosis promoting effect on cells, which may be related to increasing ROS production and regulating the expression of apoptosis related proteins.
KEYWORDS Chitosan graphene oxide carrier; Oridonin; A549 cells; Proliferation; Apoptosis
肺癌是全世界最常见的肿瘤之一,是多因素、多基因共同作用所导致的恶性肿瘤[1-2]。目前,对于肺癌患者的临床治疗,西医一般采用手术切除、放疗、化疗等方法。而对于大部分不适合手术切除的实体肿瘤患者,化疗常被作为其首选治疗方法,但化疗的毒副作用较大,导致患者常会出现恶心呕吐等毒副反应、生存质量明显下降[3-4]。中医药在治疗慢性疾病和疑难杂症方面有独特优势,且毒副作用较少;同时,中药联合化疗可有效改善患者的生存质量,降低其恶心呕吐的发生率,疗效好且安全可靠[5-6]。由此可见,中西医结合可在肺癌治疗领域中发挥重要作用,已成为目前学者关注的热点之一[5]。
冬凌草甲素(oridonin)是从唇形科植物碎米桠Rabdosia rubescens(Hemsl.)Hara中分离得到的一种贝壳杉烷类二萜化合物,具有较强的抗肿瘤活性,对多种肿瘤细胞均有显著的抑制或杀伤作用[7-8]。但由于该化合物水溶性差、生物利用度低等原因,使得其临床应用受到一定的限制[9]。因此,若能克服上述不足,则将有助于该化合物在抗肿瘤领域的进一步应用。有研究表明,适宜的药物载体可明显提高冬凌草甲素的生物利用度[10]。氧化石墨烯(graphene oxide,GO)是石墨烯经氧化超声处理后所得的产物,其结构表面和边缘都存在含氧官能团,其中的氧原子易与水形成氢键,能很好地分散于水中,从而增加药物的亲水性;同时,GO表面积大、载药量高、表面含氧官能团丰富且结构易于修饰,是一种很好的药物载体[11]。壳聚糖(chitosan,CS)的结构中有许多氨基和羟基,具有生物相容性和生物降解性好、无毒性等独特优势[12]。CS修饰GO得到的CS-GO载体具有良好的水溶性和生物相容性,可用于负载抗肿瘤药物[13]。基于此,本研究利用CS-GO作为载体负载冬凌草甲素(即CS-GO-oridonin),初步考察其对人肺癌细胞A549增殖、凋亡的影响以及可能机制,为该化合物新型抗肿瘤制剂的研发提供理论和技术支持,为肺癌的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括SQP JP-04型电子天平[赛多利斯科学仪器(北京)有限公司]、HWCL-3型磁力搅拌器(郑州长城科工贸有限公司)、TGL-16M型离心机(湖南湘仪实验室仪器开发有限公司)、Epsilon 2-4型冷冻干燥机(德国LSC Christ公司)、KQ3200B型超声波清洗器(昆山市超声仪器有限公司)、SW-CJ-1D型超净工作台(苏州智净净化设备有限公司)、BSC-1300ⅡB2型生物安全柜[西班泰克净化设备(苏州)有限公司]、311型CO2恒温培养箱和F3型移液器(美国Thermo Fisher Scientific公司)、DMIL LED型倒置荧光显微镜(德国Leica公司)、AMR-100型酶标仪(杭州奥盛仪器有限公司)、NovoCyte型流式细胞仪(美国Agilent公司)、Tanon-5200型全自动化学发光分析仪(上海天能科技有限公司)等。
1.2 主要药品与试剂
冬凌草甲素对照品(批号MUST-19011510,纯度99.64%)购自成都曼思特生物科技有限公司;GO(厚度0.8~1.2 nm,单层)购自南京先丰纳米材料科技有限公司;CS(乙酰度87.2%,分子量161.1 Da)购自南通兴成生物制品厂;透析袋(截留分子量14 000 Da)购自北京白鲨易科技有限公司;F12K培养基、胎牛血清(批号分别为21127-022、10270-106)均购自美国Gibco公司;磷酸盐缓冲溶液(PBS,pH 7.4)、0.25%胰蛋白酶、CCK-8试剂、流式细胞仪专用binding buffer、兔髓样细胞白血病1(Mcl-1)多克隆抗体、兔Bax多克隆抗体、兔Bak多克隆抗体、兔甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号分别为C1741、C1812、C1706、CY1698、202009、202008、202009、202009、202008)均购自武汉贝茵莱生物科技有限公司;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒(批号556547)购自美国BD公司;FITC试剂(货号46950)购自美国Sigma公司;2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)、活性氧(ROS)检测试剂盒(货号均为S0033)均购自碧云天生物技术有限公司;蛋白质Marker(批号P12103)购自美国Helix公司;抗荧光萃灭封片剂[含4′,6-联脒-2-苯基吲哚(DAPI)]、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、BCA蛋白浓度测定试剂盒(批号分别为S2110、S8010、T8090、PC0020)均购自北京索莱宝科技有限公司;聚偏二氟乙烯(PVDF)膜、电化学发光(ECL)试剂(批号分别为IPVH00010、1930802)均购自美国Millipore公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
人肺癌细胞A549来源于中国科学院上海细胞库/干细胞库。
2 方法
2.1 CS-GO、CS-GO-oridonin的制备
称取GO适量,加水超声使分散均匀并定容,制得GO质量浓度为2 mg/mL的分散液。取CS適量,加入2%醋酸溶液,于室温下搅拌6 h至完全溶解并定容,制得CS质量浓度为2 mg/mL的溶液。将上述GO分散液和CS溶液等体积混合,于室温下搅拌72 h后,以13 700×g离心30 min;取沉淀,用大量2%醋酸溶液洗涤(以除去未反应完全的CS)后,于4 ℃下以水透析72 h(白天每3 h换水1次,晚上每9 h换水1次),冷冻干燥后即得CS-GO[14]。称取冬凌草甲素对照品适量,用乙醇溶解后,与用水分散的CS-GO按质量比1 ∶ 1混合并在室温下搅拌24 h,即得CS-GO-oridonin(每克产物含冬凌草甲素0.428 g)。
2.2 细胞培养
将A549细胞接种于含10%胎牛血清的F12K培养基(以下简称“完全培养基”),置于37 ℃、5%CO2培养箱中培养(培养条件下同),待细胞生长至融合时,以0.25%胰蛋白酶消化,继续培养,待细胞生长至对数期时进行后续实验。
2.3 CS-GO-oridonin对A549细胞抑制作用的考察
采用CCK-8法进行检测。收集“2.2”项下对数期细胞,以完全培养基重悬制成细胞悬液,按5×103 mL-1接种于96孔板中,每孔180 ?L,培养过夜。待细胞贴壁后,将其随机分为空白组、CS-GO不同质量浓度组(3、6、12、24、48 μg/mL,以CS-GO的整体质量计,下同)、CS-GO-oridonin不同质量浓度组(3、6、12、24、48 μg/mL,以冬凌草甲素计[10],下同),每组设6个复孔。空白组加入含2%胎牛血清的F12K培养基180 μL,其余各组加入含相应质量浓度CS-GO空白载体或CS-GO-oridonin,再加入2%胎牛血清的F12K培养基180 μL;同时,设置仅含完全培养基的凋零孔。各组细胞继续培养24 h后,每孔加入CCK-8试剂20 μL,继续培养4 h;使用酶标仪于450 nm波长处测量各孔的光密度(OD)值,计算细胞存活率[细胞存活率=(检测组细胞OD值-调零孔细胞OD值)/(空白组细胞OD值-调零孔细胞OD值)×100%],并通过SPSS 22.0软件计算CS-GO-oridonin的半数抑制浓度(IC50)。
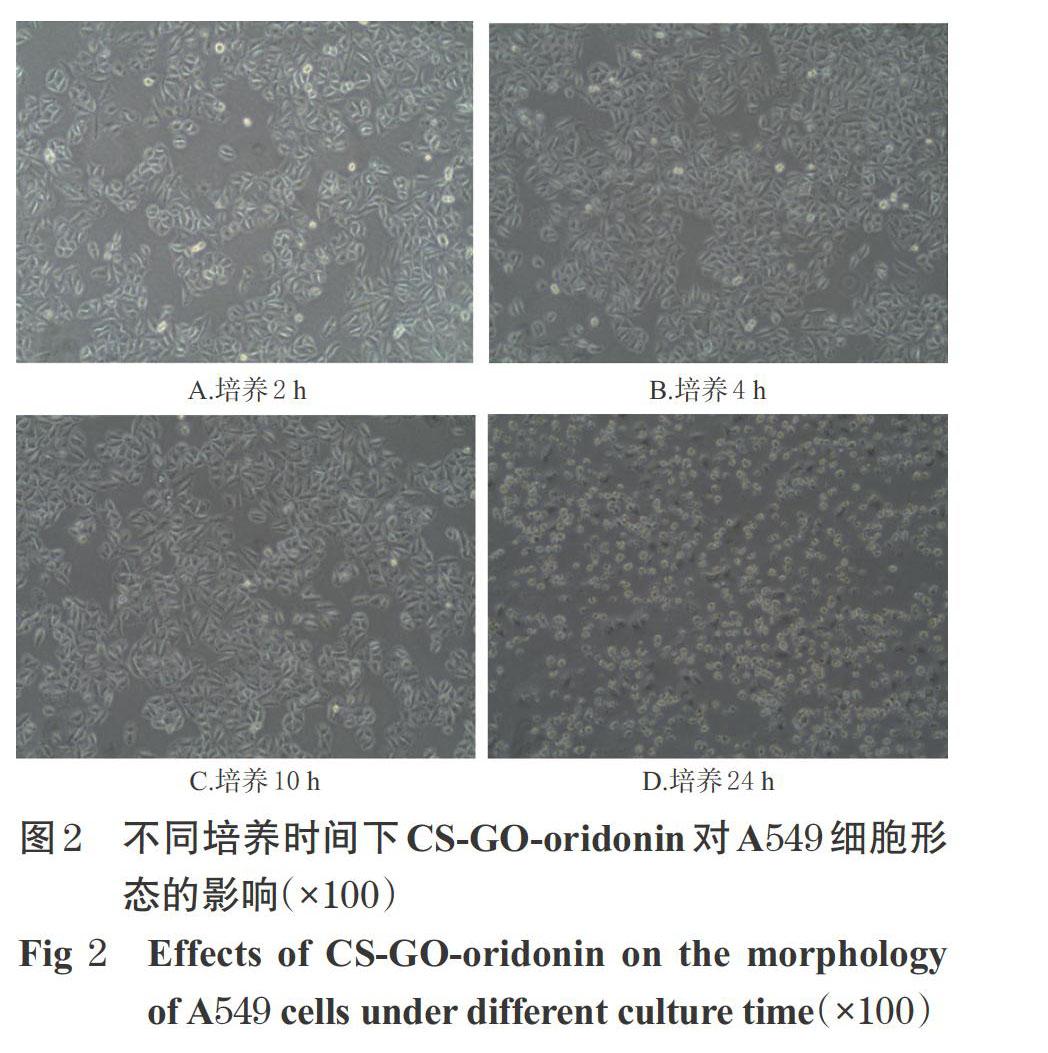
2.4 CS-GO-oridonin对A549细胞形态的影响观察
收集“2.2”项下对数期细胞,以完全培养基重悬制成细胞悬液,按5×103 mL-1接种于96孔板中,每孔180 ?L,培养过夜。待细胞贴壁后,分别加入含相应质量浓度CS-GO空白载体或CS-GO-oridonin(32 ?g/mL,质量浓度按“2.3”项下所得IC50设置),再加入2%胎牛血清的F12K培养基180 μL,分别培养2、4、10、24 h。于上述时间点取细胞适量,用PBS洗涤3次,置于倒置荧光显微镜下观察其形态并拍照。
2.5 CS-GO-oridonin被A549细胞摄取情况观察
取适量CS-GO、冬凌草甲素、CS-GO-oridonin分散在PBS中,加入适量FITC试剂,在避光条件下磁力搅拌12 h。将上述溶液以13 700×g离心30 min,收集离心管中的下层沉淀,并用PBS多次洗涤,直至上清液中不含游离FITC,即得FITC荧光标记的CS-GO、冬凌草甲素、CS-GO-oridonin。取“2.2”项下对数期细胞,以完全培养基重悬制成细胞悬液,按5×103 mL-1接种于96孔板中,每孔180 ?L,培养过夜。待细胞贴壁后,分别加入含相应质量浓度且经FITC标记的CS-GO空白载体或冬凌草甲素或CS-GO-oridonin(质量浓度同“2.4”项),再加入2%胎牛血清的F12K培养基180 μL,于37 ℃孵育4 h;用PBS冲洗3次,置于4%多聚甲醛溶液中室温固定30 min;用PBS冲洗3次,弃去PBS后,加入抗荧光淬灭封片液(含DAPI)50 μL,反应15 min后,置于倒置荧光显微镜下观察其摄取情况并拍照。
2.6 CS-GO-oridonin对A549细胞凋亡的影响考察
采用Annexin V-FITC/PI双染法以流式细胞仪进行检测。取“2.2”项下对数期细胞,以完全培养基重悬制成细胞悬液,按5×103 mL-1接种于96孔板中,每孔180 μL,培养过夜。待细胞贴壁后,将其随机分为空白组、CS-GO不同质量浓度组(16、32、64 μg/mL)、CS-GO-oridonin不同质量浓度组(16、32、64 μg/mL,以冬凌草甲素计,质量浓度按“2.3”项下所得IC50的1/2、1、2倍设置)。空白组加入含2%胎牛血清的F12K培养基2 mL,其余各组加入含相应质量浓度CS-GO空白载体或CS-GO- oridonin,再加入2%胎牛血清的F12K培养基2 mL,继续培养24 h;弃去培养基,以PBS清洗后,用0.25%胰蛋白酶消化,吸除多余的胰蛋白酶消化液;加入完全培养基轻轻吹打并收集细胞,以1 000×g離心5 min,弃去上清液,收集细胞,用PBS轻轻重悬细胞并计数。取5万~10万个重悬的细胞,于4 ℃下以1 000×g离心5 min,弃去上清液;加入预冷PBS 1 mL,轻轻振荡使细胞悬浮,于4 ℃下以1 000×g离心5 min,弃去上清液,再次重复此过程2次。将上述处理后的细胞重悬于binding buffer 200 μL中,依次加入Annexin V-FITC试剂和PI试剂各10 μL,轻轻混匀,于4 ℃下避光孵育30 min;再加入binding buffer 300 μL,用流式细胞仪检测细胞总凋亡率(细胞总凋亡率=早期凋亡率+晚期凋亡率)。
2.7 CS-GO-oridonin对A549细胞中ROS含量的影响考察
收集“2.2”项下对数期细胞,按“2.6”项下方法分组(每组设3个复孔)、给药。细胞培养5 h后,将其重悬于DCFH-DA溶液(用无血清的F12K培养基稀释至DCFH-DA终浓度为10 μmol/L)1 mL中,调整细胞密度为1×106 mL-1,于37 ℃下孵育20 min(每隔3 min颠倒混匀1次),使DCFH-DA探针和细胞充分接触。孵育结束后,用无血清F12K培养基洗涤细胞3次,以充分去除未进入细胞内的游离DCFH-DA。收集各组细胞,用PBS 500 μL重悬,调整细胞密度为1×106 mL-1,使用流式细胞仪检测细胞中ROS的含量。
2.8 CS-GO-oridonin对A549细胞中的Mcl-1、Bax、Bak蛋白表达水平的影响检测
采用Western blot法进行检测。收集“2.2”项下对数期细胞,按“2.6”项下方法分组(每组设3个复孔)、给药。细胞培养24 h后,提取其蛋白并采用BCA法测定蛋白浓度。将蛋白置于沸水浴中10 min使变性,取变性蛋白20 μg,进行SDS-聚丙烯酰胺凝胶电泳分离。电泳后,蛋白以湿转法转移至PVDF膜上,以5%脱脂奶粉室温封闭1 h;加入Mcl-1、Bax、Bak、GAPDH一抗(稀释度均为1 ∶ 1 000),4 ℃孵育过夜;用PBST溶液洗涤5 min×3次,加入HRP标记的IgG二抗(稀释度为1 ∶ 10 000),室温孵育1 h;用PBST溶液洗涤5 min×3次,以ECL显色,于全自动化学发光分析仪上成像。使用Tanon GIS 4.2软件分析各蛋白条带灰度值,以目标蛋白与内参GAPDH条带的灰度值比值作为目标蛋白的表达水平。
2.9 统计学方法
用Graphpad Prism 6.0软件对数据进行统计分析。数据以x±s或x表示,组间比较采用单因素方差分析。检验标准α=0.05,P<0.05表示差异具有统计学意义。
3 结果
3.1 CS-GO-oridonin对A549细胞的抑制作用
当培养时间为24 h时,不同质量浓度CS-GO组细胞的存活率均在90%以上;而不同质量浓度CS-GO-oridonin组细胞的存活率均较空白组显著降低,且显著低于同质量浓度CS-GO组(P<0.01),且CS-GO-oridonin 48 μg/mL组细胞的存活率仅为(27.12±0.01)%,详见表1。CS-GO-oridonin的IC50值为32.61 μg/mL。
3.2 CS-GO-oridonin对A549细胞形态学的影响
以CS-GO培养至24 h时,细胞形态仍保持正常,且形态饱满、均一性好,详见图1。以CS-GO-oridonin培养至24 h时,细胞出现了皱缩、不规则现象,且可见其成团脱落、悬浮状的现象增多,详见图2。
3.3 CS-GO-oridonin被A549细胞摄取的情况
CS-GO、冬凌草甲素和CS-GO-oridonin被A549细胞摄取情况的显微图见图3(图中,DAPI表示染色后呈蓝色荧光的细胞核,FITC表示被细胞摄取后呈绿色荧光的CS-GO空白载体或冬凌草甲素或CS-GO-oridonin,Merge表示两者叠加)。由图3可见,当细胞摄取CS-GO后,其荧光较弱;而当细胞摄取冬凌草甲素、CS-GO-oridonin后,其荧光均有所增强。
3.4 CS-GO-oridonin对A549细胞凋亡的影响
CS-GO-oridonin 16、32、64 μg/mL组细胞的凋亡率均显著高于空白组(P<0.01),且显著高于同质量浓度CS-GO组(P<0.01),详见图4、表2。
3.5 CS-GO-oridonin对A549细胞中ROS含量的影响
CS-GO-oridonin 16、32、64 μg/mL组细胞中ROS含量均显著高于空白组(P<0.01),且显著高于同质量浓度CS-GO组(P<0.01),详见表2。
3.6 CS-GO-oridonin对A549细胞中Mcl-1、Bax、Bak蛋白表达水平的影响
CS-GO-oridonin 16、32、64 μg/mL组细胞中Mcl-1蛋白的表达水平均显著低于空白组,且显著低于同浓度CS-GO组(P<0.01);Bax、Bak蛋白的表达水平均显著高于空白组,且显著高于同质量浓度CS-GO组(P<0.05或P<0.01),详见图5、表3。
4 讨论
本研究通过CCK-8法检测不同质量浓度CS-GO- oridonin对A549细胞存活率的影响,发现其对细胞均有抑制作用,且随着其质量浓度的提高,细胞存活率有逐渐降低的趋势;同时,各CS-GO-oridonin组细胞的存活率均显著低于同质量浓度CS-GO组,表明CS-GO负载等质量冬凌草甲素后可以有效抑制A549细胞的生长。此外,本研究通过CCK-8法得出CS-GO-oridonin的IC50为32.61 μg/mL,故参考該值,以32 μg/mL作为细胞形态学研究、摄取实验的CS-GO-oridonin的实验浓度;同时,以该质量浓度作为细胞凋亡率、细胞中ROS含量及相关蛋白表达水平检测的中间浓度,再将其1/2、2倍作为低、高浓度(16、64 μg/mL)。
本研究结果显示,以32 μg/mL的CS-GO空白载体培养A549细胞24 h后,细胞存活率仍在90%以上,且细胞形态仍保持正常;而载药后的CS-GO-oridonin(32 μg/mL)对细胞形态的影响较大,提示CS-GO负载的oridonin对A549细胞有杀伤作用,使其形态发生了变化。细胞摄取情况观察结果显示,CS-GO(32 μg/mL)、冬凌草甲素(32 μg/mL)、CS-GO-oridonin(32 μg/mL)均能进入A549细胞的细胞核中,且后两者的荧光较CS-GO有所增强,提示冬凌草甲素被CS-GO载体负载后,能被细胞摄取并集中于细胞核内;但CS-GO-oridonin被摄取后的荧光强度弱于冬凌草甲素,提示其靶向性有待进一步确认。
细胞死亡的主要机制是通过细胞凋亡实现的,凋亡是指由基因调控的细胞程序性死亡[15]。细胞凋亡失调发生在各种肿瘤细胞中,这使得肿瘤细胞难以被杀伤,因此激活凋亡途径或抑制抗凋亡途径的药物均具有治疗肿瘤的潜力[16]。在本研究中,不同质量浓度CS-GO-oridonin组细胞的凋亡率均显著高于空白组,且亦显著高于相同质量浓度CS-GO组,说明CS-GO-oridonin可诱导A549细胞的凋亡。
有研究表明,提高肿瘤细胞中ROS水平可有助于药物抗肿瘤作用的发挥,ROS水平的增加又可增强肿瘤细胞对药物的敏感性,从而调节细胞内相关通路信号转导、调控凋亡蛋白表达、诱导细胞周期阻滞、增强细胞内氧化应激、诱导肿瘤细胞凋亡、提高肿瘤细胞对其他化疗药物的敏感性,最终发挥抗肿瘤作用[17]。在A549细胞凋亡过程中,相关凋亡蛋白发挥着重要作用:Bax具有促进凋亡作用,是细胞凋亡通路的重要组成部分[18];Bak可以诱导线粒体碎裂和细胞色素C释放,刺激Bax的表达[19]。Mcl-1蛋白主要定位于线粒体外膜,其在细胞的分化、诱导凋亡中起着重要的作用,可将Mcl-1作为肿瘤治疗的新靶点;其主要作用機制如下:在细胞毒制剂等诱导细胞凋亡的条件下,其可通过螯合促凋亡蛋白Bax/Bak而抑制肿瘤细胞凋亡,还可与增殖细胞核抗原相互作用来调控细胞的分化过程[20-23]。本研究经CS修饰GO得到CS-GO载体,再经CCK-8法证实此载体安全性高;负载冬凌草甲素后,CS-GO-oridonin对A549细胞的增殖有抑制作用,并能诱导细胞凋亡;通过检测细胞中ROS含量以及Mcl-1、Bax、Bak蛋白表达水平的变化情况推测,CS-GO-oridonin诱导A549细胞凋亡的机制可能是通过促进细胞中ROS的产生,同时通过下调Mcl-1蛋白并上调Bax、Bak蛋白的表达,从而实现对A549细胞的杀伤作用。
综上所述,CS-GO不会影响A549细胞的增殖及凋亡;CS-GO-oridonin对A549细胞有一定的抑制和促凋亡作用,其机制可能与促进细胞中ROS的产生以及调控相关凋亡蛋白的表达有关。本研究为冬凌草甲素抗肿瘤制剂的开发提供了参考,为进一步探讨CS-GO-oridonin的抗肿瘤作用机制奠定了基础。后续本课题组将借助网络药理学技术,重点挖掘该制剂诱导A549细胞凋亡的潜在作用机制。
参考文献
[ 1 ] 王永富,秦治尹.紫杉醇对肺癌细胞株A549 Wnt/β-catenin信号通路相关基因和蛋白表达的影响[J].中国药房,2012,23(45):4233-4235.
[ 2 ] 吴玉梅,张玉梅,焦鹏,等. Akt抑制剂MK-2206对肺腺癌A549细胞增殖和凋亡的影响[J].中国药房,2016,27(1):38-41.
[ 3 ] 唐倩倩,王云飞,聂勇战,等.贝母素乙对5种肿瘤细胞的化疗增敏作用研究[J].中国药房,2017,28(34):4797- 4800.
[ 4 ] 苏兆田.中药益肺平癌方联合化疗治疗晚期非小细胞肺癌的效果探析[J].当代医药论丛,2017,15(5):31-32.
[ 5 ] 章宁静,李琪,高天,等. 301例肺癌患者中药处方回顾性分析[J].亚太传统医药,2018,14(3):202-204.
[ 6 ] 王金宝.中药联合化疗治疗晚期肺癌的临床疗效观察[J].数理医药学杂志,2018,31(6):871-873.
[ 7 ] 刘艺,郭金兴.冬凌草甲素抑制人宫颈癌HeLa细胞生存、迁移、侵袭的活性研究[J].世界科学技术(中医药现代化),2020,22(9):3328-3334.
[ 8 ] LI J J,WU Y H,WANG D,et al. Oridonin synergistically enhances the anti-tumor efficacy of doxorubicin against aggressive breast cancer via pro-apoptotic and anti-angiogenic effects[J]. Pharmacol Res,2019,146:104313.
[ 9 ] 阎学斌,雷萌,张建业,等.冬凌草甲素葡萄糖苷的合成[J].有机化学,2005,25(2):222-224.
[10] 徐志远,李永军,史萍,等.功能化石墨烯负载冬凌草甲素抗肿瘤制剂的研究[J].有机化学,2013,33(3):573-580.
[11] 俞文英,马建琦,方杰,等.冬凌草甲素聚乙二醇功能化氧化石墨烯纳米粒的制备及抗结肠癌实验研究[J].中草药,2017,48(19):3954-3960.
[12] GIANNAKAS A,PATSAOURA A,BARKOULA N M, et al. A novel solution blending method for using olive oil and corn oil as plasticizers in chitosan based organoclay nanocomposites[J]. Carbohydr Polym,2017,157:550-557.
[13] BAO H,PAN Y,PING Y,et al. Chitosan-functionalized graphene oxide as a nanocarrier for drug and gene deli- very[J]. Small,2011,7(11):1569-1578.
[14] 蔡雪梅,王志萍,廖玉兰,等.壳聚糖修饰氧化石墨烯的制备及表征[C]//世界中医药学会联合会.2018年中国中药制剂大会暨世界中医药学会联合会中药新型给药系统专业委员会第九届学术年会/世界中医药学会联合会中药药剂专业委员会第十三届学术年会/中华中医药学会制剂分会第十九届学术年会大会论文集.南昌:世界中医药学会联合会中药新型给药系统专业委员会,世界中医药学会联合会中药药剂专业委员会,中华中医药学会制剂分会,2018:1128-1137.
[15] 刘翀,蒋晓梅.白屈菜红碱对人结直肠癌细胞凋亡的影响及其机制研究[J].中国现代应用药学,2019,36(24):3034-3039.
[16] GAO C,ZHOU Y,LI H,et al. Antitumor effects of bai- calin on ovarian cancer cells through induction of cell apoptosis and inhibition of cell migration in vitro[J]. Mol Med Rep,2017,16(6):8729-8734.
[17] 孟路华,冯蕾,刘振.天然产物通过增加活性氧抗肿瘤的研究进展[J].中国药房,2019,30(8):1148-1152.
[18] 韩何丹,杜月梅,刘云帆,等.枸杞多糖联合顺铂对人肺腺癌细胞A549氧化损伤及凋亡的影响[J].食品科学,2020,41(15):194-200.
[19] PE?A-BLANCO A,GARC?A-S?EZ A J. Bax,Bak and beyond-mitochondrial performance in apoptosis[J]. FEBS J,2018,285(3):416-431.
[20] 陈文娟,袁长吉,刘念,等.抗凋亡基因Mcl-1的研究进展[J].吉林医学,2010,31(5):669-672.
[21] 陈玮姗. Mcl-1蛋白在结肠癌组织中的表达变化情况及临床治疗指导价值研究[J].吉林医学,2019,40(12):2784-2785.
[22] 王霞,王培源,吴淑华,等.口腔癌肿瘤出芽与VEGFC的表达及淋巴结转移的相关性研究[J].实用口腔医学杂志,2012,28(5):610-613.
[23] 邬腊梅,方征宇,杨宏宇,等.尿路上皮癌胚抗原1(UCA1)在舌鳞癌中的表达及意义[J].中国口腔颌面外科杂志,2013,11(6):491-494.
(收稿日期:2020-12-11 修回日期:2021-05-11)
(编辑:张元媛)

