转基因大穗小麦与受体小麦差异基因的初步研究
李 静 李艳红 陆雪莹 张志强 吴思雅
(1.新疆轻工职业技术学院食品与生物技术分院 新疆乌鲁木齐 830021;2.新疆师范大学生命科学学院 新疆乌鲁木齐830054;3.中国科学院新疆理化技术研究所干旱区植物资源化学重点实验室 新疆乌鲁木齐 830011)
优良品种是现代农业生产的重要基础,小麦(Triticum aestivum L)作为世界上第一大粮食作物,是人类最主要的食物来源。转基因大穗小麦是本实验室采用花粉管通道法将大赖草总DNA导入受体春麦761后获得的转基因小麦新株系,其具有大穗、多粒、大粒、高蛋白、抗黄萎病等优良变异[1]。缪军、王子霞等对大赖草、转基因大穗小麦及春麦761进行了RFLP、RAPD及SSR等一系列分析工作,从分子的角度证实了转基因大穗小麦中确实引入了供体大赖草的基因[2-3]。由于转基因大穗小麦是通过导入大赖草总DNA获得的,其在获得优良变异性状的同时,也引入了生长期延长、冬性化、分蘖数增加、株型分散等不利变异。为了去除不利变异基因,进一步获取优良性状基因片段,本文对转基因大穗小麦中导入的外源性DNA片段进行化学发光生物素探针标记Southern杂交检测分析,以期为后续小麦的遗传育种提供参考。
1 材料与方法
1.1 实验材料
转基因大穗小麦和春麦761幼苗叶片(将其同条件种植后幼苗长至5 cm~8 cm时,剪取幼嫩叶片作为实验材料);大赖草基因组总DNA为本实验室保存。
1.2 实验方法
1.2.1 基因组DNA的提取纯化
(1)提取。将植物幼嫩叶片样品分别加液氮依次磨碎,分别用CTAB法[4]抽提,经两次离心后,使用无水乙醇洗涤,真空抽干,在得到的DNA中加入2 mLl0 mmol/L的Tris·HCl(pH=8.0)充分溶解,于4 ℃保存。
(2)纯化。第一次纯化:向DNA溶液中加入RNA酶(RNase)(10 mg/mL),37 ℃保温30 min,加蛋白酶K使终浓度为100 μg/mL,37 ℃保温1 h,苯酚抽提两次,氯仿抽提一次;上清液分别过Sepharose 2B柱(柱长22 cm,直径2.4 cm),洗脱液为0.2 M NaCl、10 mmol/L Tris·HCl(pH=8.0),洗脱速度3 滴/min~4 滴/min,走纸6 cm/min,灵敏度2A;收集第一峰,乙醇沉淀,-20 ℃放置4 h以上,离心,真空抽干,10 mmol/L Tris·HCl溶解沉淀。第二次纯化:由于第一次过柱后,RNA峰和DNA峰分界不明显,认为仍然混有RNA,故又加入RNase,再过柱。
1.2.2 基因组总DNA电泳检测及紫外分光光度法定量测定
将提取的两种样品总DNA于1.2%Agarose、40 V电泳2 h[5],紫外灯下看条带是否清晰。分别取30 μL两种样品总DNA稀释至3 mL,蒸馏水对照,紫外分光光度计分别测OD260和OD280值。
1.2.3 化学发光生物素标记Southern杂交检测
(1)植物材料基因组总DNA的限制性双酶切。
取灭菌0.5 mL离心管,按照表1中所列配制反应液进行酶切反应,总体积为30 μL。37 ℃水浴锅中保育5 h,同时对作为对照的λDNA进行37 ℃保育2 h,BamHⅠ和HindⅢ双酶切。

表1 不同植物材料基因组总DNA限制性双酶切反应液配制量表
(2)酶切DNA的电泳分离及硝酸纤维素膜转印。
酶切DNA的电泳分离:酶切后的DNA样品与Marker一起进行1.2%琼脂糖凝胶电泳,紫外灯下观察结果。
酶切片段的原位变性及硝酸纤维素膜转印:变性,将凝胶上的双链DNA片段经过原位变性处理,使之成为单链;凝胶上的单链DNA片段经毛细管的虹吸作用,转移到硝酸纤维膜上,硝酸纤维膜真空80 ℃烘烤处理2 h固定,室温保存。
(3)生物素标记探针的制备。
对大赖草基因组DNA进行BamHⅠ和HindⅢ的限制性双酶切后,-20 ℃保存。探针的制备方法按照碧云天生物公司的《生物素随机引物DNA标记试剂盒操作说明书》,生物素标记好的DNA探针于-20 ℃保存。
(4)印迹杂交并放射自显影。
转印完毕且固定好的硝酸纤维素膜与制备好的生物素标记大赖草DNA探针进行杂交,清洗干净的杂交膜进行化学发光自显影检测,杂交检测生物素标记核酸探针的方法参照碧云天生物公司的《化学发光法生物素标记核酸检测试剂盒操作说明书》进行。
2 结果与分析
2.1 总DNA纯化结果与分析
提取植物材料总DNA的目的是要进行后续实验,做限制性双酶切、Southern杂交等,要求DNA纯度较高,将杂蛋白、多糖、RNA有效去除。残余的杂蛋白和多糖通过酚-氯仿进行多次抽提,然后用乙醚除去酚,之后再加入蛋白酶K来去除。而RNA的去除,起初认为过柱可以顺利将其除去,但过柱后,如图1所示,RNA峰和DNA峰分界不明显,认为溶液中仍然混有RNA,故又加入RNase,再次过柱后,如图2所示,RNA去除得较干净。
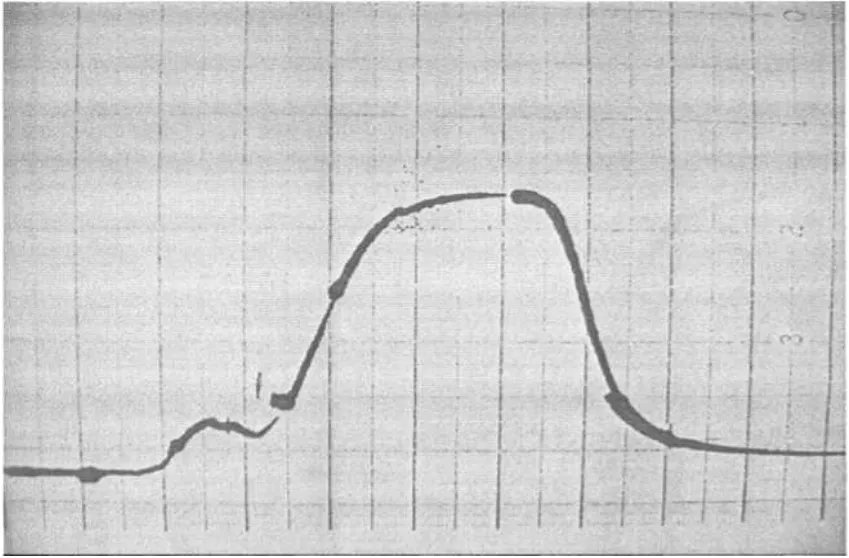
图1 总DNA Sepharose2B柱层析洗脱曲线图

图2 RNA酶解后总DNA Sepharose2B柱层析洗脱曲线图
2.2 总DNA电泳检测及紫外分光光度法定量测定结果与分析
总DNA电泳图(如图3)和紫外分光光度计定量测定结果(如表2)显示,利用CTAB法提取再过柱纯化得到的植物材料基因组总DNA的纯度较高,浓度达到了预期的值,满足限制性双酶切及Southern杂交等后续实验要求。

图3 总DNA电泳图

表2 总DNA的OD260和OD280值
2.3 总DNA的限制性双酶切结果与分析
对转基因大穗小麦和春麦761进行BamHⅠ和HindⅢ双酶切,将酶切的总DNA进行1.2%琼脂糖凝胶电泳,电泳的目的是将酶切后得到的不同长度的片段在凝胶上依次分开,然后把凝胶上分开的DNA片段原位转移到硝酸纤维素膜上。实验对高纯度的植物材料基因组总DNA和作为对照的λDNA进行BamHⅠ和HindⅢ双酶切后,电泳结果如图4所示,得到了长度合适的在凝胶上依次分开的DNA片段,为后续成功地将双酶切的DNA片段转移到硝酸纤维素膜上打下良好的基础。
对转基因大穗小麦和春麦761进行BamHⅠ和HindⅢ双酶切,将酶切的总DNA进行1.2%琼脂糖凝胶电泳,电泳的目的是将酶切后得到的不同长度的片段在凝胶上依次分开,然后把凝胶上分开的DNA片段原位转移到硝酸纤维素膜上。实验对高纯度的植物材料基因组总DNA和作为对照的λDNA进行BamHⅠ和HindⅢ双酶切后,电泳结果如图4所示,得到了长度合适的在凝胶上依次分开的DNA片段,为后续成功地将双酶切的DNA片段转移到硝酸纤维素膜上打下良好的基础。

图4 总DNA双酶切电泳图
2.4 化学发光生物素标记Southern杂交检测结果与分析
化学发光Southern杂交检测自显影后的X光胶片如图5所示,由图可知,杂交条带位于第四条泳道上,即转基因大穗小麦所在的泳道上,且只有唯一一条,而春麦761泳道上没有,经过和转膜前琼脂糖凝胶上的条带位置及Marker比对,条带大小约在750 bp~1 000 bp。

图5 Southern杂交化学发光自显影图
3 讨论与结论
20世纪90年代,花粉管通道法被广泛应用于转基因小麦的研究中[6]。本实验室采用与小麦同亚族的且具有多种小麦不具有的优良性状的大赖草总DNA对春麦761进行转化,获得了一系列的转基因新品系。分析研究转基因大穗小麦中大穗相关的功能基因对小麦品质育种具有重要意义[7]。本研究利用化学发光生物素标记大赖草总DNA探针对转基因大穗小麦和受体春麦761基因组DNA进行了Southern印迹杂交,产生了转基因大穗小麦和大赖草共有的而春麦761中没有的特异性DNA条带,实验结果显示该DNA片段长度约在750 bp~1 000 bp,推测它是大赖草总DNA导入受体春麦761之后在转基因大穗小麦中留下的DNA片段,即此片段来自大赖草基因组,为后续获取并研究该特异性外源DNA片段奠定了基础。

