脓毒性休克并发急性肾损伤危险因素分析
任娜,刘名胜,周森
海南医学院第二附属医院重症医学科,海口570311
急性肾损伤(AKI)是重症监护室(ICU)重症患者常见的合并症之一,其中42%~48%与脓毒症相关,尤其是脓毒性休克[1-3]。掌握脓毒性休克并发AKI的危险因素,早期识别潜在发生AKI患者并积极干预,对改善患者预后有非常重要的作用。脓毒性休克并发AKI的高发生率可能原因是对其病理生理学机制尚未完全理解,以及诊断的延迟[4]。脓毒性休克的主要特征是微循环障碍,且在大循环血流动力学障碍被纠正后,微循环仍然持续存在低灌注和细胞氧利用障碍,并与包括AKI在内的多器官功能障碍的发生密切相关[5]。因此,早期诊断并及早纠正微循环障碍已成为降低脓毒性休克患者多器官功能障碍发生率和病死率的关键。然而,目前临床上评价和监测微循环功能尚存在一定困难,缺乏简单而无创的客观工具[6-8]。本研究采用单因素分析法、多因素Logistic回归分析法分析脓毒性休克患者并发AKI的的影响因素及危险因素,以期为脓毒性休克并发AKI提供有效的预防手段,进而降低AKI的发病率。
1 资料与方法
1.1 临床资料 选取2019年1月—2021年1月海南医学院第二附属医院收治的154例脓毒性休克患者,男90例,女64例;年龄19~92(55.2±17.6)岁。纳入标准:①符合脓毒性休克的诊断(依据2016年2月欧洲重症医学会发布的Sepsis 3.0诊断标准[9]);②年龄≥18周岁;③自发病至进入ICU时间<6 h,且ICU停留时间≥48 h。排除标准:①进入ICU前已接受液体复苏者;②入ICU前已存在AKI或慢性肾脏病4~5期;③妊娠期或哺乳期妇女;④伴有严重低温、高位截瘫、大面积肺栓塞、外周动脉闭塞性疾病、雷诺综合征者;⑤伴有慢性器官衰竭或恶性肿瘤终末期者;⑥临床资料不完整、随访失访、放弃治疗者。本研究符合医学伦理学标准,且经本院伦理委员会批准。154例脓毒性休克患者按照是否并发AKI[采用2012年改善全球肾脏病预后组织制定的AKI诊断标准[10],即具备以下之一,且排除其他明确的非感染性原因所导致的AKI:①肾功能在48 h内急剧下降,表现为血肌酐(Scr)48 h内升高≥26.5μmol/L或Scr上升至≥基础值的1.5倍;②尿量<0.5 mL/(kg·h)超过6 h]分为AKI组(114例)和非AKI组(40例)。
1.2 研究方法 收集纳入患者的一般临床资料和实验室检查指标。包括患者年龄、性别、体质量指数(BMI)、基础疾病、感染部位、脓毒症相关器官衰竭估计(SOFA)评分及入ICU第一个24 h的急性生理学和慢性健康状况评估Ⅱ评分(APACHEⅡ评分),复苏后6 h的平均动脉压(MAP)、心率(HR)、去甲肾上腺素(NE)剂量、每小时尿量以及24 h液体平衡和28 d存活情况,以及C-反应蛋白(CRP)、血乳酸(Lac)、血尿素氮(BUN)、Scr、降钙素原(PCT)和PPI{参照文献[7,11]方法,记录液体复苏前和液体复苏后6 h的PPI值,并计算外周灌注指数变化值(ΔPPI)}。
1.3 统计学方法 采用SPSS19.0统计软件。正态分布的计量资料以±s表示,组间比较采用两独立样本t检验;偏态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料以例数(%)表示,组间比较采用χ2检验。采用多因素Logistic回归分析法探讨脓毒性休克患者发生AKI的危险因素;绘制受试者工作特征曲线(ROC曲线),评估指标对脓毒性休克患者发生AKI的预测价值,计算ROC曲线下面积(AUC)及95%可信区间(95%CI),确定截断值,计算灵敏度、特异度、约登指数。P<0.05为差异有统计学意义。
2 结果
AKI组男性64例(56.1%)、女性50例(43.9%),年 龄(56.9±17.1)岁,BMI(24.8±3.8)kg/m2,SOFA评分(11.2±3.5)分,APACHEⅡ评分(25.0±7.8)分,高血压40例(35.1%)、糖尿 病19例(16.7%)、免疫系统疾病25例(21.9%)、慢性心衰17例(14.9%)、COPD 19例(16.7%)、恶性肿瘤23例(20.2%)、慢性肾病12例(10.5%)、慢性肝病8例(7.0%),肺部感染51例(44.7%)、泌尿系感染19例(16.7%)、腹腔感染39例(34.2%)、其他部位感染5例(4.4%),CRP(16.1±10.7)mg/L,Scr(107.4±35.1)μmol/L,BUN(8.0±3.9)mmol/L,Lac[2.0(1.6,3.1)]mmol/L,PCT[7.0(1.8,14.5)]μg/L,血培养阳性39例(34.2%),28 d死亡29例(25.4%),复苏后6 h的MAP(83.9±17.2)mmHg、HR(97.6±22.9)次/min、每小时尿量(0.8±0.7)mL/(kg·h)、NE剂量[0.4(0.2,1.0)]μg/(kg·min),24 h液体平衡[19.5(9.8,30.8)]mL/kg,复苏前PPI[1.4(0.4,3.3)]、复苏后6 h PPI[1.2(0.5,3.2)]、ΔPPI[0.1(-0.9,0.7)],无AKI组男性26例(65.0%)、女性14例(35.0%),年龄(50.4±18.2)岁,BMI(26.3±4.6)kg/m2,SOFA评分(7.6±3.1)分,APACHEⅡ评分(20.1±7.1)分,高 血 压12例(30.0%)、糖 尿 病8例(20.0%)、免疫系统疾病7例(17.5%)、慢性心衰4例(10.0%)、COPD 5例(12.5%)、恶性肿瘤4例(10.0%)、慢性肾病2例(5.0%)、慢性肝病3例(7.5%),肺部感染22例(55.0%)、泌尿系感染5例(12.5%)、腹腔感染10例(25.0%)、其他部位感染3例(7.5%),CRP(17.7±9.8)mg/L,Scr(98.2±28.5)μmol/L,BUN(7.5±3.4)mmol/L,Lac[1.7(1.3,2.2)]mmol/L,PCT[14.5(1.4,14.8)]μg/L,血培养阳性7例(17.5%),28 d死亡4例(10.0%),复苏后6 h MAP(92.1±25.9)mmHg、HR(90.0±20.3)次/min、每小时尿量(1.03±0.8)mL/(kg·h)、NE剂量[0.4(0.1,0.4)]μg/(kg·min),24 h液体平衡[17.9(5.7,26.3)]mL/kg,复苏前PPI[2.5(1.0,6.5)]、复苏后6 h PPI[5.6(3.2,8.9)]、ΔPPI[2.4(0.6,4.5)],两组年龄、BMI、SOFA评分、APACHEⅡ评分、Lac水平、复苏后6 h MAP、复苏后6 h HR、复苏后6 h每小时尿量、复苏后6 h NE剂量、复苏前PPI、复苏后6 h PPI、ΔPPI、24 h液体平衡、血培养阳性率、28 d病死率比较,P均<0.05。
对单因素分析有统计学意义的参数进行多因素Logistic回归分析,多因素分析显示,SOFA评分是脓毒性休克患者并发AKI的独立危险因素,ΔPPI水平升高是脓毒性休克患者并发AKI的保护因素(P均<0.05),详见表1。
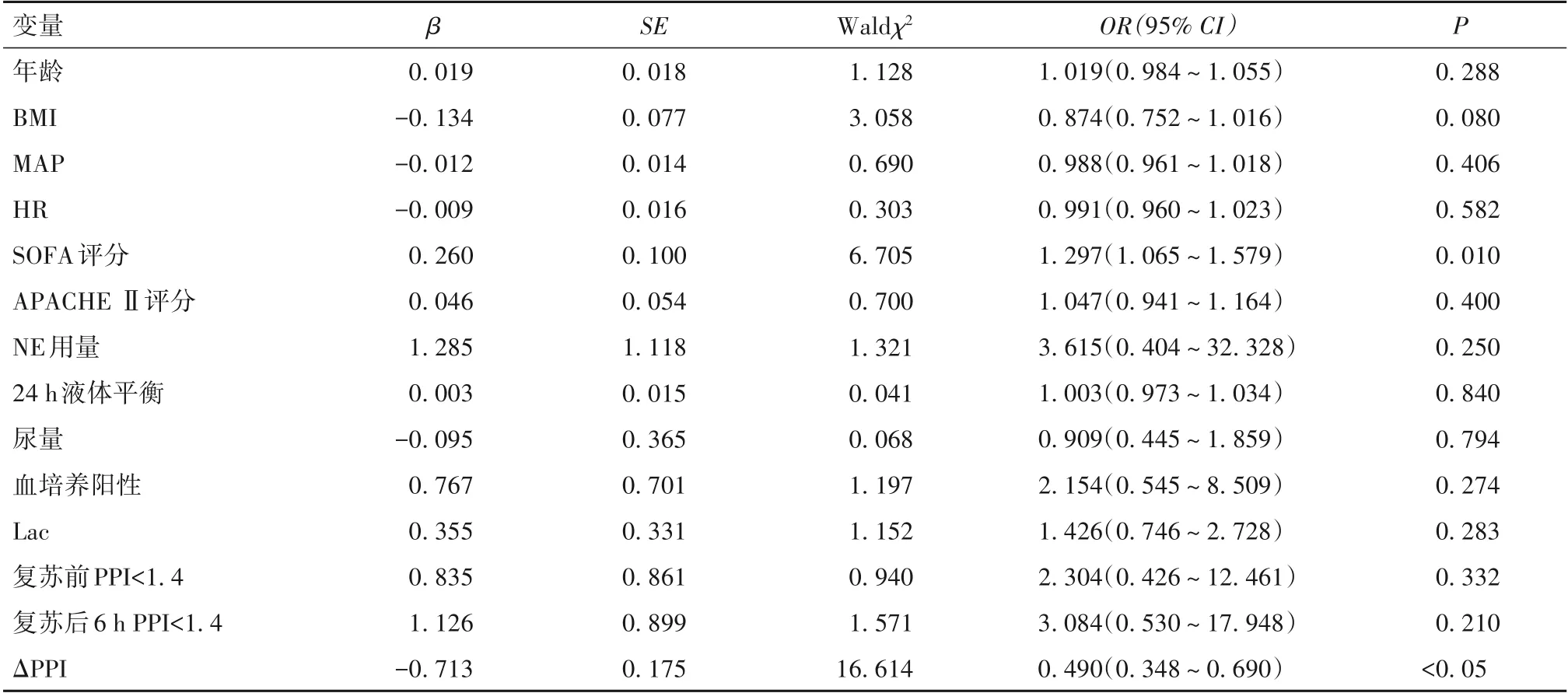
表1 脓毒性休克患者并发急性肾损伤危险因素分析结果
经ROC曲线分析显示,当SOFA评分截断值为8分时,约登指数最大(0.488),预测脓毒性休克患者并发AKI的灵敏度为76.3%,特异度为72.5%,SE为0.040,AUC(95%CI)为0.797(0.725~0.858),P<0.05;当ΔPPI截断值为0.91,约登指数最大(0.557),预测脓毒性休克患者并发AKI的灵敏度为80.7%,特异度为75.0%,SE为0.043,AUC(95%CI)为0.808(0.737~0.867),P<0.05。详见图1。
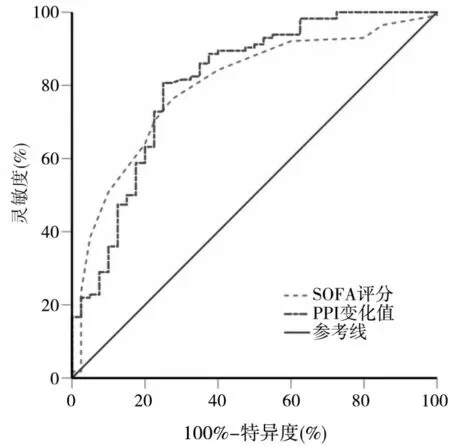
图1 SOFA评分、PPI变化值预测脓毒性休克并发AKI的ROC曲线
3 讨论
AKI是重症患者中常见的并发症之一,脓毒症是其最常见的病因,在脓毒性休克患者中发生率为55%~80%[1-2],并导致不良预后,病死率可升至49.4%[4]。本研究入选的154脓毒性休克患者中,114例(74.0%)患者发生不同程度的AKI,与既往报道[2]基本一致。本研究发现,AKI组患者28 d病死率明显高于无非AKI组,表明合并AKI的脓毒性休克患者具有较差的预后,应引起临床医生的重视。因此,明确脓毒性休克并发AKI的危险因素并早期识别潜在发生AKI患者,可为临床治疗方案的制定和预后评估提供参考依据。虽然脓毒症休克相关性AKI的发生机制复杂,常常涉及不同方面,至今尚未阐明,但目前较多学者已开展了关于通过提高血流量和灌注压两方面来改善肾灌注的研究[2,12]。MAP是推动血液通过器官的主要驱动压力,在组织灌注中起重要作用,也是反映组织灌注的指标之一。WONG等[13]发现,通过液体复苏或应用血管活性药物,脓毒症休克患者MAP由65 mmHg提高至85 mmHg,肾功能并未得到改善,Scr和尿量与对照组相比无统计学意义,该研究表明脓毒性休克相关性AKI的主要病理生理学特征是微循环障碍,且肾脏微循环障碍在宏循环障碍得到纠正后仍然持续存在,早期改善肾脏微循环灌注可以降低脓毒症休克相关性AKI发生率和病死率[8]。因此,早期评估并通过进一步调节优化宏循环,从而达到改善微循环障碍,已成为降低脓毒性休克患者包括AKI在内的多器官功能障碍发生率及病死率的关键。
本研究单因素分析显示,两组年龄、BMI、SOFA评分、APACHEⅡ评分、Lac水平、血培养阳性率、24 h液体平衡、复苏前PPI以及复苏6 h后的NE剂量、MAP、HR、尿量、PPI和ΔPPI有统计学差异;多因素分析显示,SOFA评分是脓毒性休克患者并发AKI的独立危险因素,ΔPPI水平升高是脓毒性休克患者并发AKI的独立保护因素。SOFA评分是反映器官衰竭程度的可靠指标,SOFA评分越高,往往提示器官衰竭严重程度越高,预后越差。董照刚等[14]发现,SOFA评分是脓毒症相关AKI发生的独立危险因素,与本研究结果一致。PPI是搏动组织例如波动小动脉血等与非搏动组织例如骨骼、肌肉、静脉血等吸收光量的比值,反映外周组织中小动脉的血流量情况,当外周组织灌注不足时,其水平降低,<1.4被认为是识别与危重患者血管收缩相关的外周血流灌注异常的临界值[7]。因此,PPI是一种简便无创、客观的评估外周组织灌注的良好指标,广泛应用于诊断脓毒性休克并指导液体复苏治疗和评估预后[15]。研究[8]已证实,肾脏微循环障碍在脓毒性休克相关性AKI的发生发展中起重要作用,且PPI能敏感地反映局部组织血流灌注情况,并与内脏组织器官微循环具有相关性,可以客观评价微循环功能[7-8]。本研究也发现,脓毒性休克相关性AKI的发生与ΔPPI独立相关,而与复苏前PPI或复苏6 h后PPI无关,表明单纯监测脓毒性休克患者某一时刻的PPI水平,尚不能准确反映机体组织微循环状态和对液体复苏等治疗的反应,从而与AKI的发生缺乏独立相关性。ΔPPI定义为液体复苏等治疗后6 h的PPI水平与最初阶段PPI水平相比后的升高程度,反映外周微血管对液体复苏的反应性能,其水平越高,说明液体复苏的效果越好,也反映肾脏组织血流灌注恢复越好。BRUNAUER等[16]认为,在脓毒症诊断的早期,宏观和微循环之间的血液动力学存在一致性,通过液体复苏等治疗纠正全身血液动力学紊乱改善了组织灌注和氧合,也能改善外周组织灌注,表明脓毒症患者早期皮肤血流灌注和内脏器官包括肾脏的血流灌注之间存在正相关性,通过监测液体复苏前后外周灌注变化能反映内脏器官血流灌注情况。此外MENEZES等[17]发现,脓毒性休克患者液体复苏治疗前外周灌注减少,PPI水平降低,并与病情严重程度密切相关;液体复苏治疗后,PPI水平升高越明显,继而发生器官衰竭的概率明显降低,且具有时间依赖性,液体复苏越早越充分,效果越好,表明脓毒性休克患者存在外周缺血储备,外周微血管对液体复苏反应性与内脏组织灌注之间存在线性关联,这与本研究结果一致。因此,外周灌注的持续异常在脓毒症诱导的多器官功能障碍的病理生理学中具有潜在作用,大循环流量与压力指标达标可能并不是脓毒性休克患者复苏的终点,应进一步评估外周灌注情况从而间接了解内脏器官的微循环灌注与细胞氧代谢,通过早期优化血流动力学达到恢复外周灌注才能降低多器官功能障碍发生率,从而改善不良预后。
由于脓毒性休克相关性AKI发病机制复杂,且严重程度和临床表现不一,尚缺乏诊断的金标准[18-19]。目前AKI诊断主要依据KDIG0指南中的AKI诊断和分期标准,该标准以Scr和尿量变化作为诊断和分期指标,而Scr易受多种因素影响,并非一个敏感指标;尿量也易受到尿路梗阻、利尿剂等因素的影响;因此,二者作为AKI诊断和分期指标仍然存在缺陷,不能及时准确地反映肾功能变化,且与AKI的病因缺乏相关性[12]。本研究结果显示,SOFA评分、ΔPPI预测脓毒性休克患者AKI的AUC分别为0.797、0.808,表明SOFA评分、ΔPPI对脓毒性休克患者AKI的发生有预测价值(P均<0.05)。因此,SOFA评分、ΔPPI可作为早期预测脓毒性休克患者发生AKI风险的筛选工具。
总之,SOFA评分、ΔPPI与脓毒性休克患者AKI的发生密切相关,且具有一定预测价值,可为AKI的早期预防及干预提供线索。但是本研究尚存在一些局限性:首先,本研究为单中心研究,纳入的病例数有限,剔除了部分不符合研究标准患者,不排除存在选择偏倚;其次,PPI数据被限制6 h内,未连续评估患者以避免治疗上所致的偏差。因此,PPI与脓毒性休克患者AKI的关系仍需多中心、扩大样本量进一步评价。

