早产儿氟康唑2D-HPLC血药浓度测定方法研究
王颖,曾含清,肖轶雯,原海燕,刘文辉,罗芝英*,王峰*(1.中南大学湘雅二医院药学部,长沙 410011;2.中南大学临床药理研究所,长沙 410011;.中南大学湘雅三医院药学部,长沙 410015)
氟康唑是新一代三唑类抗真菌药物,作为新生儿预防和治疗侵袭性真菌感染的一线用药,在临床广泛使用。但是最近有文献报道,常规给药方案会增加真菌定植的风险,并且可能导致新生儿重症监护室(neonatal intensive care unit,NICU)真菌感染率和耐药率上升[1-4];因此对新生儿氟康唑进行血药浓度监测(TDM),可以帮助临床判断预防用药时体内浓度及其浓度变化模型,评估氟康唑临床疗效,降低病房真菌感染率和耐药率。
新生儿与儿童、成人相比,体表面积更大、皮下脂肪组织更薄、血容量更少[5-6],考虑到患儿血常规、肝肾功能、感染指标测评等需要一定血样量,因此能供血药浓度监测的血样量很少;另外临床主要采用平卧位采血,患儿血容量多集中于躯干及内脏,足末梢的血循环相对较差,以致需要反复挤压或者多次穿刺获得血标本,这样不仅采血量不足,还增加了感染的风险[6-7]。因此建立微量血液的测定方法十分必要。
血药浓度测定属于临床检验范畴,评估及时性的标准指标为“检验结果回报时间”(turnaround time,TAT)。由于早产儿身体器官发育尚未完善,在肠内营养支持治疗条件下体重容易快速变化,从而导致药物动力学的变化;另外早产儿出生后会长时间住在 NICU,呼吸系统疾病、感染等病情隐匿性强且变化快,而一般血药浓度检测时间为3 h,因此快速的血药浓度报告对于缩短判断周期,即时调整用药方案十分重要。
近年来,全自动二维高效液相色谱法(automatic 2-dimensional high performance liquid chromatography,2D-HPLC)逐渐应用到血药浓度监测[8-10],本研究旨在研究氟康唑2D-HPLC 的各种条件,建立高灵敏度方法,降低血液样品体积需求,提高自动化,为早产儿氟康唑个体化用药提供适宜的监测技术,为临床医师用药提供参考。
1 仪器与试药
1.1 仪器
2D-LC-UV 系统由FLC 全自动二维液相色谱耦合仪(湖南德米特仪器有限公司)及岛津LC-20A 液相色谱部件构成,FLC 连接第一维色谱泵、第二维色谱泵、检测器、自动进样器等色谱模块;其中第一维色谱系统(LC1)完成样品富集及一维分离,第二维色谱系统(LC2)完成进一步分离检测,两维系统通过智能流路控制系统(TRS)连接,采用“中心切割”模式转移目标物,中间转移柱同时承担转移、拦截杂质的功能,工作站为Lab Solution 工作站,具体结构示意图见图1。GH-202 电子分析天平(AND,日本);XW-80A 漩涡震荡仪(上海琪特)。
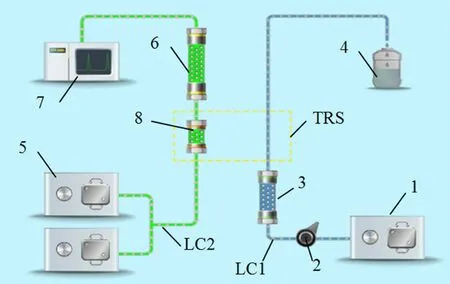
图1 全自动二维液相色谱工作原理示意图Fig 1 Schematic diagram for automatic 2D-HPLC
1.2 试药
氟康唑对照品(批号:100314-201204,含量:99.8%,中国食品药品检定研究院);甲醇、乙腈(色谱纯,ACS);磷酸、磷酸铵、三氟乙酸(分析纯,国药集团化学试剂有限公司);纯净水为纯水仪所制(不低于GB17323 执行标准)。
2 方法
2.1 色谱条件
第一维色谱柱采用Aston SNX1(氰基柱,3.5 mm×50 mm,5 μm,ANAX),流动相:V甲醇∶V水=64∶36,流速0.8 mL·min-1。第二维色谱柱采用Aston SBN(苯基柱,4.6 mm×250 mm,5 μm,ANAX),流动相:V水∶V甲醇∶V乙腈=54∶38∶8,流速1.0 mL·min-1;中间柱采用Aston SH4(苯基柱,4.6 mm×10 mm,3.5 μm,ANAX),辅助流动相为纯水,检测波长为209 nm,进样体积为200 μL。检测流程如表1所示。

表1 二维液相色谱条件设置-时间程序Tab 1 Time program for conditions in 2D-HPLC
2.2 溶液制备
2.2.1 对照品溶液的配制 准确称取氟康唑对照品66.02 mg,用纯水溶解后,定容至50 mL,配制成质量浓度为1320.36 μg·mL-1的氟康唑对照品储备液。精密吸取不同量氟康唑对照品储备液,加入10 mL 量瓶中,用空白血浆定容至刻度,得到质量浓度为54.08、135.20、338.01、845.03、2640.71、5281.42 ng·mL-1的系列线性溶液,保存在-20℃待用。
2.2.2 质控样品配制 精密吸取“2.2.1”项下氟康唑对照品储备液适量,加入到10 mL 量瓶中,用空白血浆定容至刻度,配制成高、中、低3 种质量浓度(4225.13、2112.57、211.26 ng·mL-1),取3 mL 分装到质控瓶中,保存在-20℃冰箱中。
2.3 血浆样品处理
准确吸取10%三氟乙酸去蛋白剂 600 μL 至1.5 mL EP 管中,再准确加入 200 μL 血浆样本,涡旋振荡1 min 后,高速离心(14 500 r·min-1)8 min,取650 μL 上层清液转移至进样瓶中,加入1 mol·L-1的碳酸铵水溶液65 μL 调节pH 值,涡旋混匀。
3 结果
3.1 系统适用性试验
取空白血浆(中南大学湘雅二医院提供)、患者血浆样品处理溶液及氟康唑对照品溶液按“2.1”项下色谱条件进样测定,结果见图2。氟康唑保留时间为11.7 min,目标物从第一维转移到第二维色谱系统,需要约3 min 的样品处理时间。氟康唑与杂质分离较好,血浆内源性物质及其他杂质均不干扰样品的分离测定。大多数样品中均发现存在与氟康唑较为接近的色谱峰(见图2C),是否为代谢物有待继续研究。
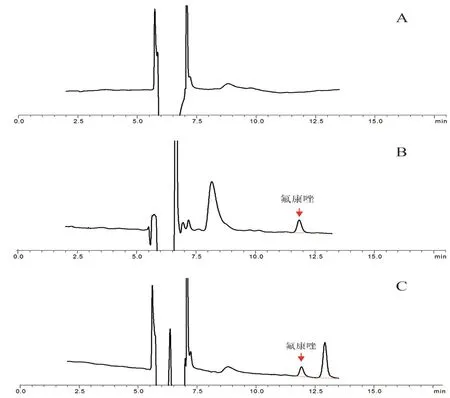
图2 系统适用性试验色谱图Fig 2 System suitability chromatogram
3.2 线性范围和定量限
取“2.2.1”项下系列线性溶液,按“2.1”项下方法检测。以氟康唑的峰面积(Y)对氟康唑质量浓度(X,ng·mL-1)进行线性回归,得回归方程为:Y=498.5X-3297.3,r=0.9999,氟康唑在54.08~5281.42 ng·mL-1与峰面积呈良好的线性关系,定量限为54.08 ng·mL-1,能够满足临床新生儿氟康唑血药浓度检测要求。
3.3 准确度和精密度
取“2.2.2”项下质控样品进行方法学准确度和精密度检测。每个浓度梯度设置5 个平行组,计算实际浓度,比较实际浓度与理论浓度得出方法回收率和变异系数,检验方法准确度和日内精密度。连续3 d 用相同方法配制并测定质控样品,考察检测方法日间精密度。建立的氟康唑分析的方法回收率在93.6%~102.7%,RSD<4.7%,日内、日间变异系数均小于5%。表明本法符合临床血药浓度监测检测的方法学要求。
3.4 提取回收率
取质量浓度为10 μg·mL-1的氟康唑对照品溶液(临用新配),用流动相稀释10 倍后作为对照,用空白血浆稀释10 倍,用同样的前处理方式沉淀样品,计算提取回收率。结果提取回收率为100.6%,RSD为4.6%(n=6),证明本法的提取回收率高且稳定。
3.5 稳定性试验
取“2.2.2”项下的质控样品,分别于室温放置24 h、反复冻融 3 次以及-20℃冰冻保存30 d 后测定样品浓度,结果RSD均小于5%,表明血浆中氟康唑稳定性良好。
3.6 临床应用
2018年1月—2019年1月,本 院NICU 对40 名住院患儿预防性地给予口服氟康唑3 mg/(kg·次),每3日给药一次,直至治愈出院。根据氟康唑药代动力学特征,患儿在第3 次给药时达到稳态血药浓度,于第3 次给药后,对所有患儿通过足底毛细血管采样,共收集120 个血液样本,2 mL 抗凝管全血采集后经 3000 r·min-1离心 10 min,取上清液,-70℃冻存待检。冻存样本化冻后,按“2.3”项下方法处理样品后,按“2.1”项下方法测定,每位患者测3 个血清样本,随行测定高、中、低质控样品。平均采样量为(647±12.3)μL。其中81 个样本血药浓度介于200~2000 ng·mL-1,占总样本量的67%;28个样本结果介于2000~4000 ng·mL-1,占总样本量的23%;11 个样本结果高于4000 ng·mL-1,占总样本量的10%。
4 讨论
4.1 光谱图
氟康唑的3D 光谱图显示(见图3),氟康唑在206 nm 及261 nm 有最大吸收波长,261 nm 吸收强度远小于206 nm。209 nm 虽然不是最大吸收波长,但可以明显减小色谱图基线的波动,考虑到209 nm 与206 nm 相差并不大,因此选择209 nm 波长作为检测波长。由于氟康唑在波长222 nm 处吸收出现下降,引起色谱图基线较大的波动,所以应当使用参比较正,但使用参比校正时发现209 nm 波长差减222 nm 波长强度,虽然改善色谱图基线状态,但并未有效改善色谱图基线状态,因此未采用此技术。
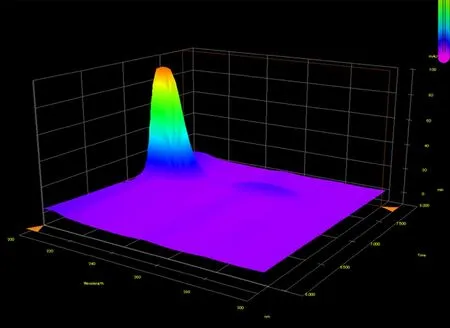
图3 氟康唑3D 图Fig 3 3D stereogram of fluconazole
4.2 样品在线处理能力
本研究应用的全自动二维液相色谱系统,通过在线萃取提高测定灵敏度,但一维色谱柱通常载样量具有一定上限,因此进样量过大的时候,会发生柱上扩散现象。本文提出“进样量线性区间(linear injection volume,LIV)”表达二维系统在线萃取的能力,进样量增加至200 μL 时,峰面积增加开始不成线性,400 μL 与500 μL 二维系统产生的峰面积并没有太大差别,因此本方法设定进样量为200 μL,与普通色谱20 μL 比较,灵敏度可以提高10 倍。
4.3 长光程样品池与灵敏度
本系统应用近年出现的长光程紫外样品池提高检测灵敏度,与普通样品池比较,紫外线通过全息反射到达传感器端,光程长达85 mm,而普通样品池仅有10 mm 光程,根据朗伯比尔定律,光程越长灵敏度更高。但为了不增加样品池体积,长光程管道体积很小,容易发生堵塞,因此使用时需要特别注意,每次用完后清洗色谱柱和替换流动相中间的盐。
图4显示空白血样添加10 μg·mL-1氟康唑的两种样品池检测色谱图,长光程样品池获得峰面积约为标准样品池的6.5 倍,很大程度地提高了样品的测定能力。
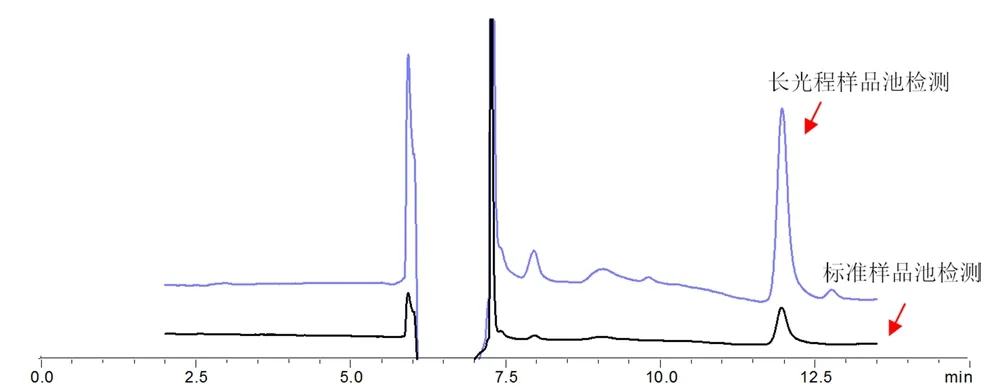
图4 长光程样品池与标准样品池的灵敏度Fig 4 Sensitivity of long path sample cells and standard sample cells
氟康唑血药浓度测定受到基质效应、多电荷现象与源内裂解的限制[11-12],内标修正上述技术缺陷,难以做到不同处理批使用同一校准曲线计算样品结果,尤其当不同条件测定方法交替、批数量过多、离子源劣化时,需要重新处理校准曲线,这样不仅需要更多的维护,也不具备足够的稳健性达到及时性要求;与HPLC 比较,紫外检测氟康唑灵敏度较低,需要复杂且耗时的前处理过程[13]。本方法开发的在线萃取、二维分离、长光程紫外检测以及光谱差减技术具有样品处理简单、分离过程自动以及检测稳定的特征,可达到早产儿血药浓度监测血样量需求小、报告及时的技术要求。
本研究分析并控制每个过程产生的时间消耗,通常早产儿足跟采血比成人静脉采血时间长,但也很少超过5 min;临床样品送达实验室时间与每个单位具体路线和程序有关,本院通常时间小于30 min;关键的时间消耗在实验室测定过程中产生,本研究采用新型2D-HPLC,利用稳定的光学检测系统,样品浓缩与分离自动完成,并标定了二维方法的转移特征,因此受环境温度变化、试剂纯度变化、样品复杂度变化影响小。本方法工作曲线可以长期使用,同时无需内标相关操作及每批定标操作,节省大量时间,可以在30 min 完成从测定系统启动到结果生成的过程。
目前,新生儿基于PK/PD 数据预防性使用氟康唑的经验十分有限。研究认为,氟康唑的稳态血药浓度应维持在2 mg·L-1以上,才能达到AUC/MIC为50 的临床预防效果[3]。笔者分析发现新生儿使用3 mg·kg-1,每周两次的给药方案后,仅33%的患儿氟康唑血药浓度在2 mg·L-1以上,结果提示氟康唑整体用药剂量不足,达到有效治疗浓度者不足1/3。因此,临床医师应可根据治疗药物监测结果,更密切地参与氟康唑临床用药,减少常规的经验用药和间接判断所致的不合理用药,减少不良反应,辅助精准医疗,降低住院费用,提升社会经济效益。

