芳香族氨基酸及其衍生物的研究进展
刘苹 苏卫卫

摘 要】 氨基酸是蛋白质的基本组成单元,氨基酸的缩合、衍生都与蛋白质的形成及功能相关。芳香族氨基酸作为机体重要的氨基酸,生物学功能非常丰富。介绍芳香族氨基酸的特征、芳香族氨基酸及其衍生物的合成及应用,并对芳香族氨基酸在营养学领域、人类医学、生物材料等方面应用进行重点阐述,对芳香族氨基酸的发展前景进行展望。
【关键词】 芳香族氨基酸;生物合成法;氨基酸交联;生物材料
Advances in the Study of Aromatic Amino Acids and Their Derivatives
Liu Ping, Su Weiwei
(Yanshan University, Qinhuangdao 066004, China)
【Abstract】 Amino acids are the basic constituent units of proteins. The condensation and derivation of amino acids are related to the formation and function of proteins. As important amino acids in the body, aromatic amino acids have abundant biological functions. This article introduces the characteristics of aromatic amino acids, the synthesis and application of aromatic amino acids and their derivatives, and focuses on the application of aromatic amino acids in nutrition, human medicine and biological materials and so on. The development prospect of aromatic amino acids is prospected in this article.
【Key words】 aromatic amino acids; biosynthesis; cross-linking of amino acids; biomaterials
〔中图分类号〕 O6-1 〔文献标识码〕 A 〔文章编号〕 1674 - 3229(2021)02- 0027- 08
0 引言
氨基酸作为生物活性分子,是蛋白质的基本组成单元。氨基酸可形成血红蛋白为机体输送氧气,可制造抗体蛋白对抗病毒或细菌的感染,生成酶和激素调节机体新陈代谢[1]。蛋白质由氨基酸组成,与氨基酸的缩合、肽的自组装等密切相关[2]。而芳香族氨基酸作为机体重要的氨基酸,生物学功能丰富,在医药、生物材料等方面应用广泛[3]。芳香族氨基酸包括苯丙氨酸、酪氨酸和色氨酸。芳香族氨基酸在体内可由肠道菌群代谢而来,代谢物对机体免疫、神经元反应、代谢等过程具有调节作用;芳香族代谢物与中枢神经系统、肝脏、胃肠道疾病等损伤有关,对机体有十分重要的影响[4]。同时,芳香族氨基酸含有芳香环,可发射荧光,是天然荧光的主要来源[5]。芳香族氨基酸及其衍生物在医学和营养等方面应用广泛[6]。尽管芳香族氨基酸及其衍生物對农业生产和人体健康都很重要,但目前研究人员对芳香族氨基酸产生途径的了解一般是从微生物研究中推断出来的,对于在植物体内芳香族氨基酸生物合成的调节控制知之甚少。在植物中,高达30%的光合固定碳直接形成芳香氨基酸及其下游产物,使这种生物合成网络成为代谢最密集的网络之一。植物依赖于高产量的芳香族氨基酸,这些氨基酸是蛋白质形成的基石,也是许多初级代谢物和专门代谢物的前体,在植物生长、繁育和防御中起着至关重要的作用[7]。
1 芳香族氨基酸的特征
2-氨基苯丙酸即苯丙氨酸 (Phenylalanine,简称Phe),在极性方面属于非极性α-氨基酸,苯丙氨酸的光学异构体为L-苯丙氨酸,且具有生物活性。人体内脂肪与糖代谢需要苯丙氨酸参与,苯丙氨酸在羟化酶的催化下产生酪氨酸,为激素和神经递质的合成做出贡献。苯丙氨酸是许多酚类化合物的常见前体,包括黄酮类化合物、缩合单宁、木质素和苯丙烷/苯类化合物等[8]。在植物学方面,苯丙氨酸的衍生物具有广泛的生理功能;由于动物不能合成苯丙氨酸,因此苯丙氨酸成为动物饮食中的基本要求。此外,苯丙氨酸衍生化合物被广泛用于营养补充剂、香料、医药和生物燃料[9]。
2-氨基-3-对羟苯基丙酸即酪氨酸 (Tyrosine,简称Tyr),含有酚羟基,这为酪氨酸的氧化提供了条件。酪氨酸极性与苯丙氨酸不同,酪氨酸属于极性α-氨基酸。酪氨酸作为一种必需氨基酸,在机体内具有重要作用[10]。同时,酪氨酸是异喹啉生物碱、色素倍他林和醌的前体[11]。
β-吲哚基丙氨酸即色氨酸 (Tryptophan,简称Trp),呈结晶性粉末状,色氨酸作为人体的必需氨基酸与其他氨基酸、糖类等共同存在时易分解[12]。另外5-羟色胺作为神经传递物质在大脑中具有重要作用,而5-羟色胺可以通过色氨酸的转化在体内生成[13]。色氨酸还是植物体内生物碱、植物碱、吲哚硫苷和植物激素生长素的前体[14]。
2 芳香族氨基酸及其衍生物的生成
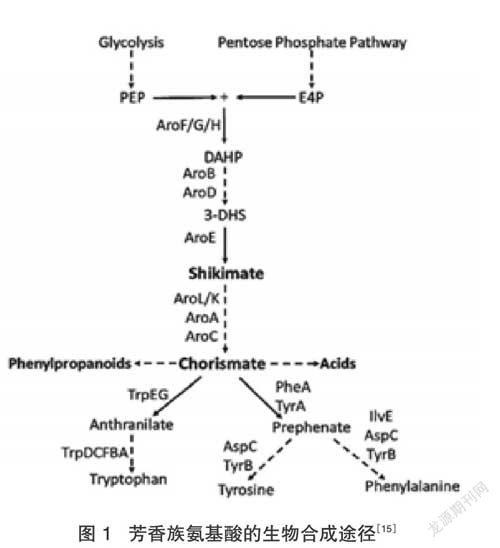
芳香族氨基酸在生物體内由莽草酸途径合成,而在体外合成芳香族氨基酸则需要通过合成生物学方法。合成生物学涉及生物化工的多个领域,Keasling[15]等人第一次通过酵母来生产青蒿酸(图1),Keasling等人的实验推动合成生物学迈入新阶段。在芳香族氨基酸的生物合成途径中,芳香族氨基酸是合成高附加值物质的前体,芳香族氨基酸的生物合成如图1所示,4-磷酸赤藓糖 (E4P) 与磷酸烯醇式丙酮酸 (PEP) 作为起始物,3-脱氧-D-阿糖基庚糖酮酸-7-磷酸是中间产物 (DAHP),首先E4P与PEP缩合,DAHP生成之后被催化,支链酸得以生成[16]。支链酸是重要的分支,因此,生物合成的过程主要聚焦于增强支链酸的碳代谢流,通过这种方法使支链酸的生产量增加[17]。芳香族氨基酸是一类重要的氨基酸,其很多衍生物是有生物学作用的营养品、药品及化学品等,芳香族氨基酸衍生物的生物合成引起广泛关注。
2.1 有机酸类
在生产芳香族氨基酸的莽草酸途径中,支链酸是其中的中间代谢物,也是水杨酸、黏糠酸等一些有机酸的前体物质。水杨酸即邻2-羟基苯甲酸,在植物中很常见,是一种调节植物生长繁殖发育的激素[18]。水杨酸甲酯是水杨酸的衍生物,具备缓解疼痛的功效,可应用在药物中,在医疗、制药等方面发挥作用[19]。对于微生物而言,水杨酸通过调节异源生物合成的莽草酸途径,来调节支链酸以及异支链酸的供给。Lin等人[20]通过引入生物合成途径与部分降解途径来生产顺式琥珀酸。通过整合所建立的邻苯酚甲酸生物合成和降解模块,研究人员发现了一条新的顺式琥珀酸生物合成途径。这项研究不仅为邻苯酚甲酸和顺式琥珀酸的生产建立了一个有效的微生物平台,而且为生物合成有价值的降解代谢物提供了一条可推广的途径。研究表明,应用质粒使支链酸的代谢流增加,但是水杨酸的产生不会随之变多,这种情况下,体内的碳代谢达到平衡。水杨酸经过脱羧、氧化形成黏糠酸,黏糠酸属于六碳二羧酸,用于生产己二酸、对苯二甲酸等。另外,Zhang等人[21]优化和扩大大肠杆菌培养,利用顺式黏糠酸有效生产另一种化合物4-羟基苯甲酸,成功克服了基本的微生物生产限制。
2.2 类苯基丙烷类
苯丙氨酸作为植物次级代谢产物是类苯基丙烷类化合物的前体。依据分子结构的不同,将类苯基丙烷划分为香豆素类、羟化肉桂酸类、茋类和黄酮类物质[22]。这些化合物拥有抗炎、抵抗病毒、抗衰老和抗癌等作用,在医药、化妆品、食品等方面应用广泛。然而,这些化合物含量不多,通过分离提取的方法可简单获取,但是产品的产率很低。随着合成生物学的不断发展,研究人员拟通过价格低廉的碳源或前体例如酵母、大肠杆菌等生物作为底物,得到高附加值的产品。Curran等人[23]首次利用酿酒酵母生成异源粘液酸。该粘液酸由桑孢子虫脱水酶、丁香肠杆菌原儿茶酸脱羧酶和白色念珠菌邻苯二酚1,2-二加氧酶通过一种三步合成的复合途径制备。研究表明,酵母有潜力成为生物生产粘液酸的平台,该研究为异源粘液酸的形成提供了一种新的策略。Martin Berner等人[24]利用链霉菌进行了基因表达实验,实验证明L-酪氨酸通过反式-对羟基肉桂酸 (香豆素酸) 直接转化反式香豆素酸,因为编码酪氨酸氨裂解酶的sam8基因的异源表达导致了反式香豆素酸的产生,这与植物中通常的苯丙烷途径不一致,在植物中,反式香豆素酸在环羟基化发生之前首先被激活。同时,由此中心途径延伸,生产了迷迭香酸、绿原酸等其他芳香族有机酸。
2.3 其他化合物
除了以上两类芳香族氨基酸衍生物,还包括其他具有生物活性的物质,这些物质通常是结构比较简单的衍生物例如5-羟基色氨酸、天麻素等。5-羟基色氨酸是重要的化学物质,其作为色氨酸的衍生物在植物体内的合成较少,所以5-羟基色氨酸的体外合成需求量较大。Lin等人[25]通过实验提高了原核苯丙氨酸4-羟化酶在大肠杆菌中的活性。然后基于序列和结构的蛋白质工程改变了其底物偏好,从而有效地将色氨酸转化为5-羟基色氨酸。这项工作不仅具有很大的潜力,而且还提出了一种扩大微生物天然代谢的策略。
另一方面,具有抗炎、抗衰老等作用的天麻素,可作为镇静剂、神经保护药等在医学上使用[26]。天麻素的合成方法多样,Yin等人[27]报告了一种新的微生物合成天麻素的人工合成方法。在大肠杆菌中,诺卡氏菌羧酸还原酶、内源性醇脱氢酶和红景天糖基转移酶将泛醌生物合成中间体4-羟基苯甲酸转化为天麻素。途径基因被过度表达,以增强对前体4-羟基苄醇的代谢通量,工程菌株在48小时内产生545 mg/L天麻素,这项工作为生产天麻素创造了一条新的人工途径。合成生物学在不断向前发展,随着更多实验方法的应用,生物化学的研究将更加多元发展。芳香族氨基酸衍生物的合成方法比较如表1所示。
3 芳香族氨基酸及其衍生物的应用
3.1 食品及饲料添加剂
食品及饲料中的氨基酸含量通常是利用酸水解来确定的,将氨基酸从蛋白质中解放出来,然后分离和定量释放出的氨基酸。在碱水解过程中,色氨酸可能会有明显的损失,特别是食品中色氨酸的水解损失,损失程度往往是从合成色氨酸的回收或色氨酸类似物 (如5-甲基色氨酸) 的回收中推断出来的[28]。Rutherfurd等人[29]探究了色氨酸、5-甲基色氨酸和a-甲基色氨酸在选定食品氢氧化钠水解过程中的稳定性。与使用5-甲基色氨酸相比,使用合成色氨酸可能会更准确地预测食物和饲料中蛋白质结合色氨酸的稳定性,在氢氧化钠水解过程中,合成色氨酸、蛋白结合色氨酸、5-甲基色氨酸和a-甲基色氨酸都以不同的速率降解,但使用a-甲基色氨酸是纠正色氨酸的水解损失最准确的方法。
色氨酸是一种必需的氨基酸,起着重要的生物学作用。色氨酸是5-羟色胺的前体,在机体内,5-羟色胺是神經递质,与情绪、应激反应、食欲变化和睡眠质量有关。从定量的角度来看,用于生产5-羟色胺的色氨酸比例很低,因为降解的色氨酸转化为5-羟色胺的比例不足10%。色氨酸分解代谢是宿主微生物与肠道微生物菌落互相影响的信号因子,王丽群等研究人员[30]通过益生菌来调节色氨酸代谢,肠道菌群的组成被改变,其对相关疾病的影响被阐述,这为相关疾病的发病机制与临床治疗等提供了新思路。色氨酸在大脑中的转运和可用性是合成大脑5-羟色胺的限制步骤之一,探究色氨酸对食欲的影响可对养殖业提供帮助。低色氨酸的摄入量将会降低食欲,色氨酸可作为饲料添加剂,来调节猪、羊、牛等动物的食欲从而提高养殖效益。Nathalie等人[31]提出并讨论了调节胰岛素敏感性和饥饿激素分泌等机制。在研究中,用低色氨酸含量食物喂养的猪产生了更严重的炎症反应。色氨酸通过分解代谢可能参与调节T细胞增殖和抗氧化分子的产生。色氨酸极有可能是控制采食量的关键营养素,适当的膳食色氨酸对于食欲限制尤为重要。在过渡时期,足够的色氨酸供应可能阻止或限制免疫系统激活对性能的影响强度。这可能需要调整色氨酸的食入含量,来提高养殖产业的经济效益。含色氨酸的食品添加剂与动物的皮毛健康有着密切联系,可促进猫、兔等动物的新陈代谢,从而增加皮毛的生长,增大皮毛的密度[32]。
3.2 医药
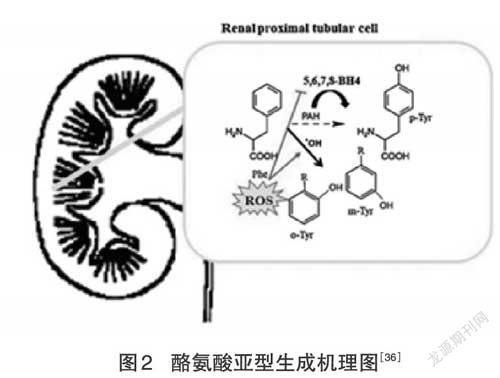
Molnár等人[33]研究证明元酪氨酸和邻酪氨酸是氧化应激相关急性疾病的潜在标志物,也可能对脓毒症患者自身胰岛素的分泌具有干扰作用。在慢性模型中,元酪氨酸和邻酪氨酸水平与代谢和血管胰岛素抵抗有关。数据表明,病理亚型可能有助于激素抵抗的发展。一个相关的神经递质前体是L-酪氨酸,增加酪氨酸摄入量会对心理功能产生有益的影响。另一方面,Hase等人[34]发现酪氨酸能够对抗工作记忆的降低、减缓信息处理以及可能由身体或精神需求情况引起的情绪恶化。即使在没有极端条件的情况下,酪氨酸也可能改善思维。而Rest等人[35]评估了老年人血浆酪氨酸浓度和工作记忆性能对酪氨酸给药的剂量依赖性反应。在双盲随机交叉试验中,研究人员观察到在老年人食入三种不同剂量的酪氨酸后,血浆酪氨酸的剂量反应是明显的。此外,数据表明,与年轻人相比,老年人血浆酪氨酸浓度明显增加。研究表明,年龄相关的血浆酪氨酸反应与酪氨酸给药的剂量依赖性有关。在另一组实验中,Kovacs等人[36]研究了酪氨酸亚型在重大烧伤后的代谢,发现严重的烧伤损伤导致氧化应激,产生元酪氨酸和正酪氨酸。内皮损伤引起的氨基酸氧化由苯丙氨酸羟化酶和氧化应激产生不同的酪氨酸亚型,抑制辅助因子5,6,7,8-BH4诱导病理性酪氨酸亚型产生的机理如图2所示。实验调查了15名严重烧伤的重症患者,数据表明酪氨酸的病理亚型在血清中积累,同时正常亚型的水平降低可能是由于迟发的肾排泄增强或严重烧伤后合成减少所致。酪氨酸在氧化应激相关急性疾病、机体记忆、烧伤后机体反应等方面影响机体的机能,可通过控制摄入酪氨酸含量来影响氧化应激反应,从而更好地发挥酪氨酸在医药方面的作用。
杨益等研究人员[37]利用中药改变相关基因的表达,调控酪氨酸酶基因家族蛋白,来影响黑色素的生成,改善皮肤色素沉着情况。酪氨酸、苯丙氨酸促进黑色素沉积,而色氨酸对黑色素沉积有负面影响[38]。酪氨酸除了对胰岛素、记忆力、机体烧伤后恢复、黑色素形成等方面具有重要影响,还对治疗肝损伤具有一定作用。在动物实验中,中药秦艽可以增强三羧酸循环和糖异生等过程,抑制酪氨酸、苯丙氨酸等氨基酸代谢紊乱从而治疗肝损伤,为中药治疗肝损伤的临床应用和研究提供了参考[39]。
3.3 生物材料
组织工程领域的进步需要设计模拟细胞环境的生物材料[40],生物材料需要具备与目标组织的力学性能相匹配的能力,以及提供指导细胞反应和生理发育的生物、物理和化学信息[41]。在生物工程的多个方面(包括细胞疗法)都需要适当的指导,其中材料的作用是传递新的细胞,并为融入周围健康组织提供信息[42]。设计生物材料有多种方法,交联方法包括酶反应、芬顿反应、光反应等。化学和物理交叉连接技术是有价值的,因为它们相对简单,可以实现对材料性能的控制。这些技术已应用于各种天然衍生的、综合开发的无机陶瓷材料[43]。在许多生物材料的设计中,一种有用的方法是酪氨酸交联。酪氨酸在自然系统中具有诸多作用[44],如联二酪氨酸的交联、酪氨酸残基诱导组装、光系统的作用等,见图3。Curran等人[45]报道了一种新的光活化贻贝蛋白基生物粘合剂 (LAMBA),其灵感来源于贻贝的粘附和昆虫的双酪氨酸交联化学。在体外和体内研究中,LAMBA表现出比商业上的纤维蛋白胶更强的体积湿组织粘附能力和良好的生物相容性。此外,LAMBA光激活交联易于调谐,有效促进伤口关闭和伤口愈合。可见光通过联二酪氨酸键形成重组粘附蛋白基生物粘附的原理如图4所示。LAMBA的合成方法操作方便,LAMBA物理性能可调、湿组织粘附性强、生物相容性强,为受创伤器官的恢复和不可到达内组织的无缝伤口封闭提供了一种很有前途的实用选择。该LAMBA系统可广泛应用于所有医学实践,包括止血剂和防水密封剂治疗血管缺损、组织移植治疗疝以及阻断生物材料中的空气泄漏和穿孔等。
自然界中的生物交联为器官功能的增强提供了可能,其中,联二酪氨酸具有弹性和荧光,引起人们的广泛兴趣[46]。Vashi等研究人员[47]通过对果蝇脂素和冈比亚按蚊脂素样蛋白进行重组,修饰聚苯乙烯表面,通过基于酪氨酸的光交联将多肽附着到磷酸三钙表面,该表面可以通过附着合适的肽而被选择性地粘附,多肽被含酪氨酸的基团修饰,从而参与交联过程。因此,这种包覆方法可以提供一种简单的方法来评估多肽的细胞相互作用能力,或者在其他研究需要时提供钝化的对照表面。芳香族氨基酸及其衍生物的几种应用对比见表2。
4 结论与展望
芳香族氨基酸及其衍生物对人体健康和农业生产极其重要,但是目前研究人员对芳香族氨基酸代谢途径了解得仍然不够全面,还需要进一步研究从而明确不同的步骤在由细胞到生物体不同水平上的影响。同时,在不同的生理、不同的病理情况下,也要分析不同途径间的相互作用。这将为芳香族氨基酸代谢途径中某些产品的特定供应或耗竭开辟新的视野,这些产品可能对炎症和应激反应产生有益的影响。另外,针对芳香族氨基酸衍生物的研究还有很多未攻克的难题,许多具有应用价值的衍生物缺乏全面的生物合成途径信息,因此重新建立整个生物合成途径仍然是一个挑战。
[参考文献]
[1] Han Q, Phillips R.S., Li J. Editorial: Aromatic Amino Acid Metabolism[J]. Frontiers in molecular biosciences, 2019(6):22.
[2] Ren X, Zou Q, Yuan C, et al. The Dominant Role of Oxygen in Modulating the Chemical Evolution Pathways of Tyrosine in Peptides: Dityrosine or Melanin[J]. Angewandte Chemie International Edition, 2019, 58(18):5872-5876.
[3] Vered T., Gad G. New insights into the shikimate and aromatic amino acids biosynthesis pathways in plants[J]. Molecular Plant, 2010, 3(6):956-972.
[4] Agus A., Planchais J., Sokol H. Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease[J]. Cell Host & Microbe, 2018, 23(6):716-724.
[5] 朱燕舞, 赖彭亮, 吴笑笑, 等. 荧光光谱法研究亚甲蓝与三种芳香族氨基酸的相互作用[J].化学研究与应用, 2015, 27(6):815-821.
[6] Leonard E., Runguphan W., O'Connor S., et al. Opportunities in metabolic engineering to facilitate scalable alkaloid production[J]. Nature Chemical Biology, 2009, 5(5):292-300.
[7] Maeda H., Dudareva N. The shikimate pathway and aromatic amino Acid biosynthesis in plants[J]. Annual Review of Plant Biology, 2012(63):73-105.
[8] Vogt T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010, 3(1): 2-20.
[9] Qian Y, Lynch J.H, Guo L, et al. Completion of the cytosolic post-chorismate phenylalanine biosynthetic pathway in plants[J]. Nature Communications, 2019, 10(1):73-105.
[10] Latham P.W. ON A NEW SYNTHESIS OF TYROSINE[J]. Elsevier, 1906, 168(4345):1583.
[11] 黄玉香, 谭何新, 于剑, 等.药用植物生物碱次生代谢工程研究进展[J]. 中草药, 2016, 47(23):4271-4281.
[12] Gu P, Yang F, Li F, et al. Knocking out analysis of tryptophan permeases in Escherichia coli for improving L-tryptophan production[J]. Appl Microbiol Biotechnol, 2013, 97(15):6677-6683.
[13] Stone T.W., Stoy N., Darlington L.G. An expanding range of targets for kynurenine metabolites of tryptophan[J]. Trends in Pharmacological Sciences, 2013, 34(2):136-143.
[14] 吳栋丽, 汪静, 陈爽, 等. 白藜芦醇抑制人肝微粒体代谢色氨酸的研究[J]. 中国药理学通报, 2021, 37(3):349-355.
[15] Ro D.K., Paradise E.M., Ouellet M., et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast[J]. Nature: International Weekly Journal of Science, 2006, 440(7086):940-943.
[16] Anastasia K., Jens N. Production of natural products through metabolic engineering of Saccharomyces cerevisiae[J]. Current Opinion in Biotechnology, 2015(35):7-15.
[17] Sun X, Shen X, Rachit J., et al. Synthesis of chemicals by metabolic engineering of microbes[J]. Chemical Society Reviews, 2015, 44(11):3760-3785.
[18] Karim M.M., Lee H.S., Kim Y.S., et al. Analysis of salicylic acid based on the fluorescence enhancement of the As(III)-salicylic acid system[J]. Analytica Chimica Acta, 2006, 576(1):136-139.
[19] Zhang Y, Li X. Salicylic acid: biosynthesis, perception, and contributions to plant immunity [J]. Current Opinion in Plant Biology, 2019(50):29-36.
[20] Lin Y, Sun X, Yuan Q, et al. Extending shikimate pathway for the production of muconic acid and its precursor salicylic acid in Escherichia coli[J]. Metabolic Engineering, 2014(23):62-69.
[21] Zhang H R, Brian P., Li Z J, et al. Engineering Escherichia coli coculture systems for the production of biochemical products[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(27):8266-8271.
[22] Weisshaar B., Jenkins G.I. Phenylpropanoid biosynthesis and its regulation[J]. Current Opinion in Plant Biology, 1998(3):251-257.
[23] Curran K.A., Leavitt J.M., Karim A.S., et al. Metabolic engineering of muconic acid production in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2013(15):55-66.
[24] Berner M., Krug D., Bihlmaier C., et al. Genes and enzymes involved in caffeic acid biosynthesis in the actinomycete Saccharothrix espanaensis[J]. Journal of Bacteriology, 2006, 188(7):2666-2673.
[25] Lin Y H, Sun X X, Yuan Q P, et al. Engineering bacterial phenylalanine 4-hydroxylase for microbial synthesis of human neurotransmitter precursor 5-hydroxytryptophan[J]. ACS Synthetic Biology, 2014, 3(7):497-505.
[26] Han J, Je J H, Hyoung K.S., et al. Gastrodia elata shows neuroprotective effects via activation of PI3K signaling against oxidative glutamate toxicity in HT22 cells[J]. The American Journal of Chinese Medicine, 2014, 42(4):1007-1019.
[27] Bai Y, Yin H, Bi H, et al. De novo biosynthesis of Gastrodin in Escherichia coli[J]. Metabolic Engineering, 2016(35):138-147.
[28] 李華伟, 祝倩, 吴灵英, 等. 色氨酸的生理功能及其在畜禽饲粮中的应用[J]. 动物营养学报, 2016, 28(3):659-664.
[29] Rutherfurd S.M., Richardson R.K., Moughan P.J. The stability of tryptophan, 5-methyl-tryptophan and alpha-methyl-tryptophan during NaOH hydrolysis of selected foods [J]. Food Chemistry, 2015(188):377-83.
[30] 王丽群, 庞日朝, 胡晓敏, 等. 肠道菌群对色氨酸代谢的影响研究进展[J/OL].中国比较医学杂志: 1-8[2021-04
-13].http://kns.cnki.net/kcms/detail/11.4822.R.20210330.
0856.002.html.
[31] Le F., Seve B. Biological roles of tryptophan and its metabolism: Potential implications for pig feeding[J]. Livestock Science, 2007, 112(1-2):23-32.
[32] 朱厚信, 王芳, 李守乐. 宠物食品添加剂及其研究进展[J]. 食品安全导刊, 2021(8):28.
[33] Molnár G.A., Kun S., Sélley E., et al. Role of Tyrosine Isomers in Acute and Chronic Diseases Leading to Oxidative Stress - A Review [J]. Current Medicinal Chemistry, 2016, 23 (7):667-685.
[34] Hase A., Jung S.E., Rot M. Behavioral and cognitive effects of tyrosine intake in healthy human adults[J]. Pharmacology, Biochemistry and Behavior, 2015(133): 1-6.
[35] Ondine V., Mirjam B., Rianne D.H., et al. Dose-Dependent Effects of Oral Tyrosine Administration on Plasma Tyrosine Levels and Cognition in Aging[J]. Nutrients, 2017, 9(12):1279.
[36] Kovacs P., Szelig L., Kun S., et al. Changes of para-, meta- and ortho-tyrosine over time in burned patients [J]. Immunobiology, 2020, 225 (3):151917.
[37] 楊益, 刘陶, 朱姗, 等. 中药治疗皮肤色素沉着类疾病研究进展[J]. 辽宁中医药大学学报, 2020, 22(10):115-119.
[38] 郑娟霞, 陈文宁, 杨莉, 等. 浅谈氨基酸对乌骨鸡黑色素沉积的影响[J]. 江西饲料, 2019(6):3-4.
[39] 吴琳静, 余雪纯, 柯佳群, 等. 基于代谢组学的中药治疗化学性肝损伤研究进展[J/OL].中国实验方剂学杂志: 1-17[2021-04-13].https://doi.org/10.13422/j.cnki.syjx.2021
0716.
[40] Oliveira S.M., Reis R.L., Mano J.F. Towards the design of 3D multiscale instructive tissue engineering constructs: Current approaches and trends[J]. Biotechnology Advances, 2015, 33(6):842-855.
[41] Chen Q, Liang S, Thouas G.A. Elastomeric biomaterials for tissue engineering[J]. Progress in Polymer Science, 2013, 38(3-4):584-671.
[42] Cezar C.C., Mooney D.J. Biomaterial-based delivery for skeletal muscle repair[J]. Advanced Drug Delivery Reviews, 2015(84): 188-197.
[43] Ren G W, Chen X D, Dong F P, et al. Concise review: mesenchymal stem cells and translational medicine: emerging issues[J]. Stem Cells Translational Medicine, 2012, 1(1):51-58.
[44] Lee J., Ju M, Cho O.H., et al. Tyrosine-Rich Peptides as a Platform for Assembly and Material Synthesis[J]. Advanced Science, 2019, 6(4):1801255.
[45] Jeon E.Y, Hwang B.H, Yang Y J, et al. Rapidly light-activated surgical protein glue inspired by mussel adhesion and insect structural crosslinking[J]. Biomaterials, 2015(67):11-19.
[46] Jones L.H., Narayanan A., Hett E.C. Understanding and applying tyrosine biochemical diversity[J]. Molecular BioSystems, 2014, 10(5): 952-969.
[47] Aditya V.V., John A.M., Ramshaw V.G. Controlled surface modification of tissue culture polystyrene for selective cell binding using resilin-inspired polypeptides[J]. Biofabrication, 2013, 5(3):035005.

