锌离子对血管细胞的毒性及其机理研究
摘要:金属锌是一种潜在的血管可降解支架材料,研究金属锌降解产生的离子对血管细胞的毒性及致机理,对可降解金属锌支架的研究与开发有重要参考价值。本文研究了不同浓度的Zn2+对血管内皮细胞与平滑肌细胞毒性及致毒机理。结果表明,对于不同细胞类型,Zn2+的毒性及作用机制均不相同。低浓度的Zn2+对内皮细胞的毒性低于对平滑肌细胞的毒性。随着浓度的升高内皮细胞对Zn2+的毒性更加敏感,其主导的致死机制为不利于机体的细胞坏死。而平滑肌细胞的致死率直至Zn2+浓度到达300 µM才明显提高,其主要致死机制为不会对机体造成负面损伤的细胞凋亡。除致死毒性外,Zn2+还会造成内皮细胞的S期阻滞及平滑肌细胞的S期和G2-M期阻滞。
关键词:锌离子,血管内皮细胞,血管平滑肌细胞,细胞凋亡,细胞坏死,细胞周期阻滞,毒性机理
Abstract: Zinc is a potential biodegradable vascular scaffold material.Study the toxicity of Zn2+ to vascular cells and the mechanism of toxicity is important to the research and development of zinc vascular scaffolds.In this paper, the toxicity of different concentrations of Zn2+ to vascular endothelial cells and smooth muscle cells were tested.The corresponding toxicity mechanism were studied.The results showed that the toxicity and mechanism were different for different cell types.The toxicity of low concentration of Zn2+ to endothelial cells was lower than that to smooth muscle cells.With the Zn2+ increasing, endothelial cells became more sensitive to the toxicity of Zn2+.The leading cell death mechanism was cell necrosis, which was unfavorable to vascular tissue.However, the death rate of smooth muscle cells was not obvious until the concentration of Zn2+ reached 300 μM.The smooth muscle cell death mechanism was apoptosis which did not cause negative damage to the tissue.In addition to toxicity leading to cell death, Zn2+ also caused S phase arrest of endothelial cells and S phase and G2 to M phase arrest of smooth muscle cells.
Key words: Zn2+; Vascular endothelial cells; Vascular smooth muscle cells; Cell apoptosis; Cell necrosis; Cell cycle arrest; Toxicity mechanism
冠脉血管狭窄导致的心肌梗死为人类健康的一大杀手,其主要治疗手段为冠脉血管支架介入治疗术。1血管支架在病变处扩张,使血流畅通,从而恢复心肌细胞的血供。临床上使用的冠脉支架一般由不锈钢、Pt等金属材料制备,这些材料在体内不可降解,长期遗留在体内作为异物刺激血管,存在血管再狭窄的风险。因此,开发安全有效的可降解支架成为一种临床需求。2高分子材料为可降解支架的主要备选材料,但高分子材料本身机械支撑力弱,不适于大血管病变,而金属材料本身具有强度的优势,因此开发可降解金属支架具有重要的意义。目前研究比较广泛的可降解金属材料为铁、镁、锌等。3相比而言,金属锌降解产生的锌离子为人体所需的微量元素,且金属锌具有较好的机械强度,因此,鋅是一种具有潜力的可降解金属材料。研究表明,低浓度的锌离子对组织细胞的增殖具有促进作用,但高浓度的锌离子对组织细胞具有毒性。4在可降解材料植入血管内的一段时间后,降解产生的离子可能在局部蓄积,势必产生细胞毒性,对生命安全造成隐患。
细胞毒性按作用机制可分细胞致死和细胞周期阻滞。5细胞致死有两种型式,包括细胞凋亡和细胞坏死。细胞凋亡一种细胞自主有序的死亡,是一个主动过程,不对机体造成负面损伤。细胞坏死是无序变化的死亡过程,往往会引发组织的急性炎症反应。细胞周期阻滞是细胞停留在细胞周期的某一阶段不能进入下一个时期的现象,理论上不影响细胞活力。
研究证实,锌离子对不同种类的细胞的毒性机理不同。6但目前,仍缺乏锌离子对血管细胞毒性机理的研究。而研究锌离子的对血管细胞的毒性机制,对如何调控金属锌在体内的降解模式具有重要参考价值。因此,本文的目的在于研究锌离子对血管细胞的毒性机理,为开发可降解金属锌支架的可行性提供理论依据。
1材料与方法
1.1材料与设备
1.1.1材料与试剂
ZnCl2(Sigma-Aldrich,Z0152),人主动脉血管平滑肌细胞(赛百慷,HA-VSMC),人脐静脉内皮细胞(赛百慷,icell-h110),血管平滑肌细胞培养基,原代内皮细胞专用培养体系(赛百慷,PriMed-iCell-002),平滑肌细胞专用培养体系(赛百慷,PriMed-iCell-004)Annexin V-FITC (BD,556419)),7-AAD Staining Solution (BD,559925),PI/RNase Staining Buffer (BD Pharmingen,550825) ,PBS(Invitrogen,14190-136),FBS (Corning, 35-076-CV)。
1.1.2仪器与设备
二氧化碳培养箱(Thermo Scientific,Heracell VIOS 160i),水浴锅(迈科诺,HJ-A2),超净工作台(力康,OptiClean 1300),涡旋振荡仪(IKA,GENIUS 3),移液控制器(Sartorius,Midi Plus)电动移液器(Sartorius,eLINE),移液枪(Eppendorf,Research Plus),离心机 (Thermo Scientific,ST 40R),流式细胞仪(Beckman Coulter,CytoFLEX)。
1.2实验方法
1.2.1锌离子溶液配制
按照表1中的浓度,将ZnCl2分别溶解于人脐静脉内皮细胞(HUVEC)与人主动脉血管平滑肌细胞(HA-VSMC)基础培养基中(不含血清)待用。
1.2.2细胞培养
在HUVEC和HA-VSMC用培养基内分别培养两种细胞至稳定期。将稳定期的细胞消化后,以106每孔的密度接种6孔板内,培养24小时,将孔板内的培养基吸弃,用不含锌离子、不含血清的培养基漂洗,之后向孔板内加入预先配制的不同浓度的含Zn2+培养基,向培养基内补充10%的FBS。24小时后收集细胞,并立即进行流式细胞仪检测。
1.2.3细胞凋亡/坏死检测
将待测样品以1500 rpm的转速离心5分钟,吸弃上清液。向离心管中加 1ml的PBS缓冲液,轻柔吹打使细胞重悬均匀;再以1500 rpm的转速离心5分钟,吸弃上清液。向离心管中加 300µl Binding buffer,轻柔吹打使细胞重悬均匀;取100µl样品,每管加入5µl Annexin V和5µl 7-AAD染色液重悬细胞;室温避光放置15分钟后,加入400µl Binding Buffer。用CytoFLEX流式细胞仪进行流式检测。所有样品需在1小时内测完;利用FlowJo进行凋亡各时期的分析。
1.2.4 细胞周期阻滞测试
将待测样品反复吹打均匀转入15ml离心管。向每个离心管中加 5 ml的PBS,轻柔吹打使细胞重悬均匀,以1500 rpm的转速离心5分钟弃上清;一边将离心管置于半速涡旋,一边滴加约5 ml 75%乙醇,在冰上孵育15分钟后放入-20 ℃冰箱保存过夜;从冰箱取出固定后的样品加入5 ml PBS,以1500 rpm 的转速离心5分钟,弃去上清,用1ml含有1% FBS的PBS洗再一次,最后加入500 µl PI/RNase Staining Buffer,室温避光孵育20分钟;用CytoFLEX流式细胞仪最低流速进行流式检测。利用Modfit软件进行周期的分析。
2实验结果
2.1锌离子浓度对细胞致死的影响
磷脂酰丝氨酸位于正常活细胞膜内侧,早期凋亡的细胞,其磷脂酰丝氨酸会从细胞膜内侧翻转至细胞膜表面。膜联蛋白-V(Annexin-V)是一种Ca2+依赖性磷脂结合蛋白,是磷脂酰丝氨酸高亲和力的结合物。7-氨基放线菌素(7AAD)是一种核酸染料,它无法透过完整的活细胞的细胞膜,但能够透过死细胞的细胞膜而使细胞核染色。因此,将Annexin-V与7AAD匹配使用,就可对凋亡细胞以及坏死细胞进行区分。7Annexin V阳性(Annexin V+)并且 7AAD阳性(7AAD+)的细胞为晚期凋亡细胞,即坏死细胞。Annexin V阳性(Annexin V+)并且 7AAD阴性(7AAD-)为早期凋亡细胞,即凋亡细胞。Annexin V阴性(Annexin V-)并且 7AAD阴性(7AAD-)为活细胞。
2.1.1 锌离子浓度与细胞活率
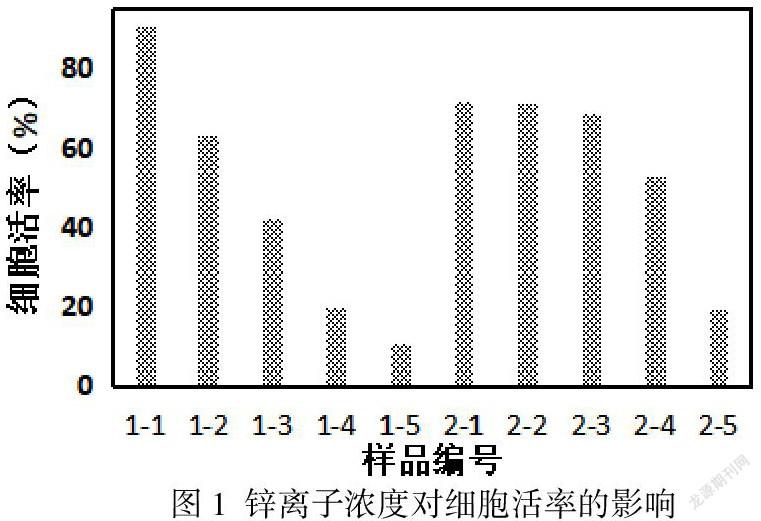
通过流式细胞仪检测Annexin V-/7AAD-的细胞比例可以获得细胞活率数据,结果如图1中所示。1-1至1-5为浓度分别为10 µM、50 µM、100 µM、300 µM、500 µM的Zn2+对应的HUVEC的细胞活率。2-1至2-5为浓度分别为10 µM、50 µM、100 µM、300 µM、500 µM的Zn2+对应的HA-VSMC的细胞活率。HUVEC在低Zn2+浓度下相比HA-VSMSC具有较高的活率,随着Zn2+浓度的增加,HUVEC活率快速降低,当Zn2+浓度达到500 µM时,细胞活率接近为零。HA-VSMC在10 µM Zn2+浓度时活率低于HUVEC,但随着Zn2+浓度的增加,HU-VSMC活率降低不明显,直至Zn2+浓度达到300 µM时,细胞活率有明显降低。可见血管内皮细胞相比平滑肌细胞对Zn2+浓度变化更敏感。
2.1.2细胞致死结果
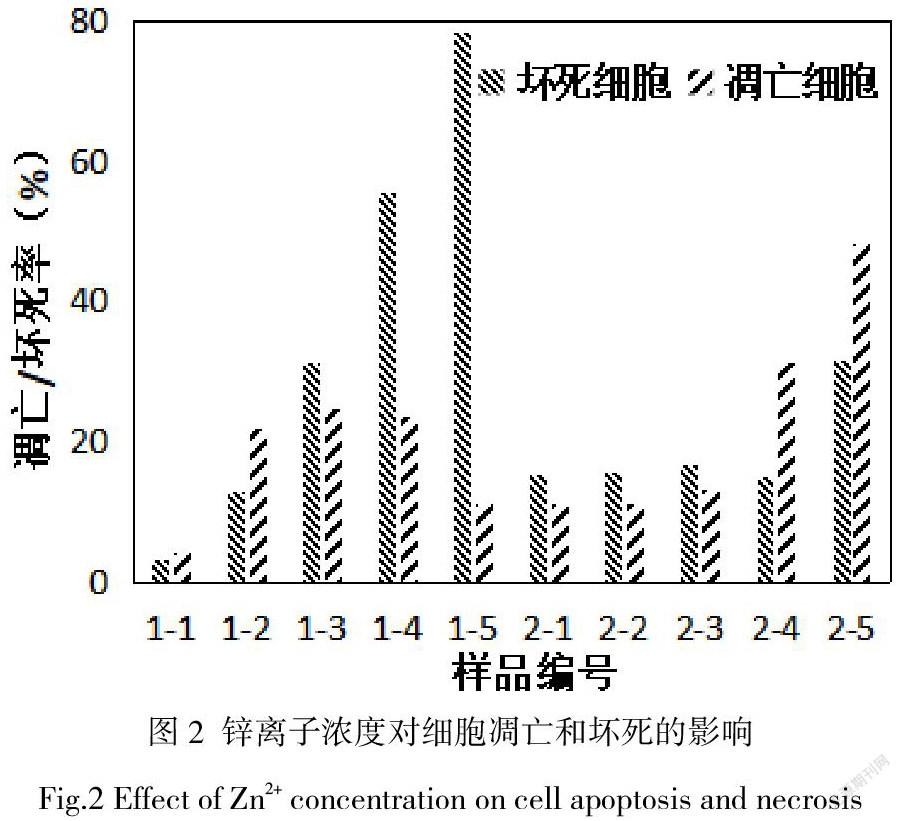
通过流式细胞仪检测Annexin V+/7AAD-、Annexin V+/7AAD+的细胞比例可以获得细胞凋亡和细胞坏死比率,结果如图2中所示。1-1至1-5为浓度分别为10 µM,50 µM,100 µM,300 µM,500 µM的Zn2+对应的HUVEC的细胞凋亡与坏死比率。随着Zn2+的增加,HUVEC的坏死率逐渐增加,细胞凋亡率首先呈现上升趋势,高于坏死比率,随后维持在一个稳定的百分比,低于坏死比率,最后呈现下降趋势。说明,对于内皮细胞,在低浓度条件下,Zn2+细胞致死的毒性机制主要為细胞凋亡,超过300 µM后细胞致死的毒性机制主要为细胞坏死。2-1至2-5为浓度分别为10 µM、50 µM、100 µM、300 µM、500 µM的Zn2+对应的HA-VSMC的细胞凋亡与坏死比率。当Zn2+浓度在10 µM至300 µM范围内时,细胞坏死率处于相对稳定的水平,坏死率略高于凋亡率。当Zn2+浓度上升至500 µM时细胞坏死比率明显升高。当Zn2+浓度在10 µM至100 µM范围内时,细胞凋亡率处于相对稳定的水平。当Zn2+浓度上升至300 µM时细胞凋亡率明显升高,凋亡率明显高于坏死率。说明,对于平滑肌细胞,在低浓度条件下,Zn2+细胞致死的毒性机理兼有细胞坏死与细胞凋亡,在高浓度调节下,细胞凋亡为主导的细胞致死机理。
2.2细胞周期阻滞结果
细胞周期是分为间期与分裂期两个阶段。8间期包含G1期、S期与G2期。G1期为DNA合成前期,主要DNA复制作准备,此期细胞具有常规二倍体的细胞的DNA含量。S期为DNA合成期,主要合成DNA,此期DNA含量介于二倍体和四倍体之间。G2期为DNA合成后期,细胞在此期终止DNA合成,此期细胞具有四倍体细胞的DNA含量。细胞分裂期即M期,细胞完成分裂,染色体均等地传递至下一代细胞。M期之后,有的细胞可继续分裂进入下一周期,有的细胞转入G0期,脱离细胞周期暂时停止分裂。
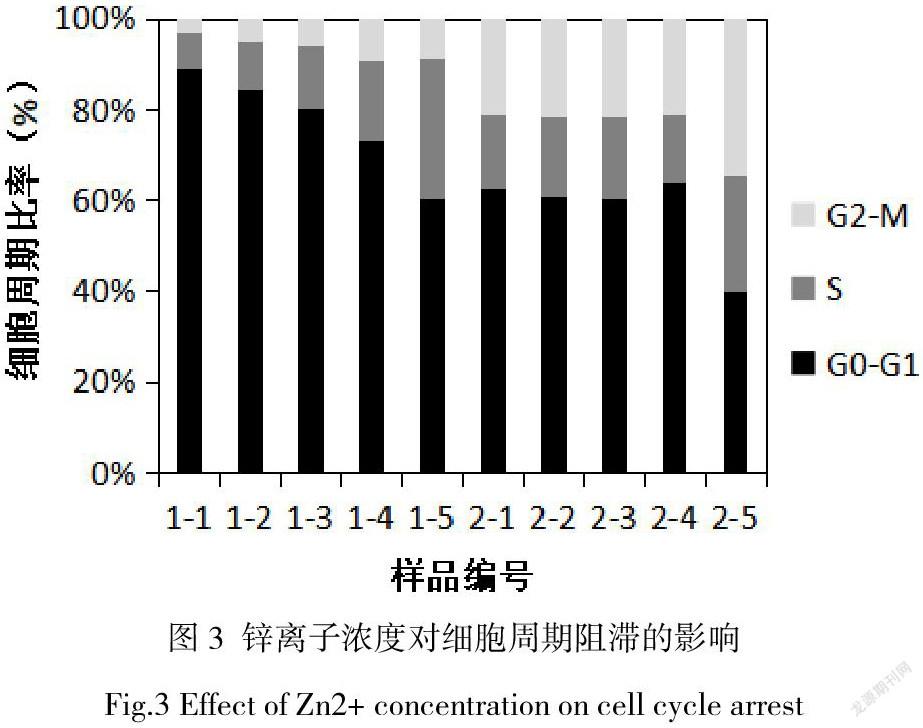
碘化丙啶(PI),可以与细胞内DNA和RNA结合,通过流式细胞仪检测PI的荧光强度可直接反馈细胞内DNA含量,因此可分辨处于细胞周期各时相的细胞的百分比的哪一阶段。9在检测中如果发现处于某个时相的细胞百分率有显著性升高,则说明细胞周期在这一时相受到了阻滞。图3为流式细胞仪检测的细胞周期阻滞结果。1-1至1-5为浓度分别为10 µM、50 µM、100 µM、300 µM、500 µM的Zn2+对应的HUVEC的细胞处于不同周期时相的比率,随着Zn2+的增加,处于G2-M期的细胞比率略有上升,但不显著。处于S期的细胞比率呈明显上升趋势。处于G0-G1期的细胞呈明显下降趋势。说明,Zn2+对内皮细胞周期的阻滞作用发生在S期,即DNA合成期。2-1至2-5为浓度分别为10 µM、50 µM、100 µM、300 µM、500 µM的Zn2+对应的HA-VSMC的细胞处于不同周期时相的比率,在浓度Zn2+处于10 µM至300 µM范围内时,处于G0-G1期、S期以及G2-M期的细胞比率无显著改变,Zn2+升至500 µM后S期及G2-M期的细胞比率明显增加,G0-G1期的细胞比率明显降低。说明,Zn2+主要阻滞平滑肌细胞的S期和G2-M期,即合成期至分裂期。
3讨论
促进内皮损伤修复并抑制平滑肌细胞增生是冠脉血管支架介入治疗后病变恢复的关键。10因此,支架的设计一般都会考虑减少对血管内皮细胞的刺激,加强对平滑肌细胞增生的抑制。细胞凋亡和细胞周期阻滞理论上不会对机体造成负面损伤,而细胞坏死会带来一系列的机体损伤效应。金属锌支架在体内降解模式需满足:一方面,产生的锌离子不可导致内皮细胞和平滑肌细胞的大量坏死;另一方面,应减少对内皮细胞的损伤,加强对平滑肌细胞的抑制。在低浓度条件下Zn2+对于内皮细胞致死的毒性机制主要为细胞凋亡,超过一定浓度后细胞致死的毒性机制主要为细胞坏死。Zn2+对内皮细胞周期的阻滞作用于S期。在低浓度条件下,Zn2+对平滑肌细胞致死的毒性机制兼有细胞坏死与细胞凋亡,在高浓度条件下,细胞凋亡为主导的细胞致死机制。Zn2+对平滑肌细胞周期阻滞在低浓度条件下不明显,在升至500 µM后细胞周期阻滞作用于S期和G2-M期。在支架植入初期,由于支架植入过程的扩张作用,内皮会有一定程度的损伤,为确保内皮修复,初期支架降解释放的Zn2+可维持在50 µM以下,在该浓度范围内,Zn2+对内皮细胞的损伤作用较弱,对平滑肌细胞的损伤作用较强,可起到促进内皮修复抑制平滑肌增生的作用。一般支架植入体内2周至4周后,支架杆会被平滑肌细胞包裹,内皮细胞生长于平滑肌细胞层之上,完成内皮层修复。之后,为抑制平滑肌细胞的增生导致的血管再狭窄,支架杆向血管腔方向释放的Zn2+依然需维持在较低水平,以减少对内皮层的刺激,而支架杆向血管壁方向释放的Zn2+可提升至较高的浓度水平(高于300 µM),诱导平滑肌细胞的凋亡,而不造成对机体的负面损伤。在实际研究中,可通过金属冶炼工艺的开发以及涂层应用是实现对降解的调控。
4 结论
本文研究了10 µM至500 µM浓度范围内的Zn2+对血管内皮细胞与平滑肌细胞毒性机制。对于不同细胞类型,Zn2+的致死作用机制不同。低浓度的Zn2+对内皮细胞的毒性作用低于对平滑肌细胞的毒性作用。随着浓度的升高内皮细胞对Zn2+的毒性更加敏感,其主导的致死方式为不利于机体的细胞坏死。而平滑肌细胞的致死率直至Zn2+浓度到达300 µM才逐渐显现,其主要致死方式为不会对机体造成负面损伤的细胞凋亡。除致死毒性外,Zn2+还会造成内皮细胞的S期阻滞及平滑肌细胞的S期和G2-M期阻滞。本研究可以为可降解锌支架的研发提供理论参考。
参考文献
[1]Chan PS, Patel MR, Klein LW, Krone RJ, Dehmer GJ, Kennedy K, Nallamothu BK, Weaver WD, Masoudi FA, Rumsfeld JS, Brindis RG and Spertus JA.Appropriateness of Percutaneous Coronary Intervention [J].JAMA.2011;306:53-61.
[2]Chen MS, John JM, Chew DP, Lee DS, Ellis SG and Bhatt DL.Bare metal stent restenosis is not a benign clinical entity [J].American Heart Journal.2006;151:1260-1264.
[3]Hermawan H, Dubé D and Mantovani D.Developments in metallic biodegradable stents [J].Acta Biomaterialia.2010;6:1693-1697.
[4]刘霞,任广达,单伟,曾瑞霞,李德华,秦书俭.锌对大鼠骨髓间充质干细胞DNA和蛋白质含量及增殖周期的影响[J].中国组织工程研究与临床康复.13:1901-1904.
[5]Vermeulen K, Berneman ZN and Van Bockstaele DR.Cell cycle and apoptosis.2003;36:165-175.
[6]Wang Y-h, Li K-j, Mao L, Hu X, Zhao W-j, Hu A, Lian H-z and Zheng W-j.Effects of Exogenous Zinc on Cell Cycle, Apoptosis and Viability of MDAMB231, HepG2 and 293 T Cells [J].Biological Trace Element Research.2013;154:418-426.
[7]Zimmermann M.MN.Annexin V/7-AAD Staining in Keratinocytes.In: Stoddart M.(eds) Mammalian Cell Viability.Methods in Molecular Biology (Methods and Protocols) [M].Humana Press.2011;170.
[8]Vermeulen K, Berneman ZN and Van Bockstaele DR.Cell cycle and apoptosis [J].Cell Proliferation.2003;36:165-175.
[9]Kim KH and Sederstrom JM.Assaying Cell Cycle Status Using Flow Cytometry [J].Curr Protoc Mol Biol.2015;111:28.6.1-28.6.11.
[10]Virmani R and Farb A.Pathology of in-stent restenosis [J].Curr Opin Lipidol.1999;10:499-506.
作者簡介:王玄,性别:女,出生年月:1988年9月,籍贯:安徽省蚌埠市,学历:博士研究生,职称:无,研究方向:生物医用材料。
(上海睿钰生物科技有限公司 201619)

