钙离子对植物乳杆菌LIP-1 抗冷冻干燥性能的影响
孙瑞胤,王瑞雪,鄂晶晶,姚彩青,何宗柏,张巧玲,陈子超,马蓉泽,包秋华,王俊国
(内蒙古农业大学食品科学与工程学院,乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古呼和浩特 010018)
益生菌一词源于希腊语,意思是“对生命有益”。2002 年世界粮农组织(FAO)和世界卫生组织(WHO)专家组对益生菌做出了定义,即通过摄取适当的量,对使用者的身体健康能发挥有效作用的细菌[1]。研究发现益生菌制剂中菌株活性对最终产品的益生功效起到至关重要的作用[2]。菌株常通过干粉状态进行运输与贮藏,在一定时期抑制菌株生理活性,从而延长其保质期并节约运输成本[3]。目前工业生产中主要通过真空冷冻干燥法制备乳酸菌制剂,其具有活菌数高、发酵活力强、遗传稳定性好等优点,但也会对菌体造成一定的损伤[4]。因此,保证冷冻干燥存活率至关重要。在早期的研究中,人们通常选用改变保护剂成分以及优化冻干工艺来提高菌株的抗冷冻干燥性能,但近年来研究发现,益生菌在冷冻干燥过程中的存活率与其生长培养基的成分也有着十分密切的联系[5]。
研究表明通过改变如碳源、氮源、生长因子以及微量元素等培养基成分可以提高菌株的冻干存活率[5]。Rault 等[6]发现在生长培养基中加入海藻糖可以提高保加利亚乳杆菌Lb6 的冷冻存活率。包维臣等[7]将培养基的氮源由酵母浸膏改为动物蛋白胨时,保加利亚乳杆菌ND02 在真空冷冻干燥过程的存活率明显升高。Carvalho 等[8]发现当甘露糖替代MRS 培养基中的葡萄糖时,保加利亚乳杆菌具有更好地抗冷冻干燥性能。张钰等[1]发现钙能够刺激鼠李糖乳杆菌ZY 的生长,使其细胞形态由长链变为短链。苏郁文等[9]发现钙离子的添加能够提高鼠李糖乳杆菌GG 在喷雾干燥过程中的存活率。除此之外,一些微量元素,如镁离子[10−11]、锰离子[12]和铁离子[4]添加到培养基中时均可促进不同菌株的生长量。由此可知,改变培养基成分,如碳源,氮源,生长因子及微量元素均可有效提高菌株的生长量及冷冻干燥抗性。
虽已有研究表明在培养基中添加钙离子可提高菌株冷冻干燥的抗性[13],但对其作用机制研究尚少。本研究以植物乳杆菌LIP-1 为研究对象,在培养基中添加不同浓度的钙离子,探究钙离子对该菌株培养后的活菌数及抗冷冻干燥性能的影响,并通过菌株大小分布、关键酶活以及细胞膜脂肪酸的检测来探讨其内在作用机制,同时通过8 周常温贮藏实验评价其贮藏稳定性,以期为今后提升菌株的冷冻干燥抗性提供理论参考。
1 材料与方法
1.1 材料与仪器
植物乳杆菌 LIP-1(Lactobacillus plantarumLIP-1)是一株分离自新疆自然发酵酸马奶,拥有较好的耐酸耐胆盐特性及较强的降胆固醇活性的益生菌[14]由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供;氯化钙(分析纯) 天津永晟精细化工有限公司;正己烷(色谱纯) 福晨(天津)化学试剂有限公司;甲醇(色谱纯) 天津市光复科技发展有限公司;30wt%甲醇钠溶液(色谱纯)、氯仿(色谱纯)上海麦克林生化科技有限公司;碱性磷酸酶试剂盒、Na+K+-ATP 酶试剂盒 北京索莱宝试剂公司。
移液枪 德国Eppendorf;MLS-3750 型灭菌锅、STAC-S45F 型恒温培养箱 日本三洋;Centrifuge-5810R 高速离心机 德国艾本德;ZHJH-1214B 超净工作台 南京依贝仪器设备有限公司;FD-1A-50 真空冷冻干燥机 北京博医康实验仪器有限公司;DW-86L388J 医用低温保存箱 青岛海尔特种电器有限公司;SP-650 型全自动干热灭菌箱 日本ASVANTEC;ND100-1 干式氮吹仪 南京肯凡电子科技有限公司;Technologies 6850 气相色谱 上海安捷伦科技(有限)公司;DSM5000 CS 显微镜 德国莱卡;细胞破碎仪VCX750 美国Sonics。
1.2 实验方法
1.2.1 溶液配制[15]冻干保护剂:蒸馏水82 mL、脱脂乳 10.0 g、蔗糖 8.0 g、L-谷氨酸钠 0.1 g,115 ℃灭菌7 min,灭菌完成后置于冰水混合物中快速冷却,4 ℃保存备用;MRS 液体培养基:葡萄糖 20.0 g、大豆蛋白胨 10.0 g、牛肉膏 10.0 g、酵母粉 5.0 g、无水乙酸钠 5.0 g、无水磷酸氢二钾 2.0 g、柠檬酸钠2.0 g、七水硫酸镁 0.2 g、五水硫酸锰 0.05 g、吐温−80 1 mL。加蒸馏水 1000 mL,121 ℃灭菌 15 min;MRS 固体培养基:液体培养基的基础上额外添加琼脂12 g/L,121 ℃灭菌15 min。
1.2.2 菌株活化[15]将贮藏于−80 ℃冰箱中的植物乳杆菌LIP-1 融化,以2%接菌量接种于液体MRS 培养基,于37 ℃培养箱中培养18 h,在4 ℃中保存备用。
1.2.3 钙离子对植物乳杆菌生长的影响 将MRS培养基中菌株以2%接菌量分别接种于外加0(对照组)、0.25、0.5、0.75、1、1.5、2 mmol/L 氯化钙的液体MRS 培养基中,培养18 h 后进行稀释平板计数(以后均简称计数)。
1.2.4 钙离子培养后菌株的干燥[15]将预冻于−80 ℃冰箱中6 h 后,添加了保护剂的菌泥,置于真空冷冻干燥机中进行冻干,冻干条件为:冷阱温度−48 ℃,20 Pa,18 h。
1.2.4.1 钙离子培养后菌株的真空冷冻干燥活菌数[15]将不同培养方式培养出的菌株,冻前计数后,加入2 mL 冷冻干燥保护剂,并充分混匀,预冻6 h,后冻干,冻干后计数。

1.2.5 电镜观察 对(MRS)对照组与添加0.5 mmol/L钙离子的实验组使用光学显微镜拍摄照片,该显微镜配有100 倍HCX PL APO 物镜。为了更好地观察细胞,细胞使用结晶紫染色。显微镜拍摄后,使用Image J 对菌株进行长度统计。
1.2.6 Na+K+-ATP 酶活力的测定[16]将冷冻干燥样品复水离心弃上清,菌泥用 0.85% NaCl 溶液清洗2 次后,加入2 mL 酶提取液,后进行超声波破碎(超声3 s,间隔10 s,7 min);4 ℃,15000 r/min,离心10 min 取上清,用于后续相关酶活测定。Na+K+-ATP 酶试剂盒分别对组样品进行相关酶活的3 次重复测定,酶活的单位用U/g 表示。
1.2.7 碱性磷酸酶活检测[16]取菌泥0.1 g,加入0.05 mL 甲苯轻摇15 min;碱性磷酸酶试剂盒分别对样品进行3 次重复酶活测定,酶活的单位用U/g 表示。
1.2.8 细胞膜脂肪酸的提取及含量测定
1.2.8.1 细胞膜脂肪酸的提取 参考陈境[15]的提取方式。首先,用无菌去离子水对冻前实验组与对照组反复离心洗涤三次(4000 r/min,4 ℃,5 min)。弃上清液后,称取菌泥0.5 g,向其中加入1.9 mL 氯仿-甲醇溶液(氯仿:甲醇为1:2 制备溶液,V/V),振荡15 min。加入0.625 mL 氯仿及0.625 mL 无菌去离子水,振荡15 min,离心10 min(4 ℃,8000 r/min)。吸取下层液相,移至无菌离心管。氮吹30 min 吹干,加入1 mL 甲醇钠-甲醇(1 moL/L),冰浴后振荡5 min。最后加入0.625 mL 正己烷,离心5 min(4 ℃,8000 r/min),吸取上清液后经有机过滤器移入气象瓶中。
1.2.8.2 细胞膜脂肪酸含量的测定 同1.2.8.1 参考陈境[15]的测定方式。气相色谱条件:DB-WAX 毛细管色谱柱(60 m×0.25 μm×0.25 mm);氮气,分流比5:1,流速1 mL/min;进样口250 ℃;检测口260 ℃;柱温程序:初始温度80 ℃,升温速率6.5 ℃/min;170 ℃,升温速率27.5 ℃/min;215 ℃保持2 min;升温速率40 ℃/min,230 ℃保持2 min。进样量3 μL。脂肪酸含量计算采用面积归一法。
1.2.9 菌株的贮藏稳定性 菌株经真空冻冻干燥后,置于25 ℃恒温箱中避光贮藏,每隔一周取出计数。
1.3 数据处理
气相数据为仪器记录数据导出后经Excel 处理得出。数据均为3 组平行实验得到,应用SPSS26.0软件进行显著性分析,P<0.05 为显著性水平,并使用Origin 2018 与Excel 进行绘图。
2 结果与分析
2.1 不同钙离子浓度对LIP-1 真空冷冻干燥存活率的影响
如图1 所示,对照组(普通MRS 培养基)中,植物乳杆菌LIP-1 冻前生长量为(3.30±0.54)×109CFU/mL;钙离子浓度低于1 mmol/L 时,其冷冻干燥存活率逐步提升。但当钙离子浓度为0.75 mmol/L时,菌株冷冻干燥前,培养基已经对菌株的生长出现了抑制作用,造成了冷冻干燥前菌株生长量降低,即使存活率高于其他组,但实际活菌数仅为(3.50±0.33)×109CFU/mL。钙离子浓度为0.5 mmol/L 时,冻前菌株生长量达到了(4.02±0.38)×109CFU/mL,冻干后菌株存活数相较对照组增长了69.63%,为(3.08±0.27)×109CFU/mL,其冷干前后活菌数均高于其他组,且冷冻干燥存活率(76.67%±5.00%)相较未添加钙离子的对照组(55.15%±1.50%)显著提高(P<0.05),菌株拥有较高的冷冻干燥抗性,因此选择钙离子浓度为0.5 mmoL/L 进行下一步试验。

图1 不同Ca2+浓度(mmol/L)对LIP-1 真空冷冻干燥存活率的影响Fig.1 The effect of different concentrations of Ca2+ on the survival rate of LIP-1 vacuum freeze-drying
2.2 钙离子对植物乳杆菌LIP-1 细胞形态的影响
如图2 所示为植物乳杆菌LIP-1 在不同培养条件下的显微电镜下的长度分布图。由图2 可知,对照组(普通MRS 培养基)培养下植物乳杆菌LIP-1 的长度范围集中在1.1 ~1.7 μm 之间,而添加了0.5 mmoL/L 钙离子培养出的植物乳杆菌LIP-1 则集中分布于0.8~1.4 μm 之间。经含有钙离子的MRS培养基(对照组)培养出的植物乳杆菌LIP-1 平均长度相较于普通MRS(实验组)培养基培养出的植物乳杆菌LIP-1 长度缩短了约0.4 μm,这一实验结果与张钰[1]研究相同。相关文献表明,短杆相较于长杆更具稳定性[10],因此当植物乳杆菌LIP-1 加入0.5 mmoL/L的钙离子后具有较高的冷冻干燥抗性。

图2 对照组(MRS)与实验组(添加0.5 mmoL/L 钙离子的MRS)的长度分布图Fig.2 Experimental group (MRS with 0.5 mmoL/L calcium ion) and control group (MRS) length distribution diagram
2.3 细胞壁损伤评价
如图3 所示为植物乳杆菌LIP-1 在不同培养条件下,经真空冷冻干燥前后菌株的碱性磷酸酶变化。碱性磷酸酶(AKP)存在于细胞壁和细胞膜之间,正常情况下细菌培养液中只能检测到少量的AKP,只有当细胞壁通透性增大或损坏时,指示液中AKP 含量才会增加,所以可以通过检测AKP 活性来反映细胞壁损伤的情况[16]。由图3 可知,冷冻干燥处理前对照组和实验组AKP 的酶活无显著差异(P>0.05)。经冷冻干燥处理后,对照组与实验组AKP 的含量均显著增加(P<0.05),说明菌体经冻干处理后,菌体的细胞壁受到损伤,且对照组AKP 的含量(595.45±3.55)U/g 显著高于实验组(543.75±2.50)U/g(P<0.05)。结果表明,适当的添加钙离子可提高菌体细胞壁的稳定性。

图3 真空冷冻干燥前后LIP-1 的碱性磷酸酶变化Fig.3 Changes of alkaline phosphatase of LIP-1 before and after vacuum freeze-drying
2.4 细胞膜损伤评价
如图4 所示为植物乳杆菌LIP-1 在不同培养条件下,经真空冷冻干燥前后菌株的Na+K+-ATP 酶活性变化。Na+K+-ATP 酶是一种生物膜酶,存在细胞膜的磷脂双分子层中,通过催化ATP 水解提供能量,驱动Na+向细胞外和K+向膜内进行运输,维持细胞膜两侧的膜电位及乳酸菌菌体细胞的正常生理功能。所以Na+K+-ATP 酶可以在一定程度上反映细胞膜的通透性[16]。在真空冷冻干燥前实验组与对照组酶活性无显著差异,分别为(19.32±0.12) U/g 与(19.41±0.22)U/g。经冷冻干燥后对照组与实验组出现了显著差异(P<0.05),对照组酶活为(10.65±0.15)U/g,实验组是(16.85±0.26)U/g,这说明经实验组培养出的菌株相较于对照组(普通MRS 组)有效的提升了菌株的抗冷冻干燥性。
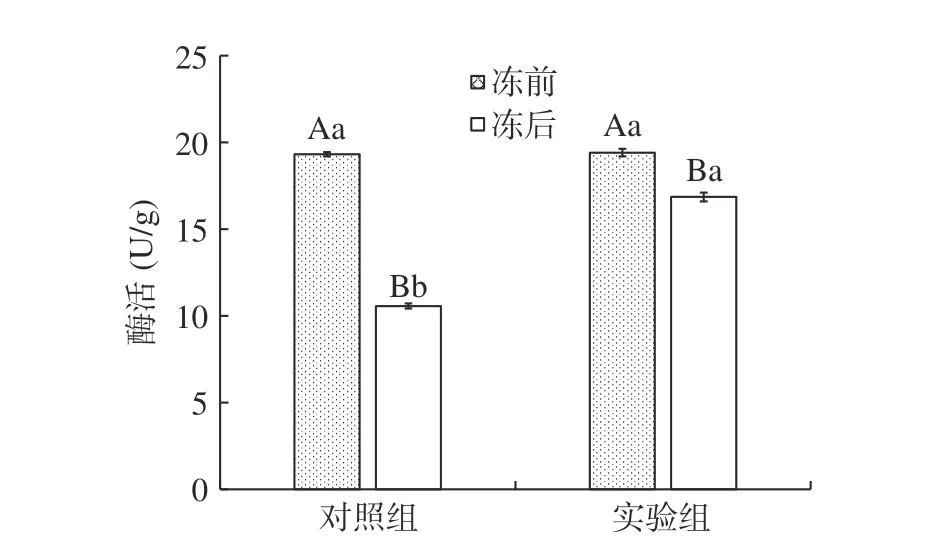
图4 真空冷冻干燥前后菌株的Na+K+-ATP 酶活性变Fig.4 Changes of Na+K+-ATPase activity of strains before and after vacuum freeze-drying
2.5 钙离子对植物乳杆菌LIP-1 细胞膜脂肪酸的影响
细胞膜脂肪酸组成成分是影响菌株抗冷冻干燥性能的重要指标。在冷冻干燥过程中,乳酸菌可以通过脂肪酸脱氢酶调节饱和/不饱和脂肪酸的比例。饱和/不饱和脂肪酸的比例决定了细胞膜的流动性和完整性,不饱和脂肪酸相对含量高的菌株具有较好的细胞膜流动性和完整性,从而提高菌体对冻干的抵抗能力[5,13]。通过对细胞膜脂肪酸的测定发现(如图5所示),细胞膜中主要包含8 种细胞膜脂肪酸,分别为月桂酸(C12:0)、肉蔻豆酸(C14:0)、棕榈酸(C16:0)、棕 榈 油 酸( C16:1) 、 硬 脂 酸( C18:0) 、 油 酸(C18:1w9c)、亚油酸(C18:2)及环丙烷脂肪酸(19cyc9,10);实验组与对照组脂肪酸的相对含量存在显著性差异,其中,棕榈酸(C16:0)和肉蔻豆酸(C14:0)两种饱和脂肪酸占总脂肪酸比例显著降低(P<0.05),而油酸(C18:1w9c)、环丙烷脂肪酸(19cyc)以及亚油酸(C18:2)占比却显著提升(P<0.05)。并且实验组中不饱和度(U/S)为0.6312 明显高于对照组(0.5587)。因此,在培养基中适当的添加Ca2+可使细胞膜的不饱和脂肪酸含量增加,不饱和度(U/S)的比值升高,提高了细胞膜的流动性和完整性,从而明显提高了菌体的冷冻干燥抗性。
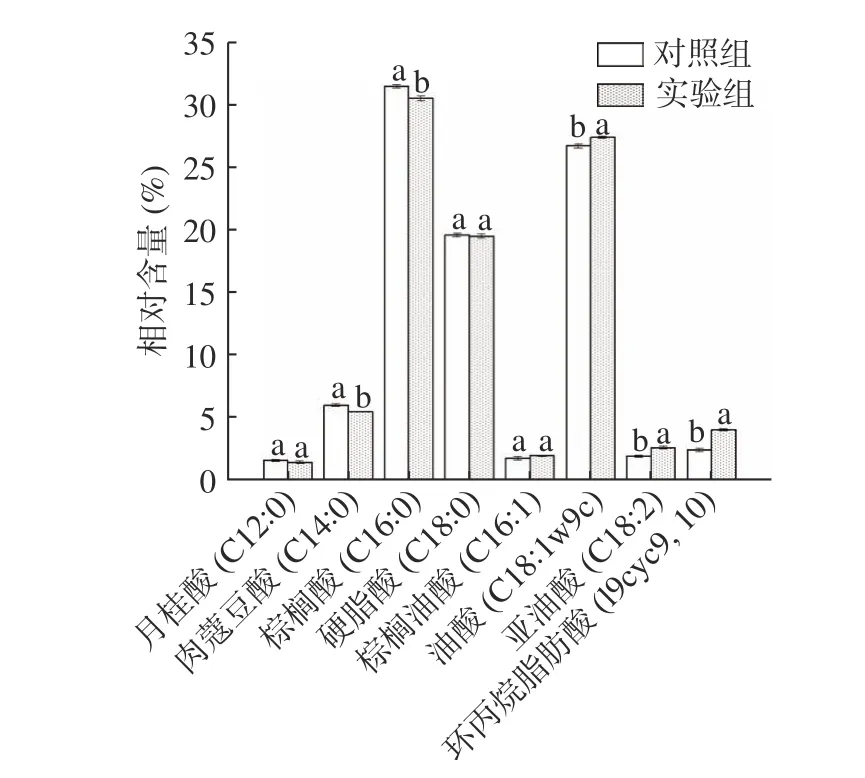
图5 普通MRS(对照组)与添加0.5 mmoL/L Ca2+(实验组)的细胞膜脂肪酸组成Fig.5 Proportion of main fatty acids of LIP-1 cultured by ordinary MRS (control group) and 0.5 mmoL/L Ca2+(experimental group)
有研究报道,细胞中蛋白酶、脂肪酶、ATP 酶等多种酶,均与钙离子的作用相关[17]。Heibrunn 等[18]报道,Ca2+具有影响酶活性、调节细胞膜的透性、控制代谢等功能[19]。由此我们推测Ca2+可能通过调节脂肪酸脱氢酶的活性从而调节细胞膜饱和/不饱和脂肪酸的比例,进而提高了菌株的冷冻干燥抗性。
2.6 不同浓度钙离子对菌株冷冻干燥后常温贮藏稳定性的影响
如图6、图7 所示,本研究通过检测真空冷冻干燥后植物乳杆菌LIP-1 在25 ℃环境下贮藏8 周的活菌数反映其贮藏稳定性,同时通过存活率变化评价其下降幅度。由图6 可知,菌株在贮藏2~8 周时,在培养基中添加了钙离子可显著提升菌株活菌数且存活率降幅较小,从而提高了菌株的贮藏稳定性(P<0.05)。随着钙离子浓度的增加,菌株贮藏稳定性提高。由于当钙离子浓度过高时菌株生长会受到抑制,影响了贮藏初始菌株密度,从而造成了第8 周时2 mmoL/L 钙离子虽然拥有较高的存活率,但是实际活菌数仅为(8.7±0.11)×108CFU/mL,低于添加钙离子培养基的其他组。这表明,钙离子的加入可以有效地提高植物乳杆菌LIP-1 的贮藏稳定性,并且随着钙离子浓度升高,贮藏稳定性随之升高[20]。钙离子对细胞壁、细胞膜的保护作用[13]可提高菌株的冷冻干燥抗性及贮藏稳定性。普通MRS 培养基中,初始菌浓度为(2.31±0.18)×109CFU/mL,当贮藏8 周后,活菌数为(1.9±0.14)×108CFU/mL,存活率仅为8.06%。综上所述,当钙离子浓度为0.5 mmoL/L 时,菌株生长情况良好,8 周内贮藏稳定性较高,经8 周贮藏后的活菌数仍有(1.09±0.11)×109CFU/mL。
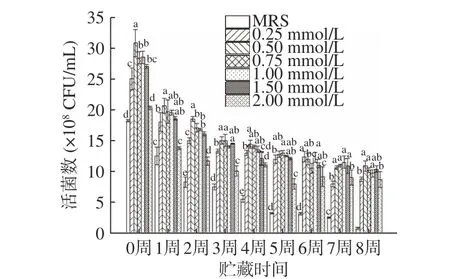
图6 LIP-1 经不同浓度Ca2+培养后的常温贮藏活菌数Fig.6 The number of viable bacteria stored at room temperature after LIP-1 was cultured with different concentrations of Ca2+
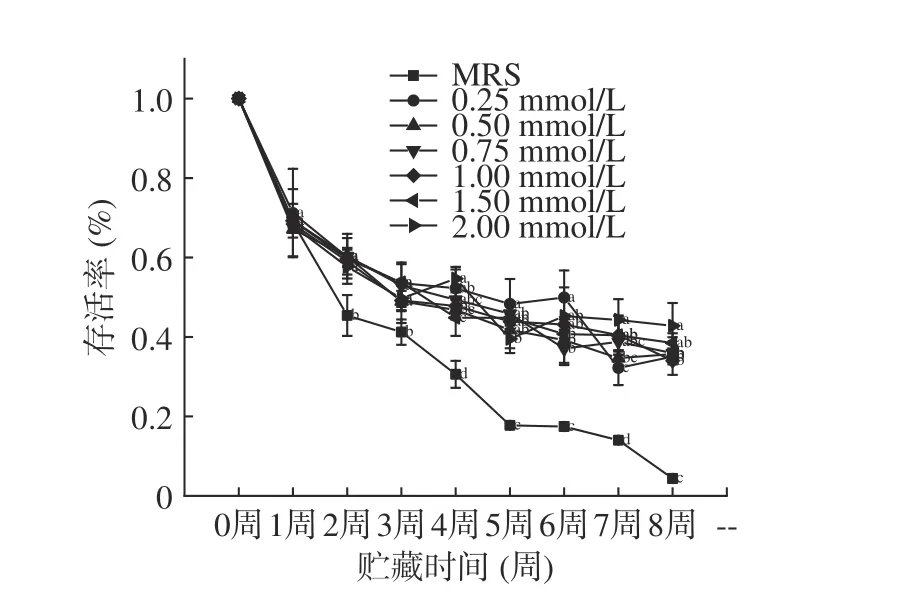
图7 LIP-1 经不同浓度Ca2+培养后的常温贮藏存活率Fig.7 The survival rate of LIP-1 after being cultured with different concentrations of Ca2+
3 讨论
不同培养基成分会造成菌株形态和生理上的改变,进而导致了其对外界不良环境的抗性不同。首先从形态上,在培养基中添加例如猪源蛋白胨[21]和钙离子[22−23]等会缩短菌株形态,此时菌体表面积减小,在冷冻过程中形成的冰晶对其细胞膜的机械损伤减少,从而菌体的冷冻干燥抗性提高。在本实验中,当培养基中添加0.5 mmoL/L 的钙离子时,菌株形态由长杆转变为短杆,且菌株的生长量由(3.3±0.54)×109CFU/mL 增加到(4.02±0.38)×109CFU/mL,冻干存活率提高了21.52%,这一结果再次验证在冻干过程中,钙离子可以通过改变菌株形态减少其在冷冻过程中所受到的损伤。
对于细菌而言,细胞壁与细胞膜至关重要。其中,细胞壁是位于细胞膜外的一层较厚、较坚韧并略具弹性的结构,使细菌既能适应多变的环境,又能维持细菌的结构[11]。本研究通过对AKP 酶的泄漏量的测定来评估细胞壁的损伤程度,发现钙离子的加入有效保护了植物乳杆菌LIP-1 的细胞壁完整性,降低了其在冷冻干燥中受到的损伤,这是由于钙离子可通过电荷作用来维持细胞壁的完整性[24]。
细胞膜可以使菌体与外部环境隔离,是保护乳酸菌的主要屏障。在冷冻干燥过程中,细胞膜受损也是导致细菌死亡的主要原因之一[25]。Na+K+-ATP 酶可以使横跨膜产生电势,从而起到维持细胞内外pH 动态平衡的作用。冷冻干燥过程会使得Na+K+-ATP 酶活性降低甚至失活[26],从而细胞膜完整性受损,细菌的冻干存活率降低。因此可以通过测定Na+K+-ATP 酶活性来评价细胞膜的损伤程度。本研究发现钙离子的加入有效保护了植物乳杆菌LIP-1 的细胞膜,降低了其在冷冻干燥中受到的损伤。这与细胞膜脂肪酸成分的改变有密切联系。菌株在冷冻干燥后,其细胞膜结构受损,其中的不饱和脂肪酸相对含量是评估冷冻干燥过程细胞膜流动性与完整性的重要指标[27]。Li 等[28]发现不饱和脂肪酸含量高的菌株,在冷冻干燥过程中会有更大的存活率。并且,适当改变培养基成分可使细胞膜上饱和脂肪酸向不饱和脂肪酸转变速率加快,从而有助于保持膜在冻干过程中的流动性[29]。但目前关于添加钙离子对经冻干处理后菌株细胞膜的变化尚未报道。本研究通过对Na+K+-ATP 酶活性以及脂肪酸含量变化的检测,评价了钙离子对细胞膜的保护作用。结果表明,钙离子的加入提高了Na+K+-ATP 酶的活性,进而更好地维持了细胞膜的通透性,降低了细胞膜的损伤程度;同时,细胞膜中不饱和脂肪酸的含量升高,U/S 变大,细胞膜流动性增强,提高了菌株的冷冻干燥存活率。综上所述,在培养基中添加钙离子可有效保护菌株的细胞壁、细胞膜,提高了细胞膜的流动性,从而使菌株具有较强的冷冻干燥抗性及贮藏稳定性。但本研究并未结合基因组学,蛋白组学,代谢组学等对细胞的变化进行深入探讨,只是基于表观特征初步的探讨了钙离子对菌株的影响,还需进一步研究。
4 结论
在培养基中添加适当浓度的钙离子(0.5 mmoL/L),可以促进植物乳杆菌LIP-1 的生长量,相较于未添加钙离子的培养基活菌数增长了0.717×109CFU/mL,并且显著提高其冷冻干燥存活率。经电镜实验发现添加钙离子使菌株形态由长杆向短杆转变,平均长度缩短0.4 μm;通过关键酶活的检测发现实验组有效的保护了菌株的细胞壁与细胞膜;通过对其脂肪酸成分的测定发现细胞膜中不饱和脂肪酸的含量升高,U/S 变大(实验组(0.6312)明显高于对照组(0.5587)),致使细胞膜流动性增强,进而显著的增加了植物乳杆菌LIP-1 的冷冻干燥存活率。

