无锡市企业执行《医疗器械不良事件监测和再评价管理办法》的现状调查与分析
王文联,曹俐娜
无锡市药品不良反应监测中心,江苏无锡 214000
医疗器械不良事件监测和再评价是实施医疗器械上市后监管的重要工作内容,是强化医疗器械全生命周期科学监管,提高监管成效的重要举措[1-2]。为加强医疗器械不良事件监测和再评价工作,落实医疗器械上市许可持有人(以下简称 “持有人”)不良事件监测和再评价主体责任,保障公众用械安全,国家市场监督管理总局令第1 号《医疗器械不良事件监测和再评价管理办法》[3-4](以下简称《办法》)已于2019 年1 月1 日起施行。“国家医疗器械不良事件监测信息系统” 这一新的信息化系统也于2019 年1 月1 日起启用。
目前,《办法》实施已经两年有余,该文通过调查2019年1—12 月该市100 家持有人在履行《办法》等法规义务的真实现状、医疗器械不良事件(以下简称 “MDR”)监测工作开展的实际情况,及时发现其中的实际问题与困难,并进行分析和对策研究,为提高持有人MDR 监测能力提出合理化建议,为《办法》的更好落实提供现实依据。 报道如下。
1 资料与方法
1.1 一般资料
对2019 年1—12 月在 “国家医疗器械不良事件监测信息系统” 注册的无锡市的持有人开展问卷调查。 随机抽取了100 家持有人发放调查问卷,每家持有人发放一份调查问卷,共计100 份,由持有人监测部门负责人或监测业务骨干填写,回收有效调查问卷100份。
1.2 研究方法
问卷调查法为该文采用的核心方法,主要用于收集持有人关于《办法》施行后的执行现状的相关数据,包括单位基本信息、组织机构与人员现状、持有人主动收集及上报情况、个例MDR 监测情况、群体MDR 监测情况、定期风险评价报告完成情况、重点监测情况、再评价情况、分析和建议,主要以选择题的形式作答(单选、多选两种类型)。 此外,与各领域医疗器械监测专家开展深度访谈作为补充。
对回收的100 份有效问卷,使用SPSS(Statistical Product and Service Solutions)统计软件进行数据录入、整理与统计分析。
2 结果
2.1 样本基本情况
100 家持有人2019 年通过 “国家医疗器械不良事件监测信息系统” 总计收到反馈报告1 604 份,最多为545份,最少为0 份。 持有人完成反馈报告评价数1 582 份,评价率为98.6%。 仅1 家企业进行了主动上报工作,共上报了11 份不良事件报告。
2.2 持有人监测部门与人员情况
对调查结果显示:持有人均建立了医疗器械质量管理体系。 22%的持有人有开展MDR 监测工作的独立部门,76%有开展该项工作的依托部门,2%的持有人既无独立部门,也无依托部门。 98%的持有人对指定部门的MDR 监测职责有相关文件进行明确规定,见表1。

表1 持有人MDR 监测部门情况
所有的持有人都配备有开展MDR 监测工作的专兼职人员,其中有专职人员的企业占50%,其余由兼职人员负责。
2.3 持有人建立自主收集报告的途径情况
在调查结果显示,96%的持有人都能够主动开展不良事件信息收集工作,但效果不佳,2019 年仅1 家持有人主动上报了不良事件报告,尚有4%的持有人未主动收集不良信息。
持有人主动收集个例不良事件的主要途径及其占比为:医疗机构途径(28.5%),经营企业途径(27.8%),电话/热线途径(23.8%),文件检索途径(8.6%),企业网站途径(7.9%),其他途径(3.3%)。
2.4 持有人关于MDR 监测情况
对于个例MDR 监测:94%的持有人已经建立了个例MDR 监测处理程序;96%的持有人在发现或获知可疑MDR 后能够立即调查原因;84%的持有人的能够在报告时限内上报死亡及严重伤害事件;对于死亡、致严重伤害、可能导致严重伤害的事件,80%的持有人能够按要求在规定时间内开展调查、分析和评价工作,6%的持有人偶尔会超过时限要求;14%的持有人目前尚未开展相关工作,见表2。
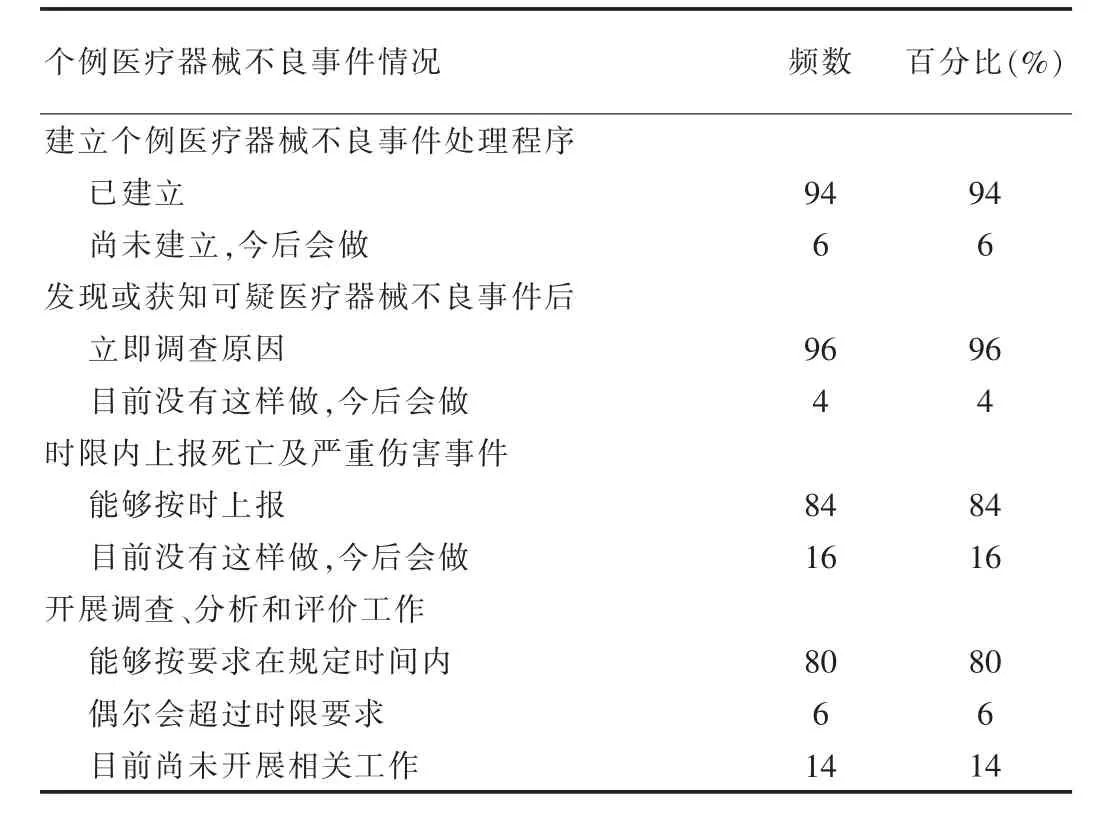
表2 个例MDR 监测工作情况
对于群体MDR 监测:82%的持有人制定了群体MDR 应急预案/处理程序。 目前,所调查的持有人均未发生过群体事件。 对于MDR 监测记录及后续追踪:90%的持有人已经建立并保存MDR 监测记录;90%的持有人能够开展持续跟踪和处理监测信息的工作。
2.5 持有人完成定期风险评价报告情况
调查结果显示,全部的持有人都制定了医疗器械产品上市后定期风险评价报告程序文件和制度。 78%的持有人能够按照已制定的程序文件和制度,按时限要求规范撰写和递交报告,22%的持有人不能规范地按照要求撰写和递交报告。
结果显示,调查企业中仅1 家持有人有创新医疗器械,但目前未收到其主动开展监测工作的文件。
2.6 持有人风险控制情况
结果显示,92%的持有人会对反馈报告进行分析评价,其中45.7%的持有人能够定期进行分析评价,54.3%的持有人不定期进行。在分析评价过程中,39.1%的持有人发现了风险信号,且展开了调查,见表3。

表3 持有人对反馈报告的分析评价情况
调查企业中62%的持有人没有在境外销售的产品,28%的持有人在境外销售并能能够按照要求上报境外发生的医疗器械不良事件的控制措施以及在境内拟采取的控制措施,但仍有10%的持有人虽然在境外销售,但不能及时上报控制措施。
76%的持有人采取过风险控制措施,12%的持有人未采取过风险控制措施。 采取过风险控制措施的持有人主要采取的风险控制措施有:改进工艺占28.3%,其次为主动提出说明书修改25.0%,通过致医生信、持有人网站、媒体等途径将风险告知医务人员和公众占20.0%,主动召回产品占18.3%,其他占8.3%。
2.7 持有人再评价情况
调查结果显示,50%的持有人能够主动开展再评价工作,对原注册资料完成重新评价内容的占比分别为:产品风险分析资料(25.7%),说明书、标签等内容(24.3%),产品技术要求(20.0%),研究资料(12.9%),临床评价资料(10.0%),综述资料(7.1%)。
2.8 持有人面临的工作难点及存在问题
调查结果显示,持有人工作难点主要集中在定期风险评价完成工作(19.0%)、主动收集和上报工作中(18.1%)以及个例医疗器械不良事件分析评价工作和再评价工作(17.1%)等,见表4。 持有人在开展监测工作面临的主要问题有:企业人员相对匮乏、持有人对医疗器械不良事件监测工作的投入相对有限以及技术指导不到位等,见表5。

表4 医疗器械生产企业面临的监测工作难点

表5 医疗器械企业开展监测工作面临的主要问题
3 讨论
3.1 持有人MDR 监测情况有待提高
100 家持有人都建立了医疗器械质量管理体系,均配备有开展MDR 监测工作的专(兼)职人员。 但通过此次调查分析发现,持有人在执行《办法》过程中仍存在诸多问题:被调查的100 家持有人中,仅1 家企业主动上报了11 份不良事件报告;在发现或获知可疑MDR 后:4%的持有人不能够立即调查原因;对于死亡、致严重伤害、可能导致严重伤害的事件:16%的持有人的不能够在报告时限内上报;对于死亡、致严重伤害、可能导致严重伤害的事件的调查、分析和评价工作:6%的持有人偶尔会超过时限要求、14%的持有人目前尚未开展相关工作;对于群体MDR:仍有18%的持有人尚未制定群体MDR应急预案/处理程序;仍有22%的持有人未能按时限要求规范撰写和递交上市后定期风险评价报告;有10%的持有人在境外销售,未及时上报控制措施。
3.2 持有人MDR 监测工作难题亟待解决
持有人认为在监测工作中存在难点主要为定期风险评价完成工作、主动收集和上报工作、个例MDR 监测分析评价工作和再评价工作。 这是因为这几项工作需要人员相对固定且需长期进行,对工作人员的业务熟悉程度以及职业敏感度要求比较高。而企业人员流动较快,岗位、职责变动较快,导致员工对监测工作一知半解,监测工作完成情况参差不齐。
持有人所存在的主要问题包括:①专业人员相对匮乏。 现阶段而言,持有人对监测工作的重视程度还不够高,从事监测工作的人员大多为兼职人员且人员较少,监测工作完成度不高或超时限完成。 ②对MDR 监测工作的投入相对有限。 绝大部分持有人没有设立专门的MDR 信息收集团队,没有相应的岗位职责要求,相关培训较为匮乏。 ③技术培训不到位。 目前《办法》已经实施两年多,监管部门和监测机构开展了数次培训,但是企业参与度不高[5]。
据《办法》要求,持有人应当对其上市的医疗器械进行持续研究,评估风险情况,承担医疗器械不良事件监测的主体责任,根据分析评价结果采取有效控制措施,并履行相应法规义务[6]。 上述调查情况说明持有人在主动报告、MDR 监测、定期风险评价以及风险控制等方面与《办法》要求有一定差距,需要有所改进。
4 建议
4.1 持有人层面
①强化持有人主体责任意识。《办法》进一步明确了以企业为主体直接报告医疗器械不良事件的要求。 上市后MDR 监测和再评价也是医疗器械全生命周期管理的核心内容[7]。 持有人应真正认识到MDR 监测工作与企业发展、产品质量命运的密切关系,全程贯彻主体责任,严把医疗器械研发、注册、生产、上市及售后各个环节关口,注重MDR 监测和报告,全力降低各种风险发生概率,确保企业持续健康运营发展[8-9]。
②构建专业的监测队伍。 一是建立具有医疗器械、流行病学、统计学等相关专业背景的高学历和/或高职称的MDR 监测团队[10],明确相应的岗位职责、制定完善的质量管理体系,通过责任明确化、行为规范化,不让制度流于形式,有效推动监测工作的深层次开展。 二是加强对MDR 监测人员的理论与技术培训,经常性地组织内部培训或派员参加国家、省、市市场监管部门或监测机构的培训,及时把握监测动态,更新监测理论水平和技术能力。三是针对性地提升监测人员在多途径收集信息、多角度提取分析、综合评价安全风险、及时主动采取有效措施等方面的能力,同时定期组织开展不良事件群体、突发事件的演练,在实践中逐步形成高效的不良事件处理流程[11]。
③拓宽MDR 信息收集渠道。 持有人应充分发挥营销和临床使用终端业务人员的主体作用,通过动向经营企业、医疗机构、患者收集MDR 信息、定期对数据库进行文献检索获取产品安全性信息等, 多渠道收集MDR信息[12]。 同时,借助网络平台,构建持有人自身的信息传递网络,一旦收集到MDR 信息,能快速在持有人内部共享,并报至MDR 监测专门部门进行后续处理。
4.2 监管层面
①建立MDR 监测工作联动机制。 建立市场监督管理部门与卫生行政部门的协调工作机制,通过联合发文,出台相关政策,明确医疗机构与持有人在MDR 信息沟通方面的工作要求,医疗机构及时上报MDR,同时将信息及时反馈给持有人,以便持有人不断改进产品,有效控制风险,切实保障医疗器械的安全性、有效性[13]。 建立健全监测联动机制,探索创建政府监管、企业负责、医疗机构协同和社会媒体监督的医疗器械监测管理体系,通过对MDR 监测收集医疗器械的真实使用数据,及时采取有效措施规避剩余风险,形成有效的监管网络,良好的社会共治格局[14]。
②完善MDR 监测检查机制。对医疗器械生产企业和产品上市后开展的现场检查是监督企业落实MDR 监测责任的重要手段[15]。 监管部门应转变目前以工作指导代替检查的工作模式,切实用好《办法》这一法律依据,重视对MDR 监测的现场检查,及时发现企业在组织机构、人员、制度等方面的问题,对生产企业实施风险等级的即时评价与诚信管理的周期性评价相结合的全程动态管理[16],以行政手段督促企业落实主体责任,让MDR 监测和再评价工作真正融入企业生产质量管理体系中去,切实保障上市后医疗器械安全有效。
③大力开展宣传培训。 各级监测部门应经常性组织持有人、医疗机构开展MDR 监测工作专题培训[17],培训内容涵盖如何发现和上报MDR、如何规范填写报告表、如何提高报告质量等基础知识[18]和挖掘风险信号、开展重点监测等内涵性业务知识,在提高企业人员、医务人员发现、收集、报告MDR 能力的基础上,不断提升监测人员的医疗器械安全风险信号发现识别能力[19],引导持有人对发生不良事件的原因进行深入挖掘研究,提前预警潜在风险,切实保障公众用械安全。

