氨氮胁迫下菲律宾蛤仔肝胰腺内参基因的筛选
徐宏超,邢荣莲,李源美,丛明
烟台大学,烟台 264005
过去30年,我国海水养殖规模迅猛发展,产量得到快速增长。其中,海洋软体动物的产量最高,达到海水养殖总产量的72.6%~78.6%,因此成为我国海水养殖产量的主要贡献者[1]。海岸带区域是海洋生物特别是海洋软体动物的重要养殖区域[2],海岸带环境的健康状况与软体动物尤其贝类养殖的健康发展密切相关。随着现代工农业的快速发展和人民生活水平的大幅提高,大量污染物未经过严格的净化处理就排放到环境中,并随着径流进入海洋环境中。由于海岸带位于河流和海洋的交汇处,因此陆源污染导致海岸带的污染状况尤其严重。国家海洋水质质量标准规定,养殖海域非离子氨的限定浓度为0.02 mg·L-1(GB11607—89)。然而,2019年中国生态环境报告显示,入海河流的氨氮浓度范围为0.02~26.4 mg·L-1,平均浓度为0.64 mg·L-1,远远超过养殖区域内海水氨氮的安全浓度[3]。已有研究表明,海洋环境中的氨氮对软体动物的生长发育产生严重影响,但是对其致毒机制还不是很清楚,因此有必要从基因水平对其毒性进行分析研究[4-6]。
实时荧光定量PCR是检测基因表达的重要方法之一,可以很好地反映受试生物体中相关基因表达的变化情况。通常可以选择一个内参基因作为其他基因表达的对照,如果内参基因的表达不稳定或者是不同的实验条件下发生改变,则无法检测其他基因表达的微小变化,甚至可能导致错误的实验结果。因此,为特定的实验目的筛选合适的内参基因非常重要。理论上,内参基因的表达对维持组织细胞的生命活动是必不可少的,在细胞中的表达比较恒定。但是,研究发现在生物体不同的发育阶段、不同的组织以及不同的实验条件下基因表达水平存在很大差异[7-8]。李迪等[9]以鳜鱼6个不同组织和5个不同发育阶段为研究对象,从GAPDH、β-Actin和18SrRNA这3个备选内参基因中筛选最适内参基因。结果表明,在胚胎发育阶段β-Actin表达最稳定;不同组织样品中,GAPDH表达最稳定。鲍相渤等[10]研究Actin、GAPDH、Tubu、Cytb、Tbp和EF-1α等6个备选内参基因,在饥饿胁迫下各组织、致病菌感染前后和水环境升温前后不同时段血样中mRNA的表达情况,结果表明,饥饿胁迫条件下,在鳃、肾和血淋巴中Actin的表达稳定,但是在外套膜、肝胰脏和闭壳肌中的表达不稳定;致病菌感染条件下,Actin的表达最稳定;而在水温升高的条件下,Actin的稳定性降低;GAPDH在饥饿胁迫中的表达稳定性较差,但是在致病菌感染和温度改变的条件下相对稳定。
海洋软体动物的鳃和肝胰腺组织在免疫应答和解毒过程中都发挥重要作用,前期我们已经对无机氮胁迫条件下菲律宾蛤仔鳃组织的内参基因做了深入研究[11-12],但是对肝胰腺中内参基因的表达情况不甚了解。因此,本研究以菲律宾蛤仔为研究对象,采用环境相关浓度(0.1 mg·L-1和0.5 mg·L-1)的氨氮暴露菲律宾蛤仔,在暴露3 h、1 d、3 d、7 d和14 d后分别取肝胰腺组织作为实验材料,筛选不同浓度氨氮暴露后,菲律宾蛤仔肝胰腺组织稳定表达的内参基因。本实验选择了肌动蛋白基因(β-Actin、Actin)、转录延伸因子基因(elongation factor 1-alpha,EF-1α)、微管蛋白基因(beta-tubulin,Tubu)、核糖体(18S RNA, 18S)、泛素蛋白基因(ubiquitin,Ubi)和亲环素基因(cyclophilin A,CyPA)作为备选内参基因,以肝胰腺cDNA为模板,利用qRT-PCR检测备选基因的表达情况,并结合geNorm、NormFinder和BestKeeper程序评估其稳定性,最后通过RefFinder软件综合分析不同氨氮浓度暴露后菲律宾蛤仔肝胰腺组织的最适内参基因,为后续研究不同氨氮浓度条件下菲律宾蛤仔肝胰腺组织的基因表达提供定量分析基础。
1 材料与方法(Materials and methods)
1.1 材料
本实验所用的菲律宾蛤仔于2019年10月购自烟台莱山区佳世客超市,选取健康、生命力强、体态均匀(长3.77 cm±0.12 cm)的个体。氨氮暴露实验开始前,将菲律宾蛤仔放入室内装有40 L过滤海水的养殖池(60 cm×60 cm×30 cm)里暂养7 d,水温(18±1) ℃,pH 8.0,盐度30‰,24 h曝气供氧;按照100只菲律宾蛤仔称取1.0 g螺旋球藻喂食,每天喂食1次,喂食前和喂食后2 h各换水一次。从第8天开始,根据海水的体积、温度和pH值,向养殖池中加入对应体积的1 mg·L-1分析纯氯化铵配制的母液(国药集团,上海),使其氨氮浓度分别达到0.1 mg·L-1和0.5 mg·L-1。
我们的前期研究表明,0.1 mg·L-1和0.5 mg·L-1氨氮浓度胁迫菲律宾蛤仔21 d,能够导致菲律宾蛤仔鳃组织出现膜系统损伤、摄食功能下降、鳃组织结构损伤甚至死亡等严重毒性效应[13-14]。因此,我们同样采用相同的氨氮浓度梯度进行14 d暴露实验,即设置0.1 mg·L-1暴露组、0.5 mg·L-1暴露组和空白对照,每个实验组设置3个重复,每个重复组30只菲律宾蛤仔。当蛤仔暴露3 h、1 d、3 d、7 d和14 d后,从每个实验重复组中随机取2个蛤仔,摘取肝胰腺组织,滤纸吸干水分后迅速放入Trizol试剂中,-80 ℃保存。
1.2 总RNA提取及可用性检测
采用Trizol试剂盒(TaKaRa,大连),提取肝胰腺组织的总RNA。匀浆管中加入0.8 mL预冷的Trizol;取菲律宾蛤仔的肝胰腺组织放入匀浆管中,置于匀浆机(Bertin Precellys 24,法国)匀浆20 s;转移0.8 mL的匀浆液于1.5 mL EP管中,冰上放置5 min;加入200 μL的氯仿并用力震荡30 s,冰上放置5 min后,4 ℃ 12 000g离心10 min;取300 μL的上清液,加入等体积的异丙醇并-20 ℃放置15 min后,4 ℃ 12 000g离心5 min;倒掉上清液,RNA沉淀用1.0 mL 75%的乙醇洗涤2次,4 ℃ 7 500g离心5 min;倒掉乙醇放置超净台干燥,待乳白色沉淀变为无色胶透明状,加入30 μL RNase free水并放置于冰盒中溶解RNA沉淀;使用1%琼脂糖凝胶电泳检测RNA的完整性,利用Nanodrop 2000(Thermo Scientific,美国)检测其纯度和浓度,当OD260/OD280在1.8~2.2范围内时,认为RNA的纯度满足qRT-PCR的实验条件。
1.3 cDNA合成及扩增浓度确定
普通PCR反转录RNA合成cDNA,按照TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix (Transgen Biotech)提供的试剂和操作方案反转录合成cDNA。反应体系为:总体积20 μL,包括2 μL RNA、1 μL Anchored Oligo(dT)18Primer(0.5 μg·μL-1)、10 μL 2×TS Reaction Mix、1 μL TransScript®RT/RI Enzyme Mix、1 μL gDNA Remover、5 μL RNase-free water;反应条件为:42 ℃孵育15 min;85 ℃加热5 s失活TransScript®RT/RI与gDNA Remover。
1.4 实时荧光定量PCR
根据前期研究基础[11-12],本次实验选取Actin、EF-1α、Tubu、18S、Ubi和CyPA作为备选内参基因,其定量引物如表1所示,以菲律宾蛤仔肝胰腺组织的cDNA作为模板进行实时荧光定量PCR扩增。

表1 内参基因的引物序列Table 1 Primer sequences for housekeeping genes
实时荧光定量PCR反应在ABI 7500 Real-Time Detection System (Applied Biosystems,美国)中进行,根据TransStart Tip Green qPCR SuperMix(Transgen Biotech)提供的试剂和操作方法扩增目的基因。其扩增的体系为:总体积20 μL,包括6 μL Template cDNA、0.4 μL Forward Primer(10 μmol·L-1)、0.4 μL Reverse Primer(10 μmol·L-1)、10 μL 2×TransStart tip green qPCR superMix、0.4 μL Passive Reference Dye Ⅰ、2.8 μL Nuclease-free water;反应条件为94 ℃ 30 s;(94 ℃ 5 s、58 ℃ 15 s、72 ℃ 10 s)×40 cycles,扩增结束后进行熔解曲线的数据分析。
1.5 内参基因稳定性分析
对备选内参基因进行qRT-PCR检测获得CT值,用-2-ΔΔCT法[15](ΔCT=CTsample-CTmin)计算每个基因的相对表达量。利用geNorm[16]、NormFinder[17]和BestKeeper[18]软件3种方法对6个内参基因的表达稳定性值(expression stability value, M)进行评价,并且最终根据RefFinder软件[19]确定合适的内参基因。根据数值越小稳定性越好的原则,筛选出表达最稳定的内参基因。
geNorm软件是一款用于微软Excel平台的VBA宏程序,分析Actin、18S、Ubi、CyPA、EF-1α和Tubu的-2-ΔΔCT,输出平均稳定性值(M),M<1.5的基因被认为是可行性的基因。根据M值越小基因表达稳定性越好的原则,确定备选内参基因表达稳定性大小。另外据M值还可以得出配对差异值(Vn/Vn+1),系统默认配对差异值为0.15,若Vn/Vn+1<0.15,则最适内参基因适配数为n,若Vn/Vn+1>0.15,则最适内参基因适配数为n+1。
NormFinder是根据差异性来评估内参基因稳定性的软件,它的算法和geNorm相似,也是分析内参基因数据得出M值,根据M值越小其稳定性越好的原理筛选最佳内参基因,但是它无法确定最适内参基因的数目。
BestKeeper软件输入每个备选内参基因的CT值,并且基于标准差(SD)和变异系数(CV)值进行计算,确定内参基因的稳定性,基因的稳定性与SD和CV值成反比。SD值<1的备选内参基因被认为是可接受作为内参基因的;而SD值>1被认为是不可接受的。
RefFinder是一款基于Web的内参基因综合评估工具,根据大量的CT值评估和选择内参基因。这个软件集合geNorm、NormFinder、BestKeeper软件和ΔCT4种内参基因的评估方法,比较和排列备选内参基因。每个内参基因分配适当的权重,计算它们权重的几何平均值,最终根据赋值越小稳定性越好的原则,确定最稳定的内参基因。
2 结果(Results)
2.1 RNA、cDNA和引物的质量检测
提取的总RNA进行1%的琼脂糖凝胶电泳,有28S、18S和5S条带(图1),并且用Nanodrop 2000检测纯度,OD260/OD280在1.8~2.2范围内。结果表明,提取样品RNA的完整性和纯度良好,符合qRT-PCR的质量要求。备选内参基因的qRT-PCR结果显示,熔解曲线呈单一的峰并且重复性好(图2)。因此,所设计的引物特异性好,适合作为qRT-PCR扩增引物。

图1 对照组、氨氮胁迫组菲律宾蛤仔的肝胰腺组织总RNA电泳图谱注:C1~C6,Control组;M,Marker;A1~A6,0.1 mg·L-1氨氮胁迫组;B1~B6,0.5 mg·L-1氨氮胁迫组。Fig. 1 Gel electrophoresis of total RNA samples from the hepatopancreas tissues of R. philippinarum in the control and ammonia nitrogen exposed groupsNote: C1~C6 denote control groups; M denotes Marker; A1~A6 denote 0.1 mg·L-1 of ammonia nitrogen-exposed groups; B1~B6 denote 0.5 mg·L-1 of ammonia nitrogen-exposed groups.

图2 6个备选内参基因扩增产物的熔解曲线Fig. 2 Melting curves of PCR products from 6 reference genes
2.2 cDNA的浓度确定
对样品cDNA模板进行梯度稀释,稀释倍数为10倍、20倍、100倍、200倍和1 000倍。qRT-PCR结果表明,10倍和20倍稀释浓度下CT值在20.0~25.0之间,其他的稀释浓度的CT值>25.0。因此,10倍和20倍稀释浓度的cDNA模板适合作为检测模板,本次实验采用稀释20倍的cDNA为定量模板。
2.3 内参基因稳定性分析
2.3.1 geNorm软件分析
通过geNorm软件分析(表2),得到Actin、18S、Ubi、CyPA、EF-1α和Tubu的平均表达稳定性值M值分别为1.029、1.207、1.029、1.085、1.861和1.403。根据M值越小基因的稳定性越好的原则,6个备选内参基因的稳定性大小为Actin=Ubi>CyPA>18S>Tubu>EF-1α。因此,geNorm分析表明Actin和Ubi是表达相对最稳定的内参基因。
内参基因的数目通过geNorm软件分析得到的配对差异值Vn/Vn+1来确定,一般默认值为0.15,当Vn/Vn+1<0.15时,选择n个基因作为内参基因,不必添加基因来提高基因表达分析的准确性;当Vn/Vn+1>0.15时选择n+1个基因作为内参基因。在本研究中Vn/Vn+1均>0.15(图3),无法通过geNorm确定内参基因的数目。

图3 geNorm分析氨氮暴露后内参基因表达的稳定性Fig. 3 Stability value of reference gene expression after ammonia nitrogen exposure by geNorm
2.3.2 NormFinder软件分析
NormFinder分析结果显示(表2),6个备选内参基因的表达稳定值分别为Actin(0.075)、18S(0.416)、Ubi(0.363)、CyPA(0.284)、EF-1α(0.932)和Tubu(0.475),即NormFinder分析表明表达最稳定的基因是Actin。
2.3.3 BestKeeper软件分析
BestKeeper软件分析结果显示(表2),Actin、18S、CyPA和Ubi的SD值分别为0.99、0.67、0.81和0.47,均<1;Tubu和EF-1α的SD值分别为1.11和2.19,均>1。根据BestKeeper软件的规则,SD值<1的基因可接受作为内参基因,否则不可接受为内参基因。因此,BestKeeper软件分析可知Actin、18S、CyPA和Ubi可接受为内参基因,其中Ubi是表达最稳定的内参基因。
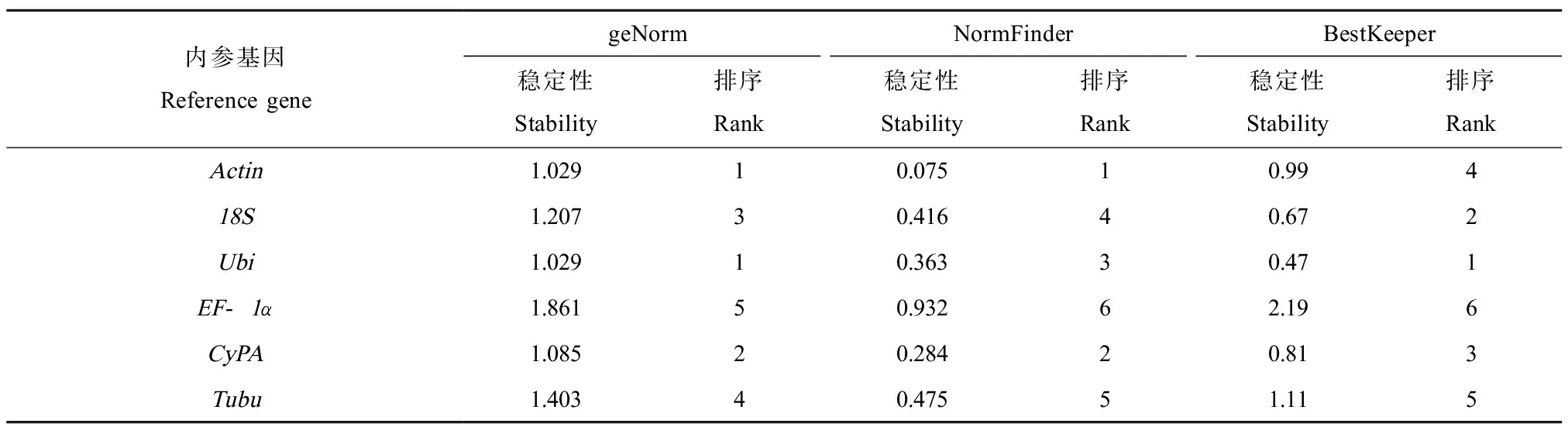
表2 geNorm、NormFinder和BestKeeper分析稳定值排名Table 2 Stability ranking by geNorm、NormFinder and BestKeeper analysis
2.3.4 综合排名分析
通过在线软件RefFinder集合geNorm、NormFinder、BestKeeper软件和ΔCT的内参基因评估方法,将各基因的CT值输入程序中,程序为每个基因赋值排序,赋值越小则表达越稳定。RefFinder综合分析6个备选基因表达稳定性大小依次为(表3):Actin(1.32)、18S(1.83)、Ubi(2.00)、CyPA(2.71)、Tubu(5.00)和EF-1α(6.00)。因此,不同浓度氨氮暴露菲律宾蛤仔的肝胰腺组织中,表达相对最稳定的内参基因是Actin。
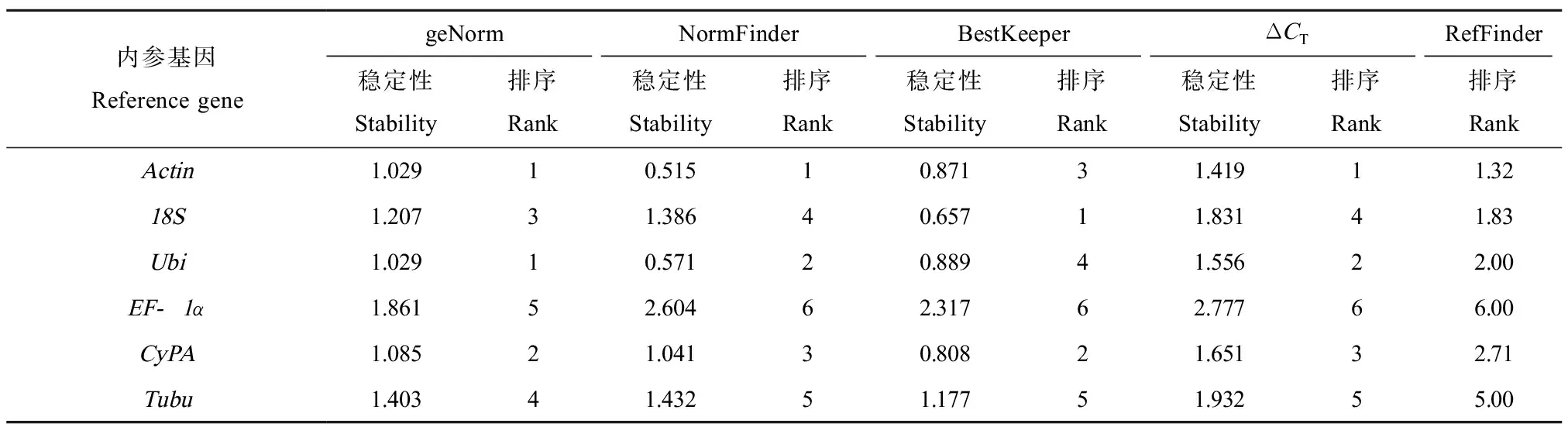
表3 RefFinder分析稳定值排名Table 3 Stability ranking by RefFinder analysis
3 讨论(Discussion)
目前,荧光定量PCR是快速、可靠定量目标基因表达水平的常用方法。为了准确比较不同实验条件下mRNA的转录水平,需要选择一个表达稳定的内参基因作为对照[20]。闫含笑等[21]在研究池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析时,采用Actin作为内参基因,对不同组织中的β-连环蛋白基因进行表达定量分析;程雪艳等[22]利用qRT-PCR技术,分析谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)基因在泥蚶的不同组织以及重金属刺激后的表达量时,选取18S作为内参基因。关于菲律宾蛤仔内参基因的筛选,牟政强等[23]以菲律宾蛤仔的不同发育阶段和不同组织为研究材料,运用qRT-PCR技术结合3个内参基因筛选方法geNorm、NormFinder及△CT对12个备选内参基因进行稳定性分析,发现菲律宾蛤仔在不同发育时期表达较稳定的内参基因是CYTC、CYTB5和RPS23,菲律宾蛤仔成体不同组织中表达稳定的内参基因是CYTB5和GFRP2,Actin在菲律宾蛤仔的不同组织和不同发育阶段表达皆最不稳定。曹滕飞等[11]以经0.1 mg·L-1氨氮暴露后的菲律宾蛤仔鳃组织为研究材料,筛选稳定表达的内参基因,发现EF-1α是表达最稳定的内参基因。王爱云等[12]以经亚硝态氮暴露的菲律宾蛤仔为研究对象,发现Actin可作为研究亚硝态氮对菲律宾蛤仔鳃组织基因功能的内参基因。综上可见,即使是同一种生物,受到不同的胁迫处理、同一暴露物的不同暴露浓度、不同发育阶段和不同组织等条件下,其内参基因表达的稳定性存在极大差异。因此,为了确保检测目的基因表达水平的准确性,当实验条件发生改变时,相应的内参基因筛选工作需要重新进行。
本研究中,使用geNorm、NormFinder和BestKeeper程序分别评估不同氨氮浓度(0.1 mg·L-1和0.5 mg·L-1)暴露下,菲律宾蛤仔肝胰腺组织内参基因的表达稳定性,最后通过RefFinder程序综合评估内参基因的稳定性。根据geNorm软件对6个备选内参基因表达的分析结果,备选内参基因稳定性大小为,Actin=Ubi>CyPA>18S>Tubu>EF-1α;NormFinder分析结果表明,菲律宾蛤仔肝胰腺组织中备选内参基因稳定性大小为Actin>CyPA>Ubi>18S>Tubu>EF-1α;BestKeeper软件分析SD值<1的18S(0.67)、CyPA(0.81)、Actin(0.99)和Ubi(0.47)可作为内参基因,其稳定性大小为Ubi>18S>CyPA>Actin。
由于geNorm、NormFinder和BestKeeper软件评估的侧重点不同,其分析结果存在差异。因此,我们利用包含上述3种方法以及ΔCT的RefFinder程序综合评估内参基因的稳定性,为每个内参基因分配适当的权重,并且计算它们权重的几何平均值,最终确定内参基因稳定性的大小。RefFinder分析结果表明(表3),6个备选内参基因稳定性通过geNorm和NormFinder软件单独分析的结果与RefFinder的基本一致,BestKeeper软件单独分析的结果与RefFinder稍有差异。但是通过RefFinder综合分析6个备选内参基因的稳定性,其结果为Actin>18S>Ubi>CyPA>Tubu>EF-1α。
另外,单独通过geNorm软件计算内参基因的配对差异(Vn/Vn+1)值可确定最适内参基因的数目。不同氨氮浓度暴露菲律宾蛤仔中配对变异值均>0.15(图3),无法通过配对变异值确定内参基因的数目。但是,根据geNorm提供的手册,系统默认的配对变异值0.15并非严格的标准。大量的研究表明,实验过程中存在配对变异值>0.15的情况。Zhang等[24]利用qRT-PCR筛选百合中用于基因表达研究的内参基因时,所有的实验条件下Vn/Vn+1>0.15,无法确定内参基因的数目,但是作者通过geNorm、NormFinder和BestKeeper的分析结果确定适合的内参基因;Li等[25]通过qRT-PCR鉴定合适的内参基因用于人类卵巢肿瘤的基因表达研究,备选内参基因的配对变异值都>0.15,但是根据配对变异值的趋势,作者推荐GUSB、PPIA和TBP为人类卵巢肿瘤的基因表达研究的内参基因。Penning等[26]研究内参基因在猫的牙(牙根、牙冠)、心(左心室)、肾、肝、肺和乳腺组织里表达的稳定性时,在所有组织中备选的10个内参基因的配对差异分析值均>0.15,需要同时选用6个才能对检测的所有组织基因表达进行最佳标准化。潘畅等[27]确定RPS23可以作为孟氏隐唇虫不同发育阶段和不同组织的基因表达分析的内参基因,而该研究的Vn/Vn+1>0.15。鲍相渤等[10]用定量PCR研究内参基因在虾夷扇贝中表达稳定性时,发现饥饿的条件下,血淋巴、肾和闭壳肌中出现了Vn/Vn+1>0.15的情况,这可能时由于饥饿对内参基因的表达产生了影响;此外,该研究在预试验中还发现,正常喂食的条件下候选内参基因在各种组织间的Vn/Vn+1值也>0.15,作者指出这可能是由于组织的细胞组成类型和比例不同及试验中的候选基因有限所致。国外的研究者也指出,在某些情况下默认值0.15可能过于严格,它受实验条件、个体间的差异以及基因数量等因素的影响[28-29],因此不必拘泥于Vn/Vn+1值是否<0.15。综合3个评估方法的分析结果和RefFinder的综合分析结果,我们认为在当前氨氮浓度(0.1 mg·L-1和0.5 mg·L-1)暴露条件下,Actin是研究菲律宾蛤仔肝胰腺组织内基因表达的最适内参基因。

