“无稻草,不翻仓,控温控湿”曲房创新对高温大曲微生物组成的影响研究
山其木格,唐 平,王 丽,王 凡,毕荣宇,李长文,卢 君
(1.贵州国台酒业集团股份有限公司,贵州仁怀 564501;2.天士力控股集团有限公司研究院,天津 300410)
酱香型白酒使用贵州红缨子糯高粱作为酿酒原料,采用“四高两长”即高温制曲、高温堆积、高温发酵、高温馏酒和生产周期长、贮存时间长的独特酿造工艺,使得众多微生物共同参与白酒发酵,使其具有“酱香突出,幽雅细腻,酒体醇厚,回味悠久,空杯留香持久”的风格特点,深受广大消费者的青睐。酱香型高温大曲作为糖化、发酵及生香剂,在酱香型白酒生产过程中扮演着极其重要的作用。高温大曲是以小麦、水为原料,稻草为辅料,依靠曲母及环境带入的各种微生物,经过自然培菌、高温发酵、储存而成[1-2]。在传统的酱香型大曲的生产过程中会按比例筛选新稻草和老稻草,作为生产用稻草,用于大曲发酵。新草略硬,骨力和吸水性较好;老草略软,骨力略差,但接种了制曲过程的丰富的微生物、酶和香味物质。稻草在酱香型大曲的发酵过程中,起到隔离曲块防止粘连、保温、保湿、透气的作用[3-5]。制曲使用过的老稻草因附着了酿酒微生物,还可作为下一轮制曲的辅料重复使用,起到接菌的作用[6-8]。周天慈等[9]基于高通量测序技术分析中高温大曲及其制作环境微生物群落结构,利用微生物溯源追踪技术对大曲中的微生物来源进行分析。研究结果表明,大曲发酵初期细菌89.3%来自于原料,5.6%来自于室内草席。
随着工业技术的进步,国内一些大型酒厂也基本实现了白酒生产机械化。但是酱香型白酒高温制曲的某些生产关键环节仍不能被机械化操作所代替,表现尤为明显的就是高温大曲的仓内发酵环节(包括翻仓工序),可以说曲仓发酵过程是酱香型白酒机械化酿造模式转型升级的难点,也是机械化变革进程中尚未被打通的“最后一公里”。酱香型白酒传统的曲房发酵环节,存在生产效率低、劳动强度大、占用面积大、大曲质量差异大、工作环境粉尘大、对制曲工人身体健康不利等缺点[10-12]。因此,贵州国台酒庄有限公司尝试利用现代工程装备技术对传统的制曲发酵环节进行改造,即在具有控温、控湿、供氧、对流等功能的曲房中采用无稻草、不翻仓、静止培养、均衡发酵的方式完成大曲的发酵过程,从而在保证曲块质量的前提下实现酱香型高温大曲生产自动化。本试验采用高通量测序技术,对传统曲房大曲(CT)、控温控湿曲房大曲(ZN)及生产用稻草(DC)的微生物群落组成进行研究,探明稻草微生物多样性及两种不同方式发酵的大曲在微生物组成上的差异。
1 材料与方法
1.1 材料、试剂及仪器
曲样的选取:传统曲房大曲(CT)、控温控湿曲房大曲(ZN)以及生产用稻草(DC)均取自贵州国台酒庄有限公司制曲车间。传统曲房大曲(CT)和控温控湿曲房大曲(ZN)为两种不同方式发酵而成的出仓曲。传统曲房大曲(CT)是通过酱香型高温大曲传统工艺发酵而成,优质小麦经润麦、粉碎、拌曲、踩曲成型、入仓堆积、一次翻仓、二次翻仓等工序完成大曲发酵,仓内摆放时为了防止曲块粘连,并且为了达到保温、保湿、透气的作用,会用到生产用稻草。而控温控湿曲房大曲(ZN)是根据传统曲房温湿度的变化规律,人为地调整曲仓的温湿度,大曲自始至终摆放在曲架上静止培养,培养过程中没有一次翻仓和二次翻仓等繁琐工序,也没有稻草用于制曲生产。两种大曲发酵方式不同,但二者都接入了相同的母曲,应用相同的小麦原料,且拥有相同的制曲环境。大曲的取样采用5 点取样法,即选取曲块中心点以及对角线与中心点距离相等的4个点作为取样点,选取的样品进行粉碎混合。生产用稻草为老稻草与新稻草以9∶1 比例混合样品,与实际生产要求一致。所有样品用无菌袋密封分装,冷冻保存于冰箱-20 ℃。3 种样品各5 个,每个样各两个平行。
仪器和试剂:荧光分光光度计Quantifluor-ST fluorometer E6090 购自Promega 公司;PCR 扩增仪bio-rad t100;Flx800 酶标仪购自BioTek公司;DNeasy PowerSoilKit 试剂盒购自Mo Bio/QIAGEN公司;Quant-iT PicoGreen dsDNA Assay Kit 试剂盒购 自P7589Invitrogen;Pyrobest DNA Polymerase DR500A 购自TaKaRa 公司;AxyPrep DNA Gel Extraction Kit(AP-GX-500)购自Axygen公司。
1.2 实验方法
1.2.1 微生物组总DNA的提取
生产用稻草置于无菌三角瓶中,用无菌PBS 缓冲液没过样本。以200 r/min 转速振荡40 min,将振荡后的PBS 溶液经两层无菌纱布过滤,去除杂质。过滤后的缓冲液以0.22 μm 的硝酸纤维素滤膜进行过滤,过滤后的滤膜放置在无菌一次性平皿中,封口膜封口,保存于-20 ℃。大曲和稻草微生物样本采用DNeasy PowerSoilKit 进行微生物组总DNA的抽提,并对抽提的DNA 进行检测。采用荧光分光光度计在260 nm 和280 nm 处分别测定DNA 的吸光值,检测DNA 的浓度,并用1%的琼脂糖凝胶电泳检测DNA 的质量。调整DNA 溶液浓度,DNA工作液保存于4 ℃,储存液保存于-20 ℃。
1.2.2 PCR 扩增
以样本微生物组总DNA 为模板,扩增出细菌16S rDNA V3—V4 可变区和真菌ITS1(a)区,供样本微生物群落分析。应用扩增引物338F(5′-ACTCCTACGGGAGGCAGCA-3′ )和806R(5′-GGACTACHVGGGTWTCTAAT-3′),扩增得到细菌16S rDNA V3—V4 可变区片段,产物约480 bp。同样以样本微生物组总DNA 为模板,应用扩增引物ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′),扩 增得到真菌ITS1(a)区,产物约250 bp。PCR 反应条件为:98 ℃,4 min;98 ℃变性30 s;55 ℃退火40 s;72 ℃延伸60 s;27个循环;72 ℃,7 min。
1.2.3 高通量测序与数据分析
针对细菌16S rDNA V3—V4 可变区和真菌ITS1(a)区扩增产物,进行割胶回收并纯化目标条带,利用BioTek 酶标仪对样品进行定量,最后采用标准的Illumina TruSeq DNA 文库制备实验流程(Illumina TruSeq DNA Sample Preparation Guide)构建所需的上机文库。测序与建库由上海派森诺生物科技股份有限公司完成。测序平台为IlluminaNova,测序策略PE-250。DADA2 方法(Benjamin et al.,2016)主要进行去引物,质量过滤,去噪(denoise),拼接和去嵌合体等步骤。它不再以相似度聚类,只进行去重(dereplication)或者说相当于以100%相似度聚类。使用DADA2 质控后产生的每个去重的序列称为ASVs(amplicon sequence variants),或称为特征序列(对应于OTU 代表序列),将ASV 代表序列与Silva(Release 132,http://www.arbsilva.de)和UNITE 数据库(Release 8.0,https://unite.ut.ee/)(Koljalg et al.,2013)比对,进行分类学注释。根据各样品物种丰富度情况,利用得出的ASV结果计算样品中生物多样性指数、丰富度指数和覆盖率指数(Coverage)等。
2 结果与分析
2.1 微生物群落Alpha多样性分析
应用高通量测序技术分析传统曲房大曲(CT)、控温控湿曲房大曲(ZN)和生产用稻草(DC)的微生物组成,共测得细菌16S V3—V4 区高质量READ 共计2871161 个,真菌ITS1 区高质量READ共计3244170 个。对于细菌,每个样品平均95705个READ(69965~109809 个READ,N=10)。对于真菌,每个样品平均108139 个READ(93147~120924 个READ,N=10)。细菌和真菌稀疏曲线均趋于平稳,说明测序深度符合要求,样品具有足够代表性,见图1。
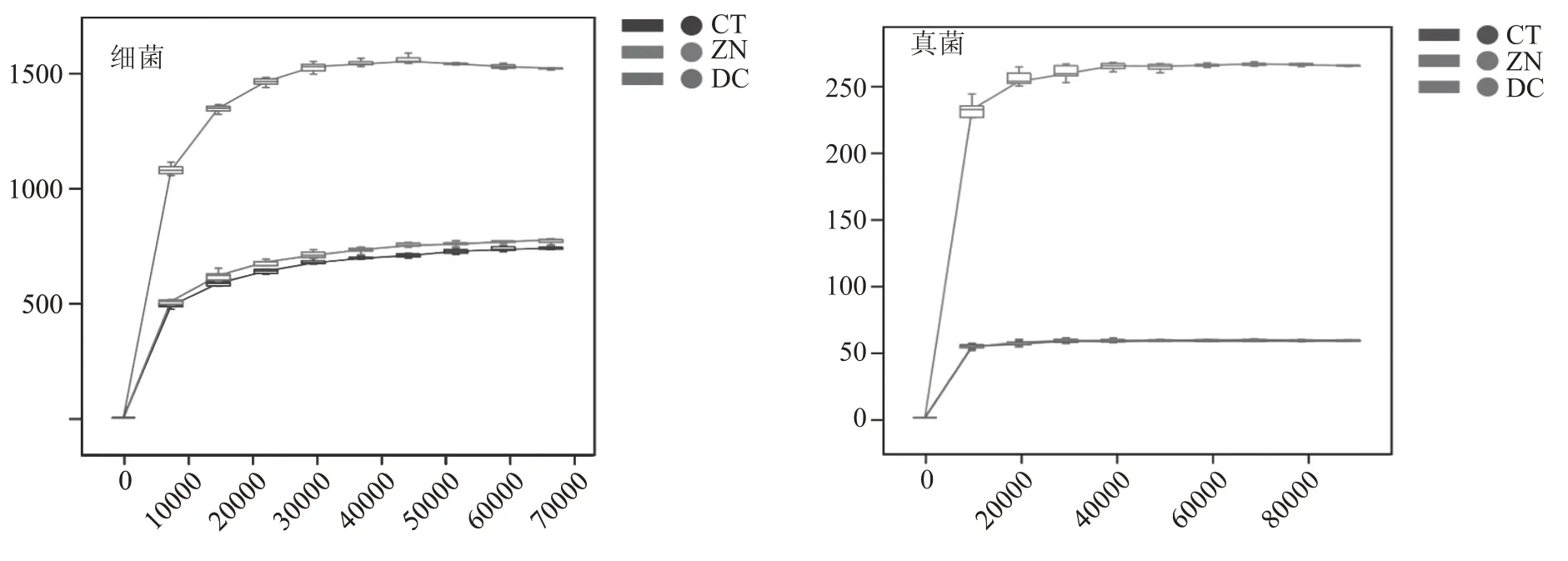
图1 细菌及真菌稀疏曲线
每个OTU 的代表序列根据OTU 在不同样本中的丰度分布,评估每个样本的多样性水平。对各组样本在属水平的具体组成进行分析,并检验组间是否具有统计学差异。通过统计学分析,发现稻草的细菌多样性最高,稻草细菌多样性极显著高于传统曲房大曲(P=0.00051,P<0.005)和控温控湿曲房大曲(P=0.00088,P<0.005)。控温控湿曲房大曲细菌多样性略高于传统曲房大曲,但并无显著性差异(P=0.26,P>0.05)。真菌多样性情况也类似,稻草的真菌多样性极显著高于传统曲房大曲(P=0.00016,P<0.005)和控温控湿曲房大曲(P=0.00016,P<0.005)。控温控湿曲房大曲真菌多样性略高于传统曲房大曲,但也无显著性差异(P=0.17,P>0.05),见表1和图2。

表1 微生物群落Alpha多样性

图2 细菌、真菌的alpha多样性
2.2 细菌组成分析
在细菌属水平分析传统曲房大曲(CT)、控温控湿曲房大曲(ZN)和稻草(DC)微生物多样性,共测得683 个属的细菌,其中稻草524 个属,传统曲房大曲102 个属,控温控湿曲房大曲458 个属。传统曲房发酵过程中大曲都是层层垒起堆放,比较密实,空气流动性较差,会造成发酵顶温较高且顶温维持时间较长,因而,高温且密闭环境的筛选作用使得一些不耐高温微生物不易存活,逐渐被淘汰。这可能是导致传统曲房大曲微生物多样性较为单一的原因。三组样本中,稻草微生物种类最为丰富,它包含Bacillus(20.68%),Pantoea(11.78%),Saccharopolyspora(10.21% ),Methylobacterium(8.47%),Staphylococcus(7.70%),Curtobacterium(5.11%),Acinetobacter(4.84%),Sphingomonas(4.33%),Pseudonocardiaceae(2.69%),Pseudomonas(2.07%),Planomicrobium(1.91%),Exiguobacterium(1.08%),Sphingobacterium(0.94%),Kineococcus(0.82%),Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium(0.79% ),Quadrisphaera(0.60%),Aureimonas(0.55%),Lysinibacillus(0.46%),Prauserella(0.45%)以及Oceanobacillus(0.45%)等属的细菌,且与传统曲房大曲共有Bacillus,Oceanobacillus,Staphylococcus,Saccharopolyspora,Pseudonocardiaceae,Pantoea等多种优势细菌属,见图3。这点也证明了文献[7]中报道,稻草在大曲发酵过程中起到接菌的作用。但图3 中也可以看到,控温控湿曲房大曲与稻草共有的微生物多于传统曲房大曲与稻草共有微生物。因此,可以推断稻草虽然具有接菌的作用,但在大曲发酵中并不是主要的微生物来源。

图3 细菌属水平VEEN图
对每组样品细菌组成相对丰度进行组内均值处理,发现传统曲房大曲(CT)与控温控湿曲房大曲(ZN)的优势微生物非常相似,均为Virgibacillus,Kroppenstedtia,Scopulibacillus3 个属的细菌,在细菌组成比例分别占88.04%和87.28%。只是在该两种大曲中优势细菌属的占比有所差异。传统曲房大曲中最多是Virgibacillus(66.13%),其次是Kroppenstedtia(20.42%),再次是Scopulibacillus(1.50%)。而在控温控湿曲房大曲中最多是Kroppenstedtia(46.52%),其次是Scopulibacillus(20.75%),再次是Virgibacillus(20.02%),见图4。除此之外,在丰度最高的20个菌属中,两种大曲也共同拥有Bacillus,Oceanobacillus,Staphylococcus,Thermoactinomyces,Lactobacillus,Saccharopolyspora,Lactococcus,Pseudonocardiaceae,Klebsiella,Chloroplast等多个菌属,见图4。

图4 细菌属水平丰度图
传统曲房大曲(CT)和控温控湿曲房大曲(ZN)中占比87%~88%的优势细菌组成一致,且在丰度最高的20 个菌属中,两种大曲也共同拥有Bacillus、Oceanobacillus、Staphylococcus、Thermoactinomyces、Lactobacillus等10 多个菌属。但是通过PCA 分析,发现该两种大曲样本相互仍可以区分,见图5,而且其细菌组成丰度Pearson 相关系数仅为0.5725。分析原因可能是:虽然两种方式发酵的大曲在优势细菌组成上非常相似,但优势微生物相对占比明显不同所造成。细菌属水平相对丰度热图中展示了前50 个属的相对丰度,比例尺显示细菌群落归一化丰度(%)的变化范围,见图6。

图5 细菌属水平PCA分析图

图6 细菌属水平相对丰度热图
2.3 真菌组成分析
在真菌属水平分析传统曲房大曲(CT)、控温控湿曲房大曲(ZN)和稻草(DC),共测得221 个属的真菌,其中稻草215 个属,传统曲房大曲28 个属,控温控湿曲房大曲40 个属。3 组样本真菌多样性情况与细菌多样性类似,可能也是传统曲房和控温控湿曲房发酵方式的不同,造成传统曲房大曲真菌多样性稍低于控温控湿曲房大曲。从图7 中可以看出,稻草真菌种类也最为丰富,含有Aspergillus(11.55%),Mycosphaerella(9.75%),Saitozyma(8.17% ),Wallemia(4.66% ),Papiliotrema(4.25%),Byssochlamys(2.65%),Moesziomyces(2.64% ),Hannaella(2.39% ),Thermoascus(1.49%),Alternaria(1.11%),Pyrenochaetopsis(0.76% ),Arthrinium(0.42% ),Neoascochyta(0.27% ),Lichtheimia(0.21% ),Trichoderma(0.14%)和Septoria(0.13%)等属的真菌。且与传统曲房大曲共有Aspergillus,Thermoascus,Byssochlamys和Rhizomucor等多种优势真菌属,见图7。
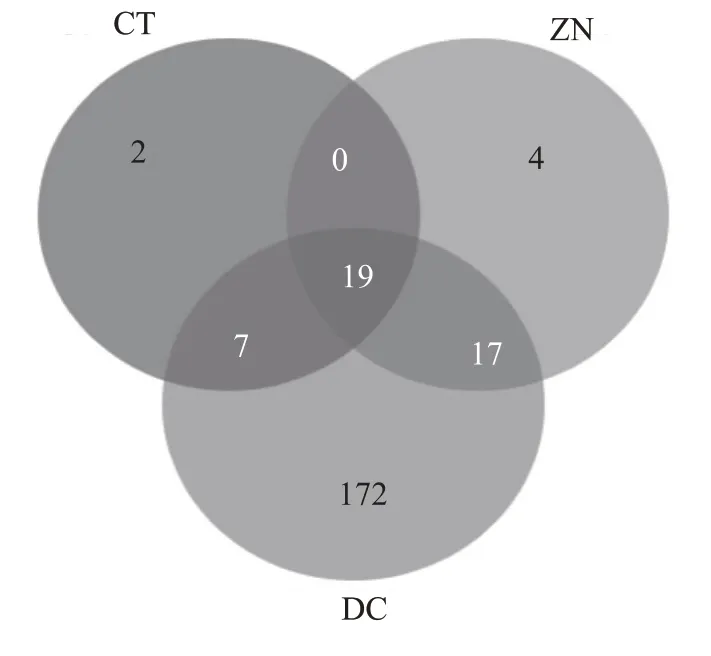
图7 真属水平VEEN图
对每组样品真菌组成相对丰度进行组内均值处理,发现传统曲房大曲(CT)与控温控湿曲房大曲(ZN)的优势真菌属也很相似,主要为Thermoascus、Thermomyces和Rasamsonia3个属的真菌,在真菌组成比例分别达到98.56%和98.57%。传统曲房大曲(CT)中,最多的是Thermoascus(74.70%),其次是Thermomyces(23.84%),再次是Rasamsonia(0.02%)。在控温控湿曲房大曲(ZN)中,最多的也是Thermoascus(94.67%),但其次是Rasamsonia(3.87%),再次是Thermomyces(0.03%)(见图8)。除此之外,在丰度最高的20 个菌属中,两种大曲也共同拥有Rhizopus,Aspergillus,Pichia,Byssochlamys,Phialemoniopsis,Lichtheimia,Cladosporium,Xeromyces等多个菌属,见图8。

图8 真菌属水平丰度图
传统曲房大曲(CT)和控温控湿曲房大曲(ZN)中占比98%以上的优势真菌组成一致,且在丰度最高的20 个菌属中,两种大曲也共同拥有Rhizopus,Aspergillus,Pichia,Byssochlamys,Phialemoniopsis等十多个菌属。但是通过PCA 分析,发现该两种大曲样本也基本可以区分,见图9。可见两种方式发酵的大曲虽然在优势真菌属组成上相似,但优势真菌和其他一些真菌的相对占比上也存在一些差异,见图10。真菌属水平相对丰度热图中展示了前50 个属的相对丰度,比例尺显示细菌群落归一化丰度(%)的变化范围。但与细菌组成相比,该两种大曲在真菌组成及丰度上比较接近,其Pearson相关系数也达到了0.9505。

图9 真菌属水平PCA分析图

图10 真菌属水平相对丰度热图
3 结论
本研究中,通过高通量测序技术及统计学分析,发现稻草的微生物多样性最为丰富,并且与传统曲房大曲共有Bacillus,Oceanobacillus,Staphylococcus,Saccharopolyspora,Pseudonocardiaceae,Pantoea等多种优势细菌属和Aspergillus,Thermoascus,Byssochlamys和Rhizomucor等多种优势真菌属的微生物,也证实了稻草在酱香型大曲发酵过程中的接菌作用。但与此同时我们也发现,无论是细菌或真菌组成上,控温控湿曲房和传统曲房发酵的出仓曲共同拥有多种优势菌属,且发酵中未用稻草的控温控湿曲房大曲反而微生物多样性更为丰富。所以,我们推断稻草虽然起到微生物接种的作用,但不是主要的微生物来源。大曲发酵中微生物主要来源应该是母曲、原料、制曲条件及环境等其他因素,这一点与周天慈等[9]的研究结论相符。
从传统曲房和控温控湿曲房发酵的酱香型高温大曲微生物区系的初步研究中发现,该两种大曲虽然工艺不同,但因接入了相同的母曲,应用相同的小麦原料,且拥有相同的制曲温湿度条件,所以共同拥有着多种优势微生物,微生物多样性并无显著性差异。左乾程等[13]利用高通量测序技术对酱香型白酒机械化制曲发酵过程中细菌群落结构进行分析,发现机械化制曲与传统制曲过程优势菌具有较高的相似性,与本文研究结论相似。但是,本研究仅对传统曲房和控温控湿曲房所生产的出仓曲进行了初步的微生物区系研究,后期还需进一步进行大曲储存过程以及后期酿酒应用方面的效果验证。本试验对比了酱香型白酒高温大曲在发酵过程中“是否使用稻草、是否翻仓”对于出仓曲微生物菌群的影响,对于未来高温大曲仓内发酵过程的机械化升级,提供了重要的基础研究数据。

