黄瓜耐盐根际促生菌的筛选及评价
薛璐 杨倩 郭慧 李英楠 张涛 申顺善 朴凤植 杜南山
摘 要:为获得具有较高耐盐能力的根际促生菌并探究其对黄瓜幼苗耐盐性的影响,对5株菌株的生化特性进行测定,并通过耐盐盆栽试验初步筛选出HG15-7、NSY1、NSY50等3株耐盐促生菌株,进一步通过盆栽试验比较了3株耐盐促生菌株对黄瓜幼苗生长、光合作用及抗氧化代谢的影响。结果表明,耐盐促生菌株均具有较高的ACC脱氨酶活性和IAA合成能力,接种耐盐促生菌株均可不同程度提高盐胁迫下黄瓜幼苗的株高、茎粗、叶片数、叶绿素含量和净光合速率,其中耐盐促生菌株NSY50处理效果最佳,150 mmol·L-1 NaCl处理下分别较对照提高49.63%、8.27%、25.00%、17.19%和9.29%,相对电导率及丙二醛含量分别较对照降低21.81%和22.22%,减轻盐胁迫对黄瓜幼苗的氧化伤害,进而增强黄瓜幼苗耐盐性。NSY50具有进一步研究开发利用的潜力。
关键词:黄瓜;盐胁迫;植物根际促生菌;氧化伤害
中图分类号:S642.2 文献标志码:A 文章编号:1673-2871(2021)09-026-07
Screening and evaluation of the salt-tolerant plant growth-promoting rhizobacteria on cucumber
XUE Lu1, YANG Qian1, GUO Hui1, LI Yingnan1, ZHANG Tao1, SHEN Shunshan2, PIAO Fengzhi1, DU Nanshan1
(1. College of Horticulture, Henan Agricultural University, Zhengzhou 450002, Henan, China; 2. College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, Henan, China)
Abstract: In order to obtain plant growth-promoting rhizobacteria with high salt-tolerant ability, we determined the biochemical characteristics of five strains and conducted pot experiment to explore their influence on the salt-tolerance of cucumber seedlings. HG15-7, NSY1, and NSY50, were screened as salt-tolerant plant growth-promoting bacteria. The effects of three salt-tolerant plant growth-promoting strains on growth, photosynthesis and antioxidant metabolism of cucumber seedlings were compared by pot experiment. The results showed that the salt-tolerant plant growth-promoting strains had high ACC deaminase activity and IAA synthesis ability. The inoculation of salt-tolerant plant growth-promoting strains could improve the growth and reduce the oxidative damage of salt stressed-cucumber seedlings. Among the 3 salt-tolerant plant growth-promoting strains, NSY50 has the best effect. Compared with the control, inoculation of NSY50 increased the plant height, stem diameter, leaf number, chlorophyll content and net photosynthetic rate by 24.60%, 8.27%, 25.00%, 17.19% and 9.29%, respectively and reduced the relative conductivity and malondialdehyde content by 21.81% and 22.22% under 150 mmol·L-1 NaCl treatment. NSY50 has the potential for further research and development.
Key words: Cucumber; Salt stress; Plant growth-promoting rhizobacteria bacteria; Oxidative damage
黃瓜(Cucumis sativus L.)是设施栽培的主要蔬菜作物之一,2019年我国黄瓜栽培面积达125.8万hm2,总产量超过7000万t(FAO),在我国“菜篮子”工程建设中占有重要地位。但由于黄瓜根系脆弱、好气、分布较浅,对盐渍环境的适应性较差,其产量和品质深受设施土壤盐渍化的影响[1]。盐胁迫一方面会影响植物的光合作用,另一方面也会对植物造成渗透胁迫和离子毒害[2],严重影响植物的生长和代谢,减少水分吸收,抑制关键代谢过程[3]。因此,提高植物的耐盐性对农业的可持续发展具有重要的现实意义,也是目前农业发展中亟待解决的问题。
植物根际促生菌(Plant growth-promoting rhizobacteria bacteria,PGPR)是指生活在根际土壤或依附于植物根系,直接或者间接参与植物生长,提高作物品质或抵抗逆境胁迫的一类有益微生物。许多植物根际促生菌通过产生植物激素(植物生长素、细胞分裂素、赤霉素和多胺),1-氨基环丙烷-1-羧酸(ACC)脱氨酶和固定氮,调节光合作用效率、离子稳态、渗透调节物质和次生代谢产物的积累,以及植物激素信号通路的基因表达[4],进而直接或间接促进植物生长。此外,有研究表明,植物根际促生菌能与植物建立共生关系,在植物受到盐胁迫、干旱等非生物胁迫时,通过诱导植物建立抵抗或忍耐机制[5],提高植物的抗逆能力,促进其生长。因此,合理使用PGPR是减轻盐胁迫危害的一种重要途径。
笔者在本研究中对5株植物根际促生菌多粘类芽孢杆菌(Paenibacillus polymyxa)HG15-7、绿针假单胞菌(Pseudomonas chlororaphis)HG28-5、多粘类芽孢杆菌(Paenibacillus polymyxa)NSY50[6]、地衣芽孢杆菌(Bacillus licheniformis)NSY15和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)NSY1[7] 进行生化特性分析和耐盐筛选,并对筛选出的3株优势耐盐促生菌株进行盆栽试验,研究盐胁迫下黄瓜幼苗生长、光合作用及抗氧化代谢,以期筛选出可提高黄瓜耐盐性的最佳耐盐促生菌株,为耐盐促生菌的开发和黄瓜耐盐栽培提供参考依据。
1 材料与方法
菌株生化特性測定试验于2018年9—12月进行,耐盐促生菌及盐浓度的筛选试验于2019年3—6月进行,耐盐促生菌盆栽试验于2019年9月至2020年1月进行,试验均在河南农业大学园艺学院设施结构优化与环境调控实验室人工气候室内进行。
1.1 材料
供试黄瓜品种为津春二号,由天津科润农业科技股份有限公司黄瓜研究所提供。多粘类芽孢杆菌(Paenibacillus polymyxa)HG15-7、绿针假单胞菌(Pseudomonas chlomraphis)HG28-5由河南农业大学植物保护学院植物病害生物防治研究室提供;解淀粉芽孢杆菌(Bacillus amyloliquefaciens)NSY1、地衣芽孢杆菌(Bacillus licheniformis)NSY15和多粘类芽孢杆菌(Paenibacillus polymyxa)NSY50由河南农业大学园艺学院杜南山提供。均以利福平标记后用甘油管冷藏法将菌株保存于-80 ℃超低温冰箱中备用。TSB培养基:胰酪大豆胨液体培养基30 g,蒸馏水1000 mL;TSA培养基:TSB 30 g,琼脂18 g,蒸馏水1000 mL;DF培养基:KH2PO4 4.0 g,Na2HPO4 6.0 g,MgSO4·7H2O 0.2 g,葡萄糖2.0 g,葡萄糖酸 2.0 g,柠檬酸2.0 g,去离子水1000 mL,pH 7.2;DF盐培养基:(NH4)2SO4 2.0 g,DF培养基1000 mL;ADF培养基:ACC 303.0 mg(将ACC溶于无菌水后,过滤除菌),DF培养基1000 mL。以上培养基在121 ℃温度下灭菌15 min后备用。
1.2 方法
1.2.1 菌株生化特性测定 参照伯杰氏细菌鉴定手册(第9版)[8],按照常规细菌学方法进行菌株生化特性检测,分别检测了纤维素酶、蛋白酶和淀粉酶特性。IAA合成能力采用Salkowski显色法,将培养的促生菌接种于含有L-色氨酸的LB液体培养基中,摇床培养48 h,加入Salkowski显色液在540 nm下测定吸光度[9]。1-氨基环丙烷-1-羧酸(ACC)脱氨酶活性参照田磊等[10]的方法进行定性鉴定。
1.2.2 菌株菌悬液制备和耐盐盆栽试验筛选 菌株在TSB培养基中28 ℃、150 r·min-1培养2 d后,在8000 r·min-1离心10 min,弃去上清液,无菌水调整菌液浓度到108 cfu·mL-1备用。
盆栽试验——试验一:将黄瓜幼苗培育至1叶1心时,选取整齐一致的健壮幼苗移栽至7.5 cm×7.5 cm×8.0 cm的营养钵中,在温度25~28 ℃、光照周期12 h/12 h、环境相对湿度60%~70%的条件下培养,待黄瓜幼苗长至2叶1心时,进行灌菌处理,向幼苗根部土壤中分别加入50 mL HG15-7、HG28-5、NSY1、NSY15和NSY50菌悬液(108 cfu·mL-1);灌菌处理3 d后,再分别加入4种不同浓度盐溶液(50、100、150、200 mmol·L-1 NaCl)50 mL,隔3 d再加1次相应浓度的盐溶液,以不接菌的相应浓度盐处理为对照。每个处理10株幼苗,3次重复,随机区组设计。盐处理14 d后对黄瓜进行盐害指数调查,以确定适宜盐浓度和筛选耐盐促生菌株。盐害分级标准:0级,无盐害特征;1级,真叶完好,叶缘黄化;2级,25%真叶萎蔫黄化;3级,50%真叶萎蔫黄化;4级,75%真叶萎蔫黄化;5级,所有叶片失水萎蔫。盐害指数/%=∑(代表级数×株数)/(最高级数×总株数)×100。
试验二:对试验一确定的适宜盐浓度和提高黄瓜耐盐性较好的耐盐促生菌株进行同上处理。盐处理14 d后测株高、茎粗和叶片数,并测定光合作用强度、叶绿素荧光参数以及抗氧化代谢等生理指标。
1.2.3 黄瓜幼苗相关生理指标的测定 采用硫代巴比妥酸比色法测定丙二醛(MDA)含量[11];采用浸泡法测定相对电导率[12];采用无水乙醇与丙酮1∶1混合液浸泡比色法测定叶绿素含量[13];采用光合测定仪(北京力高泰科技有限公司生产,型号LI-6400XT)测定光合指标;采用叶绿素荧光仪以及Fluor Cam封闭式叶绿素荧光成像系统测定叶绿素荧光参数;采用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性,采用愈创木酚法测定过氧化物酶(POD)活性,采用过氧化氢法测定过氧化氢酶(CAT)活性[14]。
1.3 统计分析
采用WPS office 2019和DPS 6.5软件进行数据分析,以最小显著差数法(LSD)进行差异性分析。
2 结果与分析
2.1 5株菌株生化特性
由表1可以看出,HG15-7、NSY1、NSY15和NSY50菌株均具有ACC脱氨酶活性、纤维素酶活性、蛋白酶活性和淀粉酶活性,具有相对较强的IAA合成能力,其中,NSY50的IAA合成能力最强,显著高于其他菌株,而HG28-5菌株IAA合成能力最弱,显著低于其他菌株,且不具有淀粉酶活性。
2.2 5株菌株对不同盐浓度下黄瓜幼苗盐害指数的影响
如表2所示,随着盐浓度的升高,各处理组黄瓜幼苗盐害指数明显升高。在低盐浓度(50 mmol·L-1)处理下,黄瓜幼苗盐害指数相对较小。在100 mmol·L-1盐浓度处理下,HG15-7、HG28-5、NSY1、NSY15和NSY50菌株处理组的黄瓜幼苗盐害指数显著低于CK(不接菌);在150 mmol·L-1盐浓度处理下,HG15-7、NSY1和NSY50菌株处理组黄瓜幼苗的盐害指数较CK分别显著降低49.77%、55.40%、65.73%,而HG28-5、NSY15菌株处理组与CK无显著差异;在200 mmol·L-1盐浓度下,5株菌株处理组与CK相比均无显著差异。这些结果表明,HG15-7、NSY1和NSY50菌株在150 mmol·L-1盐浓度以下能够显著缓解盐胁迫对黄瓜幼苗的伤害,因此,选择HG15-7、NSY1和NSY50 这3株效果较好的菌株在150 mmol·L-1盐浓度下进行进一步的试验。
2.3 3株菌株对盐胁迫下黄瓜幼苗生长的影响
由图1可知,在150 mmol·L-1盐浓度下,与对照相比,HG15-7、NSY1和NSY50菌株处理能明显缓解盐胁迫对黄瓜幼苗的伤害。由表3可知,HG15-7、NSY1、NSY50处理组较对照株高分别显著增加31.13%、43.46%、49.63%;茎粗较对照分别增加5.82%、4.14%、8.27%,但差异均未达到显著水平;叶片数也较对照增加,但仅有NSY50菌株处理与对照的差异达到显著水平,较对照提高了25.00%。
2.4 3株菌株对盐胁迫下黄瓜幼苗叶片叶绿素含量及净光合速率的影响
由图2-A可知,在盐胁迫下,HG15-7、NSY1、NSY50处理黄瓜幼苗叶绿素含量较对照分别增加11.17%、13.28%和17.19%,差异达到显著水平。耐盐促生菌处理组净光合速率也较对照有不同程度提高(图2-B),其中NSY1和NSY50处理组黄瓜幼苗叶片净光合速率较对照分别增加8.74%和9.29%,差异达到显著水平。HG15-7处理组叶片净光合速率虽然高于对照,但差异不显著。
2.5 黄瓜幼苗叶片叶绿素荧光指标的变化
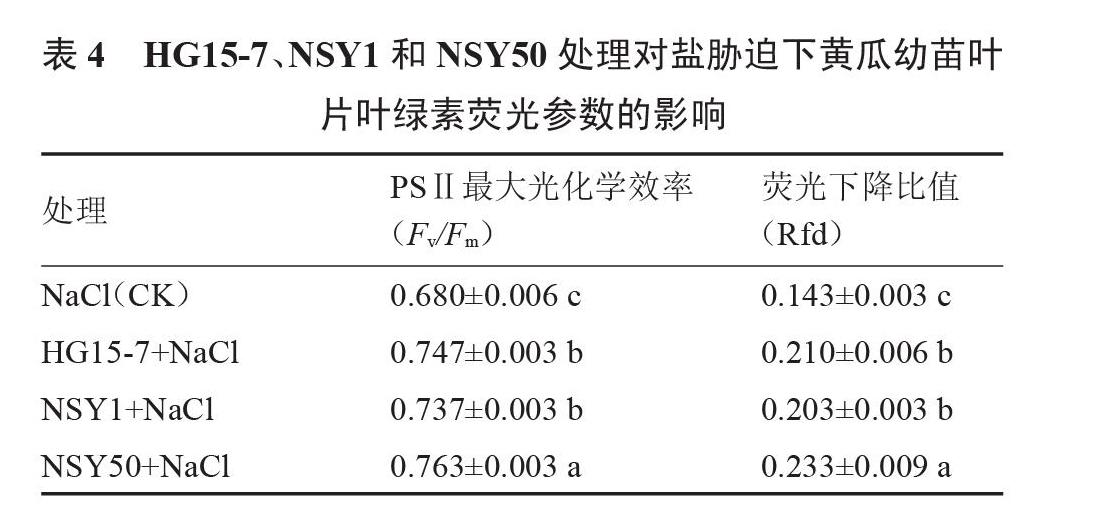
由图3、表4可以看出,在盐胁迫下,HG15-7、NSY1、NSY50处理组黄瓜幼苗叶片的PSⅡ(光系统Ⅱ)最大光化学效率(Fv/Fm)、荧光下降比值(Rfd)均显著高于不接菌对照。HG15-7、NSY1、NSY50处理组黄瓜幼苗叶片Fv/Fm较对照分别增加9.80%、8.33%和12.25%,Rfd较对照分别增加46.85%、42.19%和63.17%,差异达到显著水平,且NSY50处理组的叶绿素荧光指标均最高,显著缓解了盐胁迫对黄瓜幼苗PSⅡ的抑制作用,从而提高了盐胁迫下黄瓜幼苗叶片的光化学效率。
2.6 3株菌株对盐胁迫下黄瓜幼苗叶片相对电导率及丙二醛含量的影响
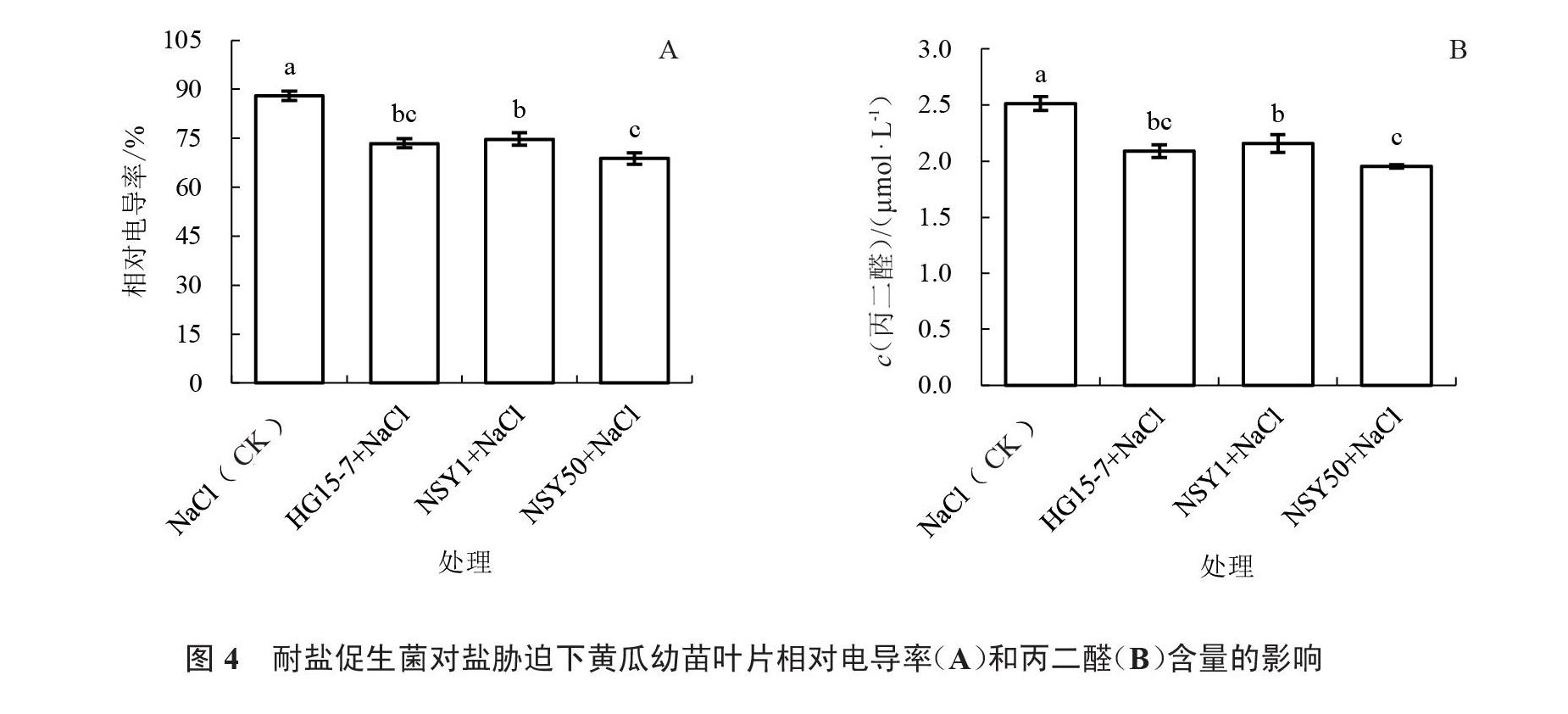
由图4可知,在盐胁迫下,HG15-7、NSY1、NSY50处理组与不接菌对照相比,黄瓜幼苗叶片相对电导率分别降低16.50%、15.11%和21.81%,差异达到显著水平(图4-A);丙二醛含量较对照分别降低16.78%、14.18%和22.22%,差异达到显著水平(图4-B)。这些结果表明,在盐胁迫条件下,HG15-7、NSY1、NSY50处理提高了植物对膜氧化损伤的耐受性,且NSY50处理的膜损伤程度最轻。
2.7 3株菌株对盐胁迫下黄瓜幼苗叶片抗氧化酶活性的影响
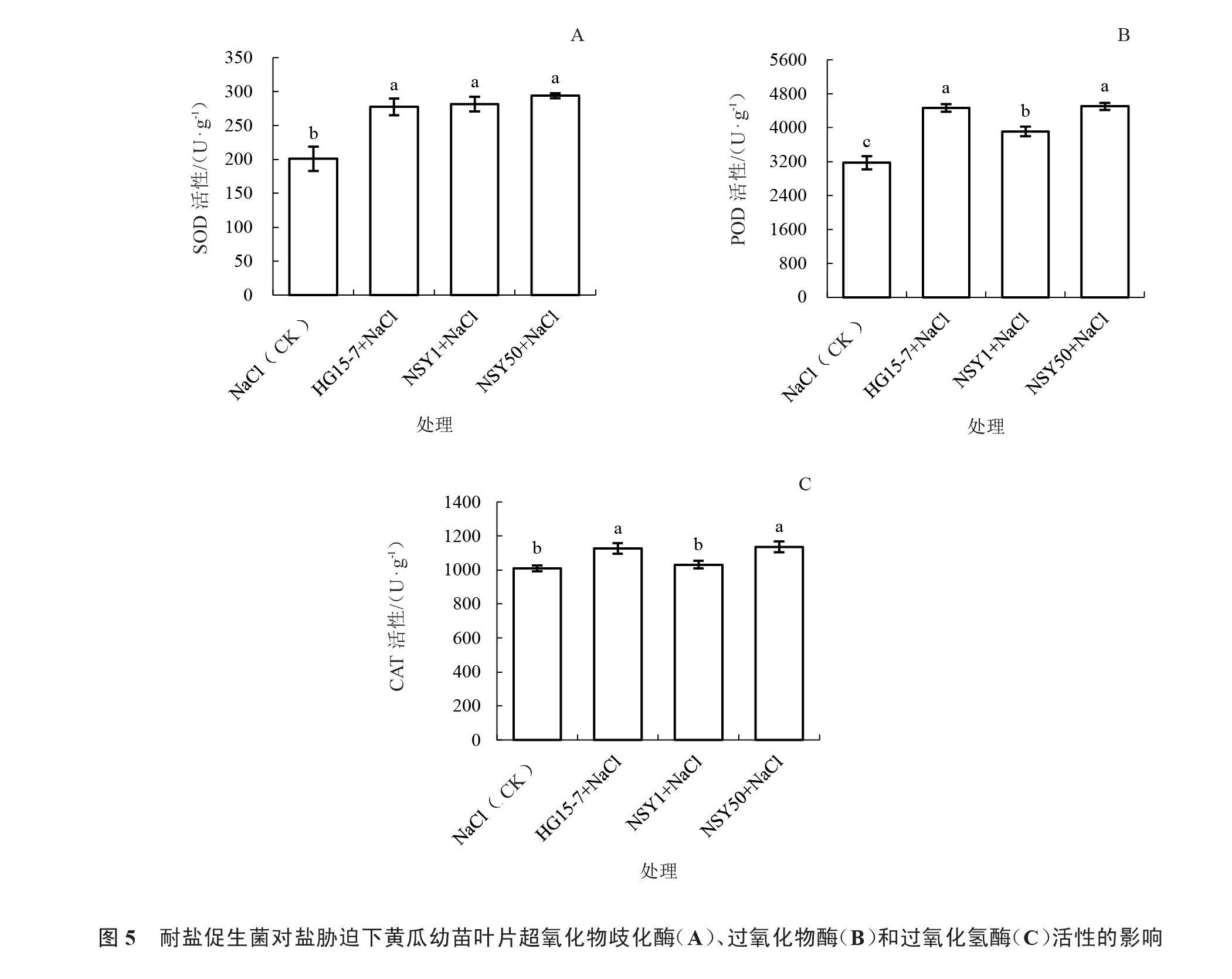
由图5可知,HG15-7、NSY1和NSY50菌株均能提高鹽胁迫下黄瓜幼苗叶片的抗氧化酶活性,其中NSY50处理的抗氧化酶活性最高,SOD、POD和CAT活性分别较不接菌对照增加46.24%、41.86%和12.61%,差异达到显著水平;HG15-7处理较对照分别提高38.04%、40.66%和11.63%,差异达到显著水平;而NSY1菌株处理的POD和CAT活性最低,且CAT活性与对照无显著差异。
3 讨论与结论
土壤盐渍化是严重影响作物生长发育的主要非生物胁迫因子之一。大量研究表明,植物根际促生菌可有效减轻植物的盐胁迫损伤。Rajnish等[15]研究发现,肠杆菌(Enterobacter sp.)SBP-6能够通过分泌ACC脱氨酶和溶磷作用来提高钾素吸收,减弱小麦在盐胁迫下对钠离子的吸收,缓解盐胁迫对小麦生长的抑制。钱兰华等[16]研究发现,巨大芽孢杆菌(Bacillus megaterium)B7菌株能促进盐胁迫下黄瓜种子发芽,并提高盐胁迫下黄瓜幼苗可溶性糖和脯氨酸含量,进而增强黄瓜幼苗耐盐能力。具有ACC脱氨酶活性的植物根际促生菌能有效降低植物逆境胁迫下乙烯水平,增强植物对逆境的耐受性,这越来越受到研究者的关注[17]。此外,一些根际促生菌还能够通过分泌植物生长激素(IAA)、固氮、溶磷、产嗜铁素等方式[18-19],提高宿主植物系统抗性。IAA作为植物中最重要的生长激素之一,主要功能为促进植物生长和根尖细胞分裂及分化,调节生根等[20]。多项研究表明,具有IAA合成能力的根际促生菌可显著增加植物的根长和根表面积,促进根的生长发育[21]。郑文波等[22]研究发现,具有较强分泌IAA能力的巨大芽孢杆菌(Bacillus megaterium)ZH5菌株能够显著增加花生植株的根长、根尖数、根表面积及根体积。聂鑫等[23]研究发现,特基拉芽孢杆菌(Bacillus tequilensis)U36对辣椒根长、根质量、茎长、茎质量和叶面积有明显促进作用。因此,笔者在本研究中以菌株的ACC脱氨酶活性、IAA合成能力以及菌株在盐胁迫下对黄瓜幼苗盐害指数的作用效果作为筛选标准,从5株促生菌菌株中初步筛出了HG15-7、NSY1和NSY50等3株耐盐促生菌。而从其IAA合成能力及对黄瓜幼苗盐害指数的影响结果中发现,NSY50的IAA合成能力最强,达到22.21 μg·mL-1,其处理后的黄瓜在不同盐浓度胁迫下的盐害指数也最低,因此,根际促生菌可能通过分泌IAA来促进植物根系的发育,从而增强植物对盐胁迫的耐受性。
光合作用是植物生长的生理基础,能够反映植物的生长势和逆境下的耐受能力[24]。在本研究中,接种NSY1和NSY50可有效缓解由盐胁迫造成的黄瓜幼苗叶片叶绿素含量的降低,间接提高叶片净光合速率和PSⅡ最大光化学效率。这与前人关于根际促生菌能够提高寄主植物逆境条件下叶绿素含量、增强叶片光合效率的研究结果一致[25-26]。多项研究表明,植物根际促生菌能够提高多种植物在不同环境胁迫下的叶绿素含量和光合效率。王琦琦等[26]研究发现,死谷芽孢杆菌(Bacillus vallismortis)GTZW50-5能够显著提高100、200 mmol·L-1 NaCl胁迫下小麦叶绿素含量25.1%、11.8%。徐雪东等[27]研究发现,与未接种促生菌处理相比,中度(田间持水量40%~50%)和重度(田间持水量25%~35%)干旱环境下接种荧光假单胞菌(Pseudomonas fluorescens)YX-2可显著提高苹果幼苗叶片的最大光化学效率,分别提高8.8%和16.7%;叶片净光合速率分别显著提高6.8%和6.7%。
一般而言,盐胁迫造成的植物光化学效率迅速下降与植物细胞膜脂过氧化密切相关,盐胁迫扰乱了细胞内活性氧的稳态平衡,引起DNA损伤、膜脂过氧化、代谢失衡,抑制植物的正常生长,严重时可造成叶片萎蔫甚至植株死亡[28-29]。在本研究中,接种HG15-7、NSY1、NSY50菌株可显著降低叶片的相对电导率,减轻盐胁迫对黄瓜叶片造成的膜损伤,叶片MDA含量显著低于盐处理对照。SOD、POD、CAT作为植物细胞中清除ROS最重要的抗氧化酶,在维持植物体内ROS代谢平衡中扮演着重要角色。在本研究中,接种促生菌HG15-7、NSY1和NSY50处理不同程度提高了盐胁迫下的黄瓜幼苗SOD、POD和CAT活性,表明这些耐盐促生菌处理能够加速提高植物盐胁迫下体内的活性氧清除效率,降低MDA含量,减轻膜结构受损程度,提高黄瓜幼苗耐盐能力,该结果与国内外报道的关于促生菌能够提高盐胁迫下植物抗氧化酶活性的研究相一致[30-32]。
笔者通过研究根际促生菌对不同盐浓度下黄瓜幼苗的耐盐效应,筛选出适宜NaCl浓度(150 mmol·L-1)下耐盐效果较好的3株(HG15-7、NSY1和NSY50)耐盐促生菌株,并经过进一步的盆栽试验,综合根际促生菌对幼苗生长、光合作用及抗氧化代谢的影响,筛选出黄瓜最佳耐盐菌株多粘类芽孢杆菌(Paenibacillus polymyxa)NSY50,为进一步开发利用生物菌肥、提高黄瓜耐盐性提供了较好的参考依据。但有关NSY50提高黄瓜耐盐性的作用机制以及对黄瓜成株期生长发育的影响,还有待进一步探究。
参考文献
[1] 王丹怡,韩玲娟,张毅,等.多胺对盐胁迫下黄瓜SOS2基因家族表达的影响[J].西北植物学报,2020,40(11):1855-1865.
[2] 周梦迪,胡志程,付秋实,等.NaCl胁迫对甜瓜生理指标及相关基因表达的影响[J].中国蔬菜,2020(2):30-39.
[3] YI C Y,YAO K Q,CAI S Y,et al.High atmospheric carbon dioxide-dependent alleviation of salt stress is linked to RESPIRATORY BURST OXIDASE 1 (RBOH1)-dependent H2O2 production in tomato (Solanum lycopersicum)[J].Journal of Experimental Botany,2015,66(22):7391-404.
[4] XIONG Y W,LI X W,WANG T T,et al.Root exudates-driven rhizosphere recruitment of the plant growth-promoting rhizobacterium Bacillus flexus KLBMP 4941 and its growth-promoting effect on the coastal halophyte Limonium sinense under salt stress[J].Ecotoxicology and Environmental Safety,2020,194:110374.
[5] 紀超,王晓辉,刘训理.盐胁迫环境下植物根际促生菌的作用机制研究进展[J].生物技术通报,2020,36(4):131-143.
[6] 李英楠,曹正,杜南山,等.三种PGPR菌株对黄瓜生长及根际土壤环境的影响[J].北方园艺,2019(24):21-27.
[7] DU N S,SHI L,YUAN Y H,et al.Isolation of a potential biocontrol agent Paenibacillus polymyxa NSY50 from vinegar waste compost and its induction of host defense responses against Fusarium wilt of cucumber[J].Microbiological Research,2017,202:1-10.
[8] BUCHANAN R E,GIBBONS N E. Bergeys manual of systematic bacteriology[M]. 9th ed.Baltimore:Williams & Wilkins Company,1994.
[9] 姜云,田磊,陈长卿,等.一株人参内生产吲哚乙酸细菌的筛选及鉴定[J].中国中药杂志,2015,40(2):213-217.
[10] 田磊,姜云,陈长卿,等.一株人参内生1-氨基环丙烷-1-羧酸(ACC)脱氨酶活性细菌的筛选、鉴定及其对宿主生长的影响[J].微生物学报,2014,54(7):760-769.
[11] 高安妮.连作条件下外源一氧化氮对平邑甜茶幼苗影响的研究[D].山东泰安:山东农业大学,2011.
[12] 李娟,陆晴,张爱敏,等.高温对唐山秋黄瓜相对电导率及脯氨酸含量的影响分析[J].新疆农垦科技,2018,41(12):16-18.
[13] 胡秉芬,黄华梨,季元祖,等.分光光度法测定叶绿素含量的提取液的适宜浓度[J].草业科学,2018,35(8):1965-1974.
[14] 刘筱,易守理,高素萍.铅胁迫对紫萼玉簪幼苗SOD、POD和CAT活性的影响[J].安徽农业科学,2011,39(14):8244-8246.
[15] SINGH R P,JHA P N.Mitigation of salt stress in wheat plant (Triticum aestivum) by ACC deaminase bacterium Enterobacter sp.SBP-6 isolated from Sorghum bicolor[J].Acta Physiologiae Plantarum,2016,38(5):110.
[16] 钱兰华,钱玮,沈雪林,等.耐盐促生菌的筛选、鉴定及其对黄瓜的促生作用[J].江苏农业科学,2019,47(18):160-163.
[17] 李华山,雷鹏,许宗奇,等.耐盐促生菌Agrobacterium sp.DF-2增强黄瓜幼苗耐盐性的研究[J].江苏农业学报,2017,33(3):654-661.
[18] 李海云,蒋永梅,姚拓,等.蔬菜作物根际促生菌分离筛选、鉴定及促生特性测定[J].植物保护学报,2018,45(4):836-845.
[19] ZERROUK I Z,RAHMOUNE B,KHELIFI L,et al.Algerian Sahara PGPR confers maize root tolerance to salt and aluminum toxicity via ACC deaminase and IAA[J].Acta Physiologiae Plantarum,2019,41(6):1-10.
[20] 徐婧,邵锴,李东芳,等.产IAA菌的筛选、鉴定及其培养基的优化[J].苏州科技大学学报(自然科学版),2018,35(2):45-54.
[21] 刘国强,旭格拉·哈布丁,艾山江,等.黑果枸杞根际促生菌的筛选鉴定及促生能力分析[J].厦门大学学报(自然科学版),2019,58(1):56-62.
[22] 郑文波,申飞,闫小梅,等.红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J].土壤,2015,47(2):361-368.
[23] 聶鑫,王伟.潜在促生菌Bacillus tequilensis U36的产IAA特性及其对辣椒的促生效果[J].广东农业科学,2017,44(1):36-42.
[24] DONG K,HAN H S,LEE K D,et al.Plant growth promoting rhizobacteria effect on antioxidant status,photosynthesis,mineral uptake and growth of lettuce under soil salinity[J].Research Journal of Agriculture and Biological Sciences,2005,1(3):210-215.
[25] SHARP R E,VALERIY P,HEjLEK L G,et al.Root growth maintenance during water deficits:physiology to functional genomics[J].Journal of Experimental Botany,2004,55(407):2343-2351.
[26] 王琦琦,冯丽,李杨,等.新疆木碱蓬(Suaeda dendroides)根际耐盐促生细菌的筛选及鉴定[J].微生物学通报,2019,46(10):2569-2578.
[27] 徐雪东,张超,秦成,等.干旱下接种根际促生细菌对苹果实生苗光合和生理生态特性的影响[J].应用生态学报,2019,30(10):3501-3508.
[28] 陈爱葵,韩瑞宏,李东洋,等.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,30(5):88-91.
[29] TANG Y Y,YUAN Y H,SHU S,et al.Regulatory mechanism of NaCl stress on photosynthesis and antioxidant capacity mediated by transglutaminase in cucumber (Cucumis sativus L.) seedlings[J].Scientia Horticulturae,2018,235:294-306.
[30] 韩坤,田曾元,刘珂,等.具有ACC脱氨酶活性的海滨锦葵(Kosteletzkya pentacarpos)内生细菌对小麦耐盐性的影响[J].植物生理学报,2015,51(2):212-220.
[31] 韩庆庆,贾婷婷,吕昕培,等.枯草芽孢杆菌GB03对紫花苜蓿耐盐性的影响[J].植物生理学报,2014,50(9):1423-1428.
[32] KHAN A L,WAQAS M,KHAN A R,et al.Fungal endophyte Penicillium janthinellum LK5 improves growth of ABA-deficient tomato under salinity[J].World Journal of Microbiology and Biotechnology,2013,29(11):2133-2144.

