不同干燥方法对半夏药材干燥特性、外观性状与内在成分的影响
罗寅珠,刘 勇,黄必胜,刘艳菊,刘 启,雷 咪,刘大会
湖北中医药大学药学院,湖北 武汉 430065
半夏为天南星科植物半夏Pinellia ternata(Thunb.) Breit.的干燥块茎,始载于《神农本草经》[1],具有燥湿化痰、降逆止呕、消痞散结的功效,是小青龙汤、小柴胡汤及射干麻黄汤等经典名方的组成药物之一,为常用大宗中药材。现代研究发现半夏含有生物碱、有机酸、核苷酸、多糖、半夏蛋白、淀粉等多种化学成分[2-3]。但《中国药典》2020年版主要是以外观性状和浸出物作为质量评价标准,并以“质坚实,断面洁白,富粉性”为佳,未规定明确指标成分。湖北潜江、天门、沙洋、江陵、钟祥、京山等老荆州、荆门地区盛产半夏,历史上因“粒圆质结,色白”,被称为“荆州子”和“荆半夏”,品质上乘,乃上选[4-5]。
产地干燥加工方法直接影响药材的质量,刘勇等[6]发现阴干法处理后的三七药材质地坚实,内部结构紧密,外观性状较好,且药效成分含量较高;杨雅雯等[7]发现60 ℃热风干燥处理后的射干药材质地坚实,内部结构紧密,外观性状较好,苷元类成分含量较高。传统本草记载半夏药材产地干燥加工方法多为脱皮后“曝晒”,而当前半夏为大面积人工栽培,生产上受限于场地和天气原因产地大量采用简易炕床加热鼓风烘烤。
近年来已有学者开展了半夏药材产地干燥加工研究工作,杨小艳等[8]发现半夏药材以晒干和减压干燥的外观性状较好,生物碱与总酸含量较高;陈倩等[9]经70 ℃烘2 h 再以低温烘干或低温反复干燥的半夏样品,其5 个特有的甾醇类成分的指纹特征峰非常稳定;但此类研究工作多是围绕生物碱、有机酸等化学成分和药理作用进行研究,淀粉及核苷类成分相关研究不多,且在加工后药材外观性状、内在质量结合起来系统评价方面研究较少。因此,为探索不同干燥加工方法对半夏外观和内在品质的影响,本实验以潜江半夏为研究对象,采用常用产地初加工工艺,将采挖后的半夏进行趁鲜脱皮清洗,进行通风阴干、自然晾晒、热风干燥等不同加工干燥方式处理,结合干燥特性指标,以外在性状、内在结构和化学成分含量为指导,分析不同干燥方法对半夏品质的影响,以期优化半夏产地干燥方法,为规范半夏产地初加工工艺、保障半夏药材质量和临床用药安全提供理论依据。
1 仪器与材料
1.1 仪器
UltiΜate3000 型高效液相色谱仪,美国戴安公司;JSΜ-6510LV 钨灯丝扫描电子显微镜(SEΜ),日本JEOL 公司;A580 双光束紫外可见分光光度计,翱艺仪器有限公司;SZΜCTV(1/2)体式显微镜,南京宇恒仪器仪表有限公司;NH310 色差仪,深圳市三恩时科技有限公司;奥豪斯EX125DZH 十万分之一天平,美国奥豪斯仪器(上海)有限公司;Precisa XB220A 万分之一电子分析天平,普利赛斯国际贸易有限公司;HR/T16Μ 台式高速冷冻离心机,湖南赫西仪器装备有限公司;DHG-9070A 电热恒温鼓风干燥箱,上海森信实验有限公司;HWS28型水浴锅,昆山一恒仪器有限公司;KQ2200DB 型数控超声波清洗器,昆山市超声仪器有限公司;SX2-10-12TP 箱式电阻炉,上海市崇明实验仪器厂。
1.2 材料
对照品淀粉(批号ES00354、TC69502,2 个测量指标,直链淀粉和支链淀粉;对照品标准溶液质量浓度1 mg/mL)、河南省万佳首化生物科技有限公司;对照品鸟苷(批号111977-201501,质量分数≥93.6%)、尿嘧啶(批号100649-201302,质量分数≥99.6%)、尿苷(批号110887-201803,质量分数≥99.5%),均购于中国食品药品检定研究院;对照品腺苷(批号 X02211803002)、肌苷(批号J05911812016)、次黄嘌呤(批号C06911812016),均购于瑞芬思生物科技有限公司,质量分数≥98%;甲醇、乙腈为色谱纯,其余试剂皆为分析纯。
实验用半夏药材样品于2019年7月采挖自湖北省潜江市蔡家台,经湖北中医药大学药学院刘大会教授鉴定为天南星科半夏属植物半夏P.ternata(Thunb.) Breit.的新鲜块茎。
2 方法
2.1 实验设计
将采收后的半夏搓皮洗净,选择色白、组织紧密、手感充实、无破损、无腐烂、大小一致的新鲜半夏,混合均匀。将清洗后的半夏在滤纸上摊开,晾干表面水分,备用。实验分别设置通风阴干[取3 kg 新鲜、搓皮、洗净、晾干表面水分的半夏块茎,装入带孔塑料筛中,放置室内通风储物架上,阴晾至足干(达到安全含水率10%左右,下同)]、自然晒干(取3 kg 新鲜搓皮洗净晾干表面水分的块茎,装入带孔塑料筛中,白天放置室外太阳下暴晒,晚上放置室内通风处,自然晒至足干)、热风干燥(设置40、55、70 ℃ 3 个热风干燥温度。分别取3 kg新鲜搓皮洗净晾干表面水分的块茎,装入带孔塑料筛中,直接放入设置温度为40、55、70 ℃的3 个电热鼓风干燥箱中,热风干燥至足干)3 种方式5 个处理,每组设置3 个重复。
2.2 干燥参数测定[10]
2.2.1 干基含水率(Mt) 半夏干燥过程中干基含水率用公式(1)获得。

Wt为t时刻半夏总质量,G为半夏干物质的质量
2.2.2 水分比(ΜR) 半夏干燥过程中水分比由式(2)获得。

M0为半夏初始干基含水率,Mt为半夏在t时刻的干基含水率
2.2.3 干燥速率(drying rate,DR) 干燥过程中的干燥速率由式(3)获得。

DR 为在t1和t2之间半夏的干燥速率,Mt1、Mt2为t1、t2时的半夏的干基含水率
2.3 外观性状及物理常数测定
2.3.1 表皮观察 首先通过肉眼进行半夏的整体观察并拍照,然后通过SZΜCTV(1/2)体式显微镜进行半夏断面观察并拍照。
2.3.2 SEΜ 表征观测 采用SEΜ 对不同干燥方法的半夏样品横断面的微观结构进行观察分析。
2.3.3 色差测定[11]取干燥后的半夏用色差仪测定色差值,每个样品测定3 次,取平均值。由式(4)获得。

ΔE表示总色差,L、a、b分别表示样品的亮度值、红绿值、黄蓝值,L0、a0、b0分别表示标准样品的亮度值、红绿值、黄蓝值
2.3.4 密度测定 采用AR223CN 型美国奥豪斯电子天平加密度组件测定半夏的密度,其密度测定方法是借助于阿基米德原理(浮力法)来实现。
2.3.5 复水比 取2.0 g 半夏药材样品于150 mL 烧杯中,加入50 mL 蒸馏水,置于40 ℃恒温水浴箱中浸泡,复水完全后取出,用滤纸吸干表面水分后称量。复水比(rehydration ratio,RR)按照公式(5)计算。

WW为复水后样品的质量,Wd为复水前样品的质量
2.4 灰分、浸出物指标测定
2.4.1 灰分 参照《中国药典》2020年版四部通则2302 进行测定。
2.4.2 浸出物 参照《中国药典》2020年版四部通则2201(水溶性浸出物冷浸法)进行测定。
2.5 半夏淀粉成分含量测定
采用双波长法测定半夏中直链淀粉、支链淀粉含量[12]。
2.6 核苷类成分含量测定
2.6.1 色谱条件 Agilent XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为水-乙腈,梯度洗脱:0~10 min,0.5%~2%乙腈;10~20 min,2%~3.5%乙腈;20~30 min,3.5%~10%乙腈;30~50 min,10%~28%乙腈;50~55 min,28%~30%乙腈;55~60 min,30%~0.5%乙腈;体积流量1.0 mL/min;检测波长260 nm;柱温25 ℃;检测器为紫外检测器;进样量20 μL[13]。混合对照品和半夏晒干样品溶液的HPLC 图见图1。

图1 混合对照品 (A) 和半夏晒干样品 (B) 的HPLC 图Fig.1 HPLC for mixed reference substances (A) and Pinelliae Rhizoma sample under sun-drying (B)
2.6.2 供试品溶液制备 取半夏药材粉末(65 目)2.0 g,精密称定,置具塞锥形瓶中,精密加入纯水20 mL,密塞,摇匀,称定质量,超声处理45 min,放冷,再称定质量,用水补足减失的质量,摇匀,4000 r/min 离心5 min,经0.22 μm 微孔滤膜滤过,即得供试品溶液。
2.6.3 对照品溶液制备 分别取对照品鸟苷5.85 mg、次黄嘌呤5.42 mg、尿苷5.66 mg、肌苷4.87 mg、尿嘧啶6.07 mg、腺苷4.70 mg,精密称定,于10 mL量瓶中加水溶解并定容至刻度,摇匀。分别精密量取1 mL 置于50 mL 量瓶中,加水溶解并定容至刻度,摇匀,制成鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷质量浓度依次为11.70、10.84、11.32、9.74、12.14、9.40 µg/mL 的对照品溶液,备用。
2.6.4 线性关系考察 分别精密量取上述对照品溶液制备项下的鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷对照品溶液1、2、4、6、8 mL 于50 mL 量瓶中,用纯水稀释至刻度,摇匀,得到不同质量浓度梯度的对照品溶液,在上述色谱条件下进样测定。以峰面积为纵坐标(Y),对照品的质量浓度为横坐标(X)进行线性回归,得回归方程分别为鸟苷Y=1.463 1X+0.008 5,r2=0.999 9,线性范围0.234~1.872 μg/mL;次黄嘌呤Y=1.186X-0.005 9,r2=0.999 9,线性范围0.216 8~1.734 4 μg/mL;尿苷Y=0.811 7X-0.004 7,r2=0.999 9,线性范围0.226 4~1.811 2 μg/mL;肌苷Y=0.557 5X+0.003 5,r2=0.999 7,线性范围0.194 8~1.558 4 μg/mL;尿嘧啶Y=0.734 0X-0.003 5,r2=0.999 9,线性范围0.242 8~1.942 4 μg/mL;腺苷Y=1.088 3X-0.011 8,r2=0.999 9,线性范围0.188 0~1.504 0 μg/mL;结果表明,各指标成分在各自线性范围内关系良好。
2.6.5 精密度试验 取混合对照品适量,按“2.6.1”项色谱条件重复进样6 次,记录色谱峰面积,结果鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷峰面积的RSD 分别为0.69%、0.75%、1.42%、0.93%、1.17%、1.33%,表明仪器精密度良好。
2.6.6 稳定性试验 取晒干样品按照“2.6.2”项制备供试品溶液,分别于制备后0、2、4、6、8、12 h按上述色谱条件进样测定,记录色谱峰面积。结果鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷峰面积的RSD 分别为3.40%、4.80%、1.28%、3.90%、4.25%、4.20%,表明供试品溶液在12 h 内稳定。
2.6.7 重复性试验 精密称取晒干半夏粉末2 g,平行称定6 份,按照“2.6.2”项制备供试品溶液,结果鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷质量分数的RSD 分别为1.44%、1.54%、0.97%、1.03%、2.50%、2.90%,表明该方法重复性良好。
2.6.8 加样回收率试验[14]取已测定指标成分含量的晒干半夏药材粉末6 份,每份0.5 g(《中国药典》2020年版未规定半夏药材含量测定的取样量,本项取样量经过大量半夏核苷类文献检索,发现加样回收取样量在0.1~2 g 不等,然后依据已测定的晒干半夏药材含量计算得到,若仍然称取2 g,为使加入的对照品成分质量与样品中待测成分含有量相当,则加入溶剂的体积将超过20 mL),精密称定,每份样品皆分别加入“2.6.3”项下制备的鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷的对照品溶液,加入溶液体积依次为2、2、8、3、4、0.5 mL,使加入的对照品成分质量与样品中待测成分含有量相当,按照“2.6.2”项制备供试品溶液,按上述色谱条件测定,记录色谱峰面积,计算加样回收率,结果鸟苷、次黄嘌呤、尿苷、肌苷、尿嘧啶、腺苷的平均加样回收率分别为104.25%、98.08%、101.00%、97.80%、98.00%、105.18%,RSD 分别为1.87%、1.60%、2.37%、2.60%、1.67%、2.54%。
2.7 统计方法
采用Excel 2010 和SPSS 21.0 进行数据整理分析,采用GraphPad Prism5.0 软件作图。
3 结果与分析
3.1 不同干燥方法对半夏药材干燥特性影响
从干燥曲线(图2)可知,不同干燥方法下的半夏药材水分比随着干燥时间延长均呈指数下降。进一步对各干燥方法的干燥曲线进行指数函数拟合(表1),结果表明阴干、晒干、40 ℃烘干、55 ℃烘干、70 ℃烘干各种干燥方法使半夏达到安全含水率(10%)分别需要用时为143.90、75.56、46.27、21.90、14.66 h。

表1 不同干燥方法下半夏药材的干燥曲线拟合公式Table 1 Drying curve fitting formula of Pinelliae Rhizoma under different drying methods
半夏药材传统干燥方式为晒干,阴干相较于晒干干燥时间延长了47.5%,40、55、70 ℃烘干相较于晒干分别缩短38.8%、71.0%、80.6%。晒干过程中,半夏药材干燥速度的下降速率较为平缓,其干燥曲线及干燥速率曲线波动较其他4 种干燥方式稍大,可能是受日光照射时间和昼夜温差的影响;阴干处理过程中,半夏药材干燥速度呈持续下降趋势,但下降趋势非常平缓,其在干燥阶段需经过一个较长的恒速期,仅在其预热期(表面水分蒸发期)干燥速率较快;40 ℃烘干过程中,半夏药材失水速度及干燥过程变化差异较前者表现的十分明显,干燥速度在0~25 h 下降幅度较大,25~72 h 下降较为平缓直至趋于平稳,干燥速率曲线表明整个干燥过程主要表现为降速期,Mt从1.98 g/g 降到1.75 g/g的过程中是一段恒速期,在1.75~1.33 g/g 过程中干燥速率急剧下降后从1.33~1.07 g/g 这一段过程中表现为升速期;55 ℃烘干干燥过程中,半夏药材失水速度较40 ℃烘干处理更加剧烈,其整个干燥过程都呈大幅度快速下降趋势,仅在18 h 之后相较于0~18 h 稍缓直至趋于平稳,干燥速率曲线表明,该干燥过程呈现2 段升速期,Mt从1.98~1.65 g/g的过程中是一段升速期,从1.65~0.97 g/g 过程中DR 值由缓慢下降然后急剧下降后在0.97~0.70 g/g这一段过程中表现为升速期,之后呈现大幅度快速下降趋势;70 ℃烘干过程半夏药材失水速度最为剧烈,干燥速度在0~6 h 大幅度快速下降,6 h 之后下降速度稍缓直至趋于平稳,干燥速率曲线表明,70 ℃烘干半夏药材的干燥阶段主要表现为降速期,仅在干燥过程即将结束时有较短恒速期,且降速阶段DR 下降非常明显(图2)。
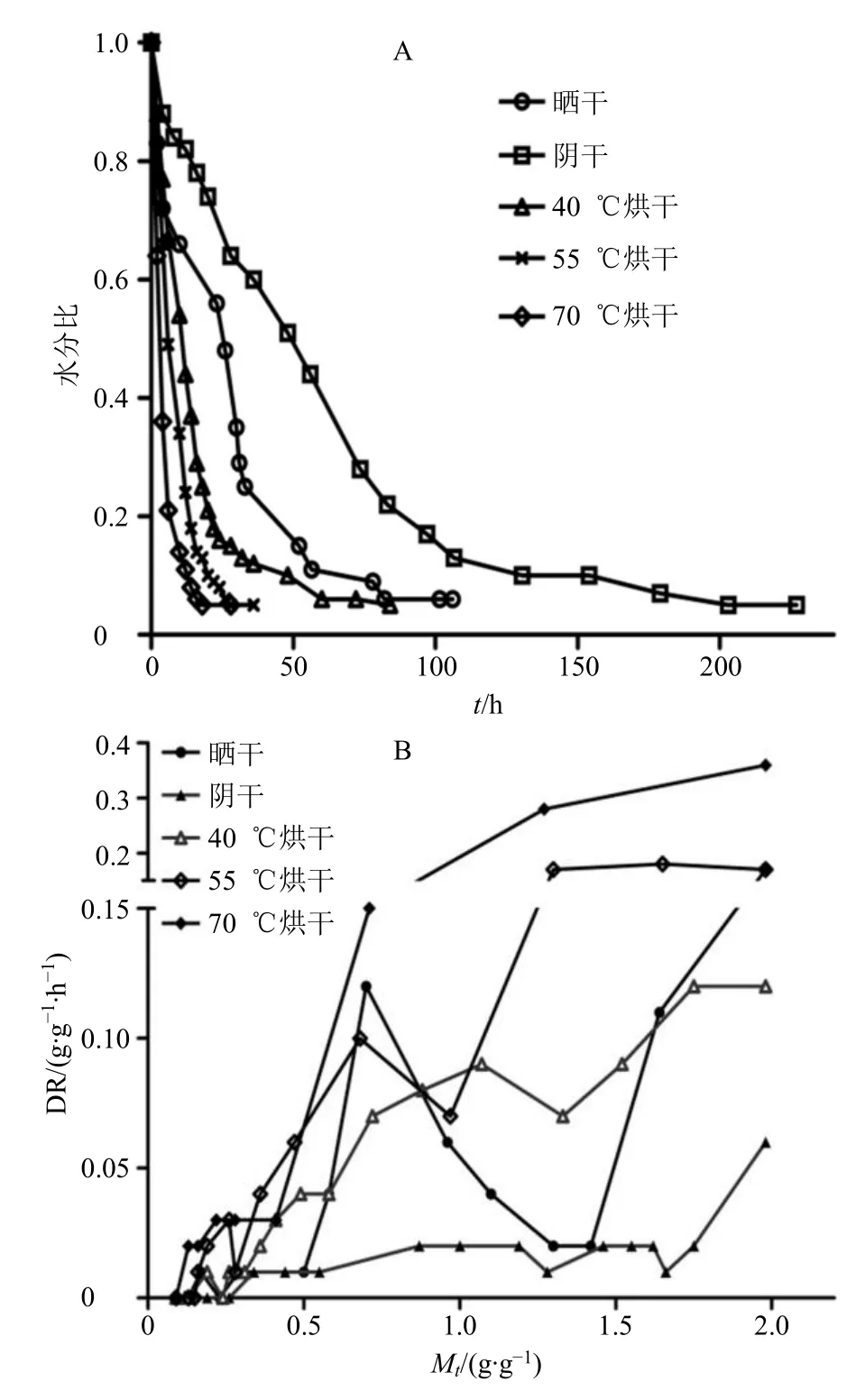
图2 不同干燥方法下半夏药材的干燥曲线 (A) 与干燥速率曲线 (B)Fig.2 Drying curve (A) and drying rate curve (B) of Pinelliae Rhizoma under different drying methods
3.2 不同干燥方法对半夏药材外观性状的影响
新鲜半夏脱皮后表面呈白色,但干燥后半夏块茎会发生不同程度的褐变和角质状,颜色变为黄褐色或者灰褐色。晒干半夏表面黄白色,质坚实,断面洁白,富粉性,与药典描述最为接近。阴干半夏因干燥时间长,药材表面变为黑褐色,切面淀粉呈絮状,粉性不足,品相较差。40、55、70 ℃烘干处理半夏表面黄棕色,质坚实,断面洁白,但表皮均出现不同程度的角质化。
用色差仪测定不同干燥方法下干燥后半夏药材表皮,切面的色差值,发现不同干燥方法均导致干燥后半夏药材表皮色泽度不同程度的降低,其中阴干条件下所得干制品的L*值最低,说明该条件导致物料的表皮色泽最暗;晒干条件下所得干制品的a*最高,b*值偏低,ΔE值最小,且切面L*最高,说明晒干条件下的色泽亮,颜色为黄白色;3 种烘干处理中55 ℃下L*最高,ΔE值较小,a*较高,b*最高,且断面L*最高,说明在这3种烘干干燥温度中55 ℃下的性状略好(表2)。

表2 不同干燥方法下干燥后半夏药材表皮及切面颜色比较Table 2 Comparison of epidermal and cross-sectional color of Pinelliae Rhizoma under different drying methods
用SEΜ 对不同干燥方法干燥后半夏药材样品横断面的微观结构进行观察分析可见,晒干处理半夏药材样品断面孔洞直径较小,较少,结构紧实;阴干处理样品断面空洞直径大小中等,较晒干稍大且多;3 种烘干处理较晒干,阴干处理空洞均较大较多,其中70 ℃烘干处理相对40 ℃与55 ℃烘干处理半夏样品孔隙要少(图3)。

图3 不同干燥方法下半夏药材表皮 (A)、切面 (B)、SEM (C) 图片Fig.3 Surface (A),cross section (B),and SEM (C) images of Pinelliae Rhizoma with different drying methods
3.3 不同干燥方法对半夏药材折干率、灰分、浸出物、密度、复水比的影响
不同干燥方法对干燥半夏药材的折干率和灰分含量影响不大,比较而言55 ℃烘干折干率略高,40 ℃烘干折干率略小,阴干灰分含量较低。阴干浸出物最高,晒干与40 ℃烘干次之,70 ℃烘干最低,表明烘干温度对半夏药材浸出物含量也影响较大,烘干温度越高,半夏药材可溶性浸出物含量越低。晒干、阴干、40 ℃烘干3 处理干燥后半夏药材密度差异不大,55 ℃烘干、70 ℃烘干干燥后半夏药材密度随干燥温度的升高较前3 处理大幅降低,表明烘干温度对半夏药材密度影响较大。
5 种干燥方法下阴干处理复水比最低,晒干次之,40、55、70 ℃烘干处理复水比较高,进一步表明烘干处理半夏药材容易形成疏松多孔的结构,从而利于水分吸收(表3)。

表3 不同干燥方法对半夏药材折干率、灰分、浸出物、密度、复水比的影响 (n=3)Table 3 Effects of different drying methods on the drying rate,density,extract,ash content and rehydration ratio of Pinelliae Rhizoma (n=3)
3.4 不同干燥方法对半夏药材淀粉含量的影响
晒干半夏药材直链淀粉含量最高,阴干处理含量最低(表4)。70 ℃烘干半夏药材支链淀粉含量最高,40 ℃次之,阴干后的含量最低。支链淀粉含量/直链淀粉含量的比值是70 ℃条件下最大,为2.29,晒干条件下最小为1.74。直链淀粉含量高的淀粉内部结构较紧密,比直链淀粉含量低的淀粉糊化困难,而支链淀粉含量越多粘度越高,则粉性不足,与其外观性状结果一致。

表4 不同干燥方法对半夏药材淀粉含量及支链/直链淀粉占比的影响 (n=3)Table 4 Effects of different drying methods on starch contents and amylose/branched amylose ratio of Pinelliae Rhizoma (n=3)
3.5 不同干燥方法对半夏药材核苷类成分含量的影响
半夏药材鸟苷成分含量是阴干最高(表5),其次是55 ℃烘干,晒干和40 ℃烘干较低,70 ℃烘干最低,较阴干下降71.4%;次黄嘌呤成分含量是40 ℃烘干最高,阴干其次,70 ℃烘干最低,较40 ℃烘干下降72.7%;尿苷成分70 ℃烘干含量最高,其他4 种处理含量差异不大,较70 ℃烘干下降36.8%~47.4%;肌苷成分含量是55 ℃烘干含量最高,阴干其次,70 ℃烘干最低,较55 ℃烘干下降76.9%;尿嘧啶成分含量是70 ℃烘干含量最高,晒干其次,40 与55 ℃烘干含量最低,较70 ℃烘干下降72.0%;腺苷成分含量是70 ℃烘干含量最高,55 ℃烘干其次,其他3 种处理最低,较70 ℃烘干下降83.3%。

表5 不同干燥方法对半夏核苷类成分含量的影响 (n=3)Table 5 Effects of different drying methods on content of nucleosides in Pinelliae Rhizoma (n=3)
综上可知,半夏中鸟苷、肌苷、次黄嘌呤成分含量随着温度的升高呈先增加后降低的趋势,半夏中尿苷,尿嘧啶和腺苷成分含量随着温度的升高整体呈先降低后增加的趋势。
4 讨论
中药材产地干燥加工不仅是一种方便药材运输和储藏的有效手段,更是一种赋予药材以特殊药性及品质的过程[15]。中药材新鲜块茎脱水干燥分为外控干燥阶段(排除块茎表面的自由水分为主)和内控干燥阶段(排除块茎内部结合水和毛细管水)2 部分。本研究中半夏传统晒干干燥工艺,白天阳光曝晒,环境温度逐步升高,促进了半夏块茎外控干燥脱水,干燥速率上升,水分比下降较快;傍晚后太阳下山,环境温度逐步下降,外控干燥脱水减弱,干燥速率下降,水分比下降变慢;且夜间由于半夏块茎表皮和内部出现水分含量梯度(白天表皮自由水分散失),促进了块茎内部结合水和毛细管水向表皮迁移,此时以内控干燥脱水为主,块茎表皮出现回潮;如此昼夜交替,形成了半夏块茎外控干燥阶段和内控干燥阶段主导作用交替,故其干燥曲线和干燥速率出现波动;这也促进半夏块茎外控、内控干燥脱水平衡,因而其内部结构紧密、均匀,密度大,复水比小。半夏阴干处理由于环境温度较低且稳定,其干燥速率较低,水分比下降较慢,脱水时间长,且其外控干燥脱水和内控干燥脱水趋于平衡,故其干燥干燥曲线和干燥速率比较平缓,波动非常小,这也促进内部结构更紧密,密度大,复水比更小。不同温度鼓风烘干处理,由于外界环境温度高和鼓风排湿,促进了半夏块茎整个脱水干燥过程是外控干燥脱水占主导,故其干燥速率快、水分比下降快,且波动较小;但外控、内控干燥脱水的不平衡,急速脱水导致了内部结构出现空隙、开裂,甚至空心,密度减小,故复水比增大。邱婷等[16]发现在半夏药材干燥过程有一个速率急剧降低后又升高的情况,和本研究半夏干燥速率相似,可能跟半夏干燥过程中外壳硬强化后,水分溢出困难有关。
严茂伟等[17]研究发现半夏在干燥过程中会酶促褐变导致表面变褐色,容易干燥不当产生“僵子”,与优质半夏“色白,粉圆”有差异,影响了半夏的品质与药理活性。淀粉在过量水存在的条件下加热时,结构会经历一个由有序向无序变化的相变,即淀粉的糊化过程,糊化温度范围随淀粉不同而不同[18]。本研究70 ℃烘干后半夏药材角质化严重,可能是半夏药材高温烘干过程中,淀粉糊化导致其角质化严重,粉性不足。中药材在加工过程中的褐变现象比较普遍,导致半夏干燥过程发生褐变的机制并不单一,酶促反应与羰氨反应在半夏药材干燥过程中都会发生,新鲜半夏中含有葡萄糖与17 种氨基酸,易发生羰氨反应[17],导致其干燥过程中褐化严重。本研究半夏药材阴干干燥时间较长,40 ℃其次,半夏药材酶促反应与羧氨反应时间较长,则褐化严重。晒干与55 ℃烘干处理温度适中,干燥时间较短,半夏药材外观性状较好。
不同干燥方法半夏药材直链淀粉含量晒干与阴干干燥有显著差异,直链淀粉含量高有利于防止破裂保持淀粉粒的完整性,使淀粉有较强的抗剪切稀化能力[19]。直链淀粉与支链淀粉的比例已被公认为是淀粉物化性质与功能特性的重要决定因素,大量研究认为直链淀粉含量直接影响谷物在烹煮等加工过程中的吸水膨胀,受热糊化以及成品品质,并将直链淀粉含量作为预测淀粉加工性质,淀粉质食品品质的重要指标。研究发现木薯原淀粉中支链淀粉与直链淀粉的比例高达4∶1,所以黏性强,吸水性强,糊化之后呈现出透明的块状[20]。本研究中,70 ℃干燥的半夏支链淀粉与直链淀粉的比值较高达到2.29,说明高温烘烤会导致半夏淀粉糊化,从而出现与木薯淀粉相似的透明的块状,导致干燥后半夏药材粉性降低,并导致半夏药材可溶性浸出物含量降低。
杨书婷等[21]对不同温度干燥的珍珠贝软体进行核苷类成分含量测定,发现珍珠贝样品尿苷成分在70 ℃烘干含量最高,而鸟苷和肌苷成分含量分别在30 ℃与70 ℃烘干含量最高;次黄嘌呤和尿嘧啶成分在40 ℃和50 ℃烘干含量最高-。本研究半夏药材尿苷成分含量与次黄嘌呤成分最低含量与上述文献结果一致,尿苷在70 ℃烘干含量最高,次黄嘌呤成分在70 ℃烘干含量最低。尿嘧啶和腺苷成分则是在70 ℃烘干含量最高;高温对半夏药材鸟苷和肌苷成分含量影响较大,本研究与上述文献结果相反,在70 ℃烘干二者含量最低。
中药材产地初加工干燥方法的形成和选择常常是基于临近产地、操作简单、技术要求低、投入较少等原则[6],本研究比较了生产上使用较为普遍的传统阴干,晒干,烘干方法,综合评价结果表明半夏药材最宜采用晒干处理的干燥方法。半夏生产上如受限场地和天气因素,则可模拟晒干干燥原理进行半夏仿日晒干燥技术研发。一是采用日光温室结合鼓风排湿设施,进行半夏立体多层干燥,提高场地空间利用效率和晒干效率,并减少晾晒过程中降雨天气影响;二是采用粮食和食品的干燥设备,进行低温(不高于55 ℃)鼓风烘烤和间歇回潮相结合方式,优化相关参数,进行半夏药材仿日晒烘干。
利益冲突所有作者均声明不存在利益冲突

