过瘤胃半胱胺对舍饲滩羊生长性能、养分表观消化率、肉品质及血清抗氧化指标的影响
李荫柱 钟 锐 李海海 方 洲 徐小春 寇启芳 张桂杰*
(1.宁夏大学动物科学系,银川 750021;2.宁夏草牧业工程技术研究中心,银川 750021;3.北方民族大学生物科学与工程学院,银川 750021;4.吴忠市红寺堡区天源良种羊繁育养殖有限公司,吴忠 751900)
滩羊结合宁夏得天独厚的水草资源和天然地理环境,形成了滩羊肉的独特品质,其口感细嫩、味道鲜美,深受消费者青睐和推崇。为推进生态环境建设和满足羊肉的消费需求,肉羊饲养方式逐渐转为舍饲为主。舍饲环境下羊只由于运动量少,肌肉中抗氧化酶活性降低,进而影响肉品质[1-2]。半胱胺(cysteamine,CS)为一种生物活性肽,具有抗氧化、促进生长、缓解应激、调节免疫等生理功能,具有促进哺乳动物生长和改善其产品品质等作用[3]。CS在动物胃肠道和下丘脑中产生,作用于生长轴,能够显著影响与生长轴相关的因子,尤其是耗竭动物体血液中生长抑素(somatostatin,SS)水平[3-5],以提高动物机体中生长激素(growth hormone,GH)水平,从而提高动物生长性能,改善肉品质[6]。薛瑞婷等[7]在饲粮中添加100 mg/kg包被CS显著提高了育肥猪的末重,显著降低了料重比;Barnett等[8]研究表明,饲粮中添加80 mg/kg的CS可显著增加美利奴·多赛特羔羊体重,提高饲料转化率;Szabo等[9]通过研究溃疡治病机理,在大鼠的胃瘘管加入CS后可迅速降低下丘脑、十二指肠以及胃的SS免疫活性。此外,CS自身的巯基基团具有抗氧化功能[10],能有效清除活性氧自由基(ROS)、活性氮自由基(RNS)等[11-12]。CS是细胞内含量最丰富的非蛋白抗氧化剂,本质是一种三肽(γ-谷氨酰半胱氨酰甘氨酸),可通过自身途径或间接途径增加动物血液中主要的抗氧化物质——谷胱甘肽(glutathione,GSH)含量,在抵御细菌、病毒、氧化应激诱导的细胞损伤和线粒体损伤中起着至关重要的作用。同时可作为其他抗氧化酶或修复酶的底物[13],促进淋巴细胞的增殖[14]。综上所述,CS具有提高机体免疫和抗氧化功能的作用。
CS化学性质不稳定且易氧化,易在反刍动物瘤胃中降解,因此本试验使用的CS是过瘤胃半胱胺(rumen protected cysteamine,RP-CS)。国内外学者研究发现,CS对猪、禽类、牛等动物都有明显的促生长作用[4,15-17],但关于RP-CS对滩羊生长性能和肉品质的影响鲜有报道。基于前人的研究,我们假设RP-CS可以通过调节氧化水平、抗氧化酶活性来改善滩羊肉品质和保护肌肉免受氧化应激,就RP-CS对舍饲滩羊生长性能、养分表观消化率、肉品质及血清抗氧化指标的影响进行研究,为其在舍饲滩羊生产中科学、合理地应用提供理论基础。
1 材料与方法
1.1 试验设计
试验选用3月龄、体重[(21.61±0.80) kg]相近、健康的去势滩羊48只,随机分为4组,每组3个重复(圈),每个重复4只羊。对照组饲喂基础饲粮,试验组分别在基础饲粮中添加0.02%(0.02%组)、0.04%(0.04%组)和0.06%的RP-CS(0.06%组)。预试期7 d,正试期134 d。
参照NRC(2007)营养需要配制基础饲粮,其组成及营养水平见表1。RP-CS由山东某农业发展有限公司馈赠,过瘤胃率为85%。
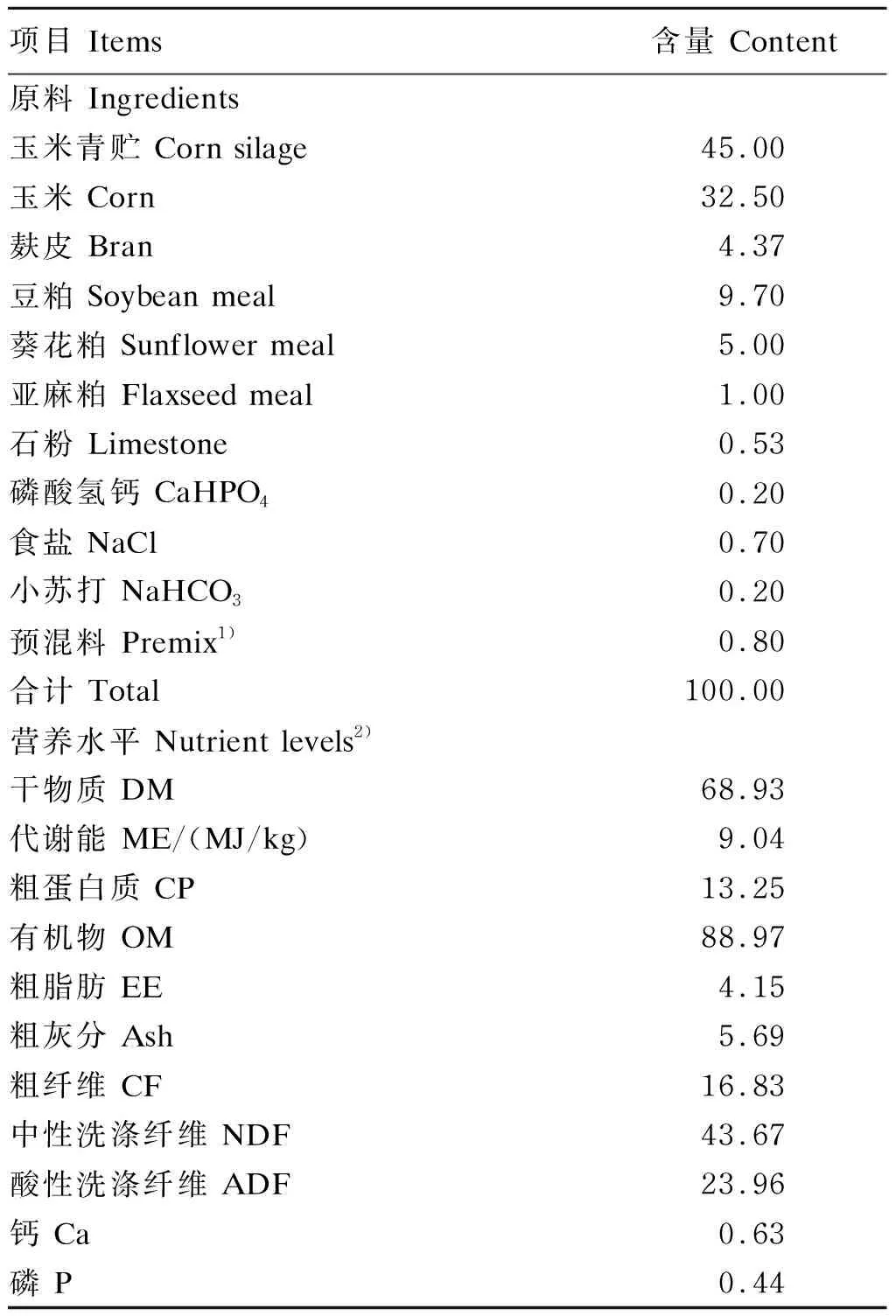
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
1.2 饲养管理
试验羊统一编号,进行布病检测,注射伊维菌素、口蹄疫、羊痘、小反刍、三联四防驱虫防疫,药浴剪毛后饲养在通风良好的半开放式羊舍内。预试期7 d,正试期134 d。定期对羊舍进行消毒,保持羊圈干净整洁。分别于每天08:00和18:00以全混合日粮(TMR)的形式等量饲喂,自由饮水。每天根据前1天剩余料情况,调整饲喂量,保证饲料有少量剩余,以保证羊只的饱食及增重,但不超过饲喂量的5%。
1.3 检测指标与方法
1.3.1 饲粮营养水平
饲粮干物质(DM)、粗蛋白质(CP)、钙(Ca)、磷(P)含量分别参照中华人民共和国国家标准GB/T 6435—1986、GB/T 6432—1994、GB/T 6436—2002和GB/T 6437—2002方法测定,有机物(OM)、粗脂肪(EE)、粗灰分(Ash)、粗纤维(CF)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量根据张丽英[18]编著的《饲料分析及饲料质量检测技术》进行测定。
1.3.2 生长性能
试验开始和结束时,早晨空腹个体称重并记录,计算平均日增重(ADG);每次饲喂前清理料槽并对剩料进行称重记录,计算平均日采食量(ADFI);根据平均日采食量和平均日增重计算料重比。
1.3.3 养分表观消化率
根据滩羊每日TMR的总采食量和DM水平计算滩羊24 h内平均干物质采食量(dry matter intake,DMI)。试验第43天,每组选取3只羊,即每圈挑选1只具有典型代表、接近本圈羊平均生长水平的羊只进行消化代谢试验,采用消化代谢笼全收粪法进行,适应3 d后连续收粪4 d,每次饲喂前1 h(07:00和17:00)收集1次鲜粪并称重,按照粪重的10%加入10%稀硫酸固氮,-20 ℃保存,最后将4 d的样品混合后烘干粉碎,测定收集粪样的DM、CP、EE、OM、NDF和ADF含量,测定方法参照张丽英[19]编著的《饲料分析及饲料质量检测技术》。NDF和ADF含量采用全自动纤维分析仪(ANKOM A2000i)进行测定。养分表观消化率计算公式如下:
某养分表观消化率(%)=100×(摄入
该养分含量-排出该养分含量)/摄入
该养分含量。
1.3.4 肉品质
pH:试验羊屠宰后45 min取背最长肌,使用便携式pH计测定肌肉pH,待pH计示数稳定后读数,重复5次取均值。45 min、24 h后pH方法同上,分别记为pH45 min、pH24 h。
滴水损失:取背最长肌6 g左右样品(2 cm×2 cm×2 cm),悬空在充有饱满气体的塑封袋,用细绳悬于4 ℃冰箱,24 h后取出,用滤纸擦干表面水分,称重记录。计算公式如下:
滴水损失(%)=100×(悬挂前肉样重-
悬挂后肉样重)/悬挂前肉样重。
剪切力:取一块合适的背最长肌,将其去除肌肉表面的脂肪后装入塑封袋内封口,将肉样放置在4 ℃冰箱中24 h,从冰箱中取肉样,放置室温后,将温度计插入肉样的中心部位,置于塑封袋中,将袋口封好后放入80 ℃恒温水浴锅中加热,当温度计显示温度达到75 ℃时取出冷却至室温。按肌纤维方向切成长2 cm,宽、高均为1 cm待测样品。用C-LM型嫩度仪测其剪切力,测定5次取平均值。

系水力和蒸煮损失计算公式如下:
系水力(%)=100×(压前肉样重-
压后肉样重)/压前肉样重;
蒸煮损失(%)=100×(煮前肉样重-
煮后肉样重)/煮前肉样重。
1.3.5 血清抗氧化指标
试验第133天时,每组选取3只羊,即每个重复挑选1只具有典型代表、接近本圈羊平均生长水平的羊只,进行颈静脉采血,将采集的血液置于5 mL离心管中,然后在4 ℃、1 980×g离心机中离心15 min后析出血清,将析出血清倒入新的离心管并置于-20 ℃冰箱保存待测。按照试剂盒说明书按步骤操作,采用比色法测定血清中丙二醛(MDA)含量、总抗氧化能力(T-AOC)及总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)活性,试剂盒购自南京建成生物工程研究所。
1.4 数据统计
试验所有数据采用Excel 2010进行初步整理,采用SAS 8.2的ANOVA过程进行单因素方差分析,组间差异采用Duncan氏法进行多重比较,以P<0.05作为差异显著判定标准。
2 结 果
2.1 过瘤胃半胱胺对舍饲滩羊生长性能的影响
由表2可知,与对照组相比,0.02%组、0.04%组、0.06%组的平均日采食量和料重比显著降低(P<0.05),其中,0.06%组的平均日采食量最低,0.04%组的料重比最低;0.04%组的平均日增重显著升高(P<0.05)。

表2 过瘤胃半胱胺对舍饲滩羊生长性能的影响Table 2 Effects of RP-CS on growth performance of captivity Tan sheep
2.2 过瘤胃半胱胺对舍饲滩羊养分表观消化率的影响
由表3可知,0.04%组和0.06%组的干物质采食量显著低于0.02%组(P<0.05),0.02%组显著低于对照组(P<0.05),而0.04%组和0.06%组之间无显著差异(P>0.05)。0.04%组的粪干物质排出量显著低于0.02%组(P<0.05),0.02%组显著低于0.06%组(P<0.05),0.06%组低于对照组(P<0.05)。与对照组相比,0.02%组和0.04%组的DM和CP表观消化率显著升高(P<0.05),0.04%组和0.06%组的OM表观消化率显著升高(P<0.05)。而各组之间EE、NDF和ADF表观消化率均无显著差异(P>0.05)。

表3 过瘤胃半胱胺对舍饲滩羊养分表观消化率的影响(DM基础)Table 3 Effects of RP-CS on nutrient apparent digestibility of captivity Tan sheep (DM basis)
2.3 过瘤胃半胱胺对舍饲滩羊肉品质的影响

表4 过瘤胃半胱胺对舍饲滩羊肉品质的影响Table 4 Effects of RP-CS on meat quality of captivity Tan sheep
2.4 过瘤胃半胱胺对舍饲滩羊血清抗氧化指标的影响
由表5可知,与对照组相比,0.02%组、0.04%组、0.06%组的血清谷胱甘肽过氧化酶活性显著升高(P<0.05),血清丙二醛含量显降低(P<0.05);0.04%组和0.06%组的血清总抗氧化能力和总超氧化物歧化酶活性显著升高(P<0.05)。

表5 过瘤胃半胱胺对舍饲滩羊血清抗氧化指标的影响Table 5 Effects of RP-CS on serum antioxidant indexes of captivity Tan sheep
3 讨 论
3.1 过瘤胃半胱胺对舍饲滩羊生长性能和养分表观消化率的影响
动物生长发育除受到年龄、环境、生理状态、基因表达、神经内分泌及体内代谢的影响外,其很大程度上是由GH、胰岛素样生长因子轴来调节的[4]。本质上来说,CS主要由下丘脑生长激素释放激素(GHRH)和SS来调控GH分泌的,CS对SS具有耗竭作用是由于CS具有间隔2个碳原子的巯基和氨基,能直接与SS分子作用,使SS的二硫键发生改变,破坏其生物活性和免疫活性,从而解除对GH的抑制作用,促进垂体前叶分泌GH进入血液,使GH水平升高,从而促进动物机体骨骼、内脏和全身生长。CS除耗竭SS和影响其他激素的分泌水平外,亦可抑制多巴胺羟化酶[19],减少多巴胺(dopamine,DA)的羟化,进而减少下丘脑内去甲肾上腺素(NE)水平和增加DA蓄积,DA进一步促进GH的合成分泌[3],从而促进畜禽的生长发育。宋天增等[20]给藏绵羊断奶羔羊隔日饲喂300 mg/kg CS,平均日增重和饲料转化利用率在第8~35天显著高于对照组。岳晓帆[21]研究发现,在萨福克羊饲粮中添加10 mg/kg的CS,其体增重显著升高,血清SS含量显著降低。本研究发现,饲粮中添加0.04%的RP-CS可显著提高舍饲滩羊平均日增重。这可能是RP-CS耗竭SS提高内源性GH和胰岛素(INS)水平,INS可加速组织细胞吸收利用葡萄糖,在肝脏中合成糖原和脂肪;而GH可促进胰岛素样生长因子-Ⅰ(IGF-Ⅰ)合成。一方面,IGF-Ⅰ能够促进软骨生长和细胞增殖,并能通过自分泌、内分泌和旁分泌作用于靶细胞,改变合成代谢,提升DNA和RNA的转录翻译水平,进而促进蛋白质合成和肌肉生长[22];另一方面,GIF-Ⅰ能减少蛋白质的分解代谢和增强肝脏及肌肉摄取外源性氨基酸,从而增加蛋白质合成,并促进脂肪分解,增强脂肪酸氧化,为动物的生长发育提供能量,限制了外周组织摄取利用葡萄糖;加之IGF-Ⅰ可以调控体内营养素分配[22],进而使滩羊平均日增重显著增加。饲粮添加0.06%的RP-CS与添加0.04%的RP-CS相比,舍饲滩羊的平均日增重、平均日采食量更低,料重比更高,这个可能是因为RP-CS添加量偏高,动物消化系统SS将会消耗过度,致使消化液亢进分泌,血流量加快,引发动物消化道一定程度的溃疡[23],致使舍饲滩羊采食量下降,进而影响RP-CS在饲粮中的应用效果。
与对照组相比,饲粮中添加0.02%和0.04%的RP-CS均可显著提高饲粮DM和CP表观消化率,且添加量为0.04%时效果最佳。可能是CS在动物体内可减少对促胃液素、促胰液素释放的抑制,增加促胃液素、促胰液素的分泌,改善瘤胃的发酵以及胃肠和胆囊蠕动[24],调节消化酶的活性;同时,CS还可以影响其他激素的分泌水平,例如胃泌素及三碘甲状腺原氨酸(T3)、甲状腺激素(T4),胃泌素能刺激胃酸与胃蛋白酶原的分泌,増加胃血流量,引起胃窦收缩,还能引起胃肠道黏膜上皮细胞分裂[25];T3和T4可促进机体新陈代谢、生长发育和组织分化[26],进而促进了动物机体对养分的消化吸收,加速新陈代谢,提高养分表观消化率,改善动物生长性能;此外,CS还可以在双加氧酶的作用下生成次牛磺酸,次牛磺酸再经氧化生成牛磺酸,牛磺酸可以增加军曹鱼体内淀粉酶和胰蛋白酶的活性[27];这可能是饲粮中添加适量RP-CS可以显著降低舍饲滩羊料重比和提高饲粮养分表观消化率的主要原因。
3.2 过瘤胃半胱胺对舍饲滩羊肉品质的影响
肉品质是一个复合性状指标,屠宰前受营养、年龄、性别、遗传和环境等共同因素的影响,屠宰后受屠宰方式、屠宰环境、胴体分割技术和储存方式等共同作用影响。其中pH、剪切力、肉色、系水力等皆是评定肉品质的重要指标,它们彼此关联,互相影响。
动物屠宰后,肌肉细胞不会立即死亡,它试图维持机体平衡[28],改变新陈代谢,此时肌肉pH在6.0~7.0,为正常值[29]。本研究中,背最长肌的pH45 min在6.19~6.41,均符合正常的肉质标准,这表明饲粮中添加RP-CS对滩羊肌肉的pH无消极影响。孙劲松等[30]研究表明,滩羊屠宰后,由于血液循环停止,肌肉细胞由有氧呼吸变成无氧呼吸,消耗大量肌糖原产生大量乳酸,导致pH呈下降趋势。本研究显示,饲粮中添加0.02%的RP-CS就可显著提高背最长肌的pH24 h和系水力,这表明饲粮中添加适量的RP-CS在一定程度上可以有效缓解糖酵解的速度,进而减少排酸,降低滩羊肉储藏损失,对滩羊肉品质起到了明显的保护作用。肉嫩度是决定肉品质的关键因素之一,是反映肉品质的重要指标[31],剪切力越大代表其硬度越大,嫩度越小,反之嫩度越大。本研究显示,饲粮中添加0.04%和0.06%的RP-CS可显著降低剪切力和蒸煮损失,这表明饲粮中添加适量的RP-CS可以提高羊肉的嫩度。这是因为饲粮中添加适量的RP-CS缓解了糖酵的速度,进而减少了排酸,提升了羊肉的系水力,降低了蒸煮损失,从而使其嫩度提高。
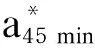
3.3 过瘤胃半胱胺对舍饲滩羊血清抗氧化指标的影响
总抗氧化能力是衡量动物机体应对氧化应激抵抗能力强弱的主要参数,反映酶促体系和非酶促体系对外来刺激的代偿能力以及机体自由基代谢的情况。丙二醛是膜脂质过氧化指标,是代谢过程中自由基攻击细胞膜生成的不饱和脂肪酸而引发的脂质过氧化反应生成的物质,可间接反映细胞氧化受损程度。本研究显示,与对照组相比,饲粮中添加0.02%、0.04%和0.06%的RP-CS显著降低了血清丙二醛含量,饲粮中添加0.04%和0.06%的RP-CS显著提高了血清T-AOC。这表明饲粮中添加适量的RP-CS可增强舍饲滩羊血液对氧化应激的抵抗能力,能够保护相关细胞免受氧化损伤。
自由基是造成氧化损伤的根本原因,其中包括各种生化反应产生的活性自由基,特别是在细胞呼吸中。自由基包括ROS、RNS、脂质自由基、脂质过氧化物,其中ROS包括羟基自由基、超氧自由基和过氧化氢等;RNS包括二氧化氮(NO2)、一氧化氮(NO)和过氧化亚硝酸盐等。但动物机体有自己的抗氧化防御系统,主要由抗氧化酶和非酶抗氧化物质组成,它能阻止脂质链式反应的引发或消除己引发的自由基,从而切断反应[2],维持体内氧化稳定性。CS含有还原性的氨基巯基,能有效清除自由基,保护生物大分子中的巯基免受氧化,也可通过自身途径或间接地提高抗氧化酶的活性,其中超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶等构成了抵抗自由基的内源性细胞屏障,这些酶的作用是将活性物质转化为非自由基和无毒的产物[38],因此RP-CS具有提高机体抗氧化功能的作用。过氧化氢酶广泛存在于所有动物组织中,可以避免羟基自由基的产生,保护细胞成分免受过氧化物酶体的氧化损伤[39]。超氧化物歧化酶是一种金属蛋白,它通过降低超氧阴离子的稳态来保护细胞免受ROS的伤害,终止自由基连锁反应,修复细胞,减少超氧化物对细胞的损害。而超氧化物歧化酶降低超氧阴离子的过程中会产生过氧化氢和分子氧,进而可被过氧化氢酶或谷胱甘肽过氧化物酶反应所抵消,从而降低细胞损伤程度[40]。谷胱甘肽过氧化物酶是细胞内最为关键的一种解毒酶,能消除细胞代谢过程产生的有害过氧化物,保持细胞内自由基相对平衡,避免细胞内外有害物质对膜系统结构和功能破坏。本研究发现,与对照组相比,饲粮中添加0.02%、0.04%、0.06%的RP-CS显著提高了血清谷胱甘肽过氧化物酶活性,对血清过氧化氢酶活性无显著影响;饲粮中添加0.04%和0.06%的RP-CS显著提高了血清总超氧化物歧化酶活性。这表明饲粮中添加适量的RP-CS通过提高血液中谷胱甘肽过氧化酶和超氧化物歧化酶活性及降低丙二醛含量来改善舍饲滩羊抗氧化能力,避免过氧化伤害;至于饲粮中添加RP-CS对血清过氧化氢酶活性无显著影响,可能是超氧化物歧化酶降低超氧阴离子的过程中产生的过氧化氢或分子氧消耗了过氧化氢酶,因为随着RP-CS添加量的增加,血清过氧化氢酶活性有增长的趋势,但有待进一步研究证实。
4 结 论
① 饲粮中添加0.04%的RP-CS可显著提高舍饲滩羊生长性能。
② 饲粮中添加0.02%、0.04%和0.06%的RP-CS均可不同程度增加舍饲滩羊养分表观消化率。
③ 饲粮中添加0.02%、0.04%和0.06%的RP-CS均可不同程度改善舍饲滩羊肉品质和增强抗氧化功能。
④ 综合评价得出,舍饲滩羊饲粮中RP-CS适宜添加量为0.04%。

