嗜酸乳杆菌抗氧化活性评价及其对小鼠单核巨噬细胞氧化应激的影响
王 恒 李建喜 郭志廷 岳 聪 张 康 仇正英 张 凯 王 磊 王贵波 王学智 杨孝朴 张景艳*
(1.中国农业科学院兰州畜牧与兽药研究所,甘肃省中兽药工程技术研究中心,兰州 730050;2.甘肃农业大学动物医学院,兰州 730070)
巨噬细胞在特异性免疫系统和非特异性免疫系统中发挥重要作用,具有“多面性”,与多种疾病的产生及防御有关。在外源性刺激时,巨噬细胞最先作出反应,对异源性物质进行吞噬、处理、加工以及递呈,此过程伴随电子的转移,是氧化胁迫的主要来源,巨噬细胞是机体抗氧化与免疫调控相关机制研究中的一个重要工具细胞。
嗜酸乳杆菌(Lactobacillusacidophilus)是革兰氏阳性菌,主要存在小肠中。研究发现,饲料中添加0.42%嗜酸乳杆菌(0.72×108CFU/g)可显著促进斜带石斑鱼幼鱼的生长,并提高其抗病力和肠道消化酶活性[7]。嗜酸乳杆菌S-层蛋白还可以提高小鼠巨噬细胞的吞噬活性,促进免疫信号分子NO的释放,调节细胞因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)的表达水平[8]。嗜酸乳杆菌能使抗生素诱导的肠道菌群明显恢复,可降低雏鸡白痢的发病率并提高治愈率,增强雏鸡对致病性大肠杆菌侵染的抵抗能力等[9-10]。然而有关嗜酸乳杆菌的抗氧化方面的研究尚未见报道。鉴于此,本研究通过比较嗜酸乳杆菌培养物不同组分的抗氧化能力,评价其上清液对小鼠单核巨噬细胞(RAW 264.7细胞)NO含量、ROS水平和SOD、GSH-Px活性的影响以及对LPS诱导的氧化损伤的保护作用,旨在寻找嗜酸乳杆菌中抗氧化活性组分,并明确嗜酸乳杆菌抗氧化活性组分对巨噬细胞氧化应激的影响。
1 材料与方法
1.1 试验菌株与细胞
嗜酸乳杆菌BNCC 185342购自北纳创联生物技术有限公司,RAW 264.7细胞购自上海晅科生物科技有限公司。
1.2 试验试剂
1,1-二苯基-2-三硝基苯肼(DPPH)、丁基化羟基甲苯(BHT)购自上海源叶生物科技有限公司;1,10-邻二氮菲(1,10-phenanthroline)、吐温20(Tween 20)、亚油酸、硫代巴比妥酸(TBA)购自北京索莱宝科技有限公司,DMEM培养基、胎牛血清(FBS)购自美国Gicbo公司,GSH-Px、SOD、ROS试剂盒购自上海碧云天生物技术有限公司,Griess试剂购自美国ThermoFisher公司,LPS(大肠杆菌O55∶B5)购自美国Sigma公司,CCK-8试剂盒购自上海泽塔生物科技有限公司。其他化学试剂均为国产分析纯。
1.3 嗜酸乳杆菌复苏及嗜酸乳杆菌培养物不同组分制备
在37 ℃水浴锅中迅速融解-80 ℃保存的嗜酸乳杆菌,接种于MRS营养肉汤,37 ℃培养24 h,传至2~3代,用于后续试验。
参考Ragul等[4]的方法,并略作改动。将培养好的嗜酸乳杆菌调整细菌浓度为1×108CFU/mL,4 500×g离心10 min,收集上清液,用0.22 μm滤器过滤,得到无细胞的上清液;离心后的细胞颗粒用0.01 mmol/L磷酸盐缓冲液(PBS,pH 7.4)洗涤3次,再悬浮在PBS中,调整细菌浓度为1×108CFU/mL,得到完整细胞;将细菌浓度为1×108CFU/mL的完整细胞置于超声细胞破碎机中,并在冰浴条件下超声(50%功率工作5 s、停顿5 s,共处理40 min,12 000×g离心10 min)除去细胞碎片,得到无细胞的胞内提取物。
1.4 嗜酸乳杆菌培养物不同组分清除自由基的效果比较
1.4.1 DPPH清除率
参考Lin等[11]的方法,并略作改动。取500 μL样品与500 μL 0.1 mmol/L DPPH在1.5 mL离心管中混匀,放入30 ℃温箱避光30 min,用抗坏血酸作阳性对照,各样品组在517 nm吸光度值记为A样品;对照组以500 μL无水乙醇代替DPPH溶液,在517 nm吸光度值记为A对照;空白组以500 μL PBS或MRS肉汤代替样品溶液,在517 nm吸光度值记为A空白。用下式计算DPPH清除率:
DPPH清除率(%)=[1-(A样品-A对照)/
A空白]×100。
1.4.2 羟自由基清除率
参考Zhang等[12]的方法,并略作改动。取0.5 mL 1,10-邻二氮菲(1.875 mmol/L)、1 mL PBS(0.01 mmol/L,pH 7.4)和0.5 mL硫酸亚铁(FeSO4,1.875 mmol/L)混匀,分别添加0.5 mL样品和0.5 mL H2O2(0.1%),混合后置37 ℃温育1.5 h,测定536 nm吸光度值。用下式计算羟自由基清除率:
羟自由基清除率(%)=(As-An)/(Ab-An)×100。
式中:As为样品和H2O2吸光度值;An为PBS/MRS肉汤和H2O2吸光度值;Ab为PBS/MRS肉汤和水吸光度值。
1.4.3 亚油酸清除率
参考Lin等[11]的方法,并略作改动。取0.1 mL亚油酸、0.2 mL Tween 20和19.7 mL去离子水混合,制备亚油酸乳液(20 mL)。将1 mL亚油酸乳液、0.5 mL PBS(0.01 mmol/L,pH 7.4)、0.2 mL FeSO4(0.01%)、0.2 mL H2O2(0.01%)和0.5 mL嗜酸乳杆菌培养物不同组分样品混合,空白组用PBS或MRS肉汤代替样品,37 ℃孵育12 h后。取2 mL反应溶液与0.2 mL三氯乙酸(TCA;4%)、2 mL TBA(0.8%)和0.2 mL丁基化羟基甲苯(BHT,0.4%)混合,100 ℃孵育30 min,冷却后加入2 mL氯仿萃取。取200 μL上清液加入96孔板,测定532 nm吸光度值。用下式计算亚油酸清除率:
亚油酸清除率(%)=(1-A样品/A空白)×100。
式中:A样品为试验样品吸光度值;A空白为空白样品吸光度值。
1.5 嗜酸乳杆菌培养物上清液对RAW 264.7细胞增殖、释放NO及氧化水平的影响
1.5.1 嗜酸乳杆菌培养物上清液对RAW 264.7细胞增殖的影响
将消化后的RAW 264.7细胞离心,调整细胞浓度为5×105CFU/mL,接种于96孔板,静置12 h,弃上清液。对照组加入100 μL完全培养液(只含10% FBS),试验组每孔加入5、25、50、125 μL嗜酸乳杆菌培养物上清(将原液用完全培养基稀释10倍),在37 ℃、5% CO2培养箱中孵育24 h,用PBS清洗2遍,加入100 μL完全培养液和10 μL CCK-8溶液,37 ℃孵育1.5 h,测定450 nm吸光度值,计算细胞活力。
1.5.2 嗜酸乳杆菌培养物上清液对RAW 264.7细胞释放NO的影响
将消化后的RAW 264.7细胞离心,调整细胞浓度为1×106CFU/mL,接于6孔板,静置12 h。对照组加入1 mL完全培养液,试验组每孔加入5、25、50、125 μL嗜酸乳杆菌培养物上清液,并用完全培养液补足1 mL,在37 ℃、5% CO2培养箱中孵育24 h,收集上清液,根据Griess试剂说明书测定上清液中NO含量。
1.5.3 嗜酸乳杆菌培养物上清液对RAW 264.7细胞氧化水平的影响
细胞处理同1.5.2,收集上清液,ROS水平及SOD、GSH-Px活性采用试剂盒测定,根据试剂盒说明书进行操作。
1.6 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞氧化应激的影响
1.6.1 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞释放NO的影响
将RAW 264.7细胞以1×106CFU/mL接于6孔板后,静置12 h。对照组加入1 mL完全培养液,试验组每孔加入25、125 μL嗜酸乳杆菌培养物上清液,用完全培养液补足1 mL,在37 ℃、5% CO2培养箱中孵育12 h,弃上清液,加入0.5 μg/mL LPS孵育24 h,以0.5 μg/mL LPS孵育24 h作为阳性对照(LPS组),收集上清液,根据Griess试剂说明书测定上清液中NO含量。
1.6.2 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞SOD和GSH-Px活性的影响
细胞处理同1.6.1,收集上清液,SOD和GSH-Px活性采用试剂盒测定,根据试剂盒说明书进行操作。
1.7 统计分析
数据经Excel 2010整理后,采用GraphPad Prism 5软件进行单因素方差分析(one-way ANOVA),差异显著时采用Tukey氏法进行多重比较,差异显著性水平设为P<0.05。
2 结果与分析
2.1 嗜酸乳杆菌培养物上清液、完整细胞及胞内提取物对DPPH、羟自由基和亚油酸清除率的影响
分别制备嗜酸乳杆菌培养物上清液、完整细胞及胞内提取物,比较它们对DPPH、羟自由基和亚油酸清除率的影响,结果见图1。抗坏血酸以及嗜酸乳杆菌培养物上清液、完整细胞和胞内提取物的DPPH清除率(图1-A)分别为96.63%、86.98%、16.24%和68.03%,羟自由基清除率(图1-B)分别为54.03%、68.93%、33.61%和12.65%;嗜酸乳杆菌培养物上清液、完整细胞和胞内提取物的亚油酸清除率(图1-C)分别为15.21%、4.82%和6.75%。嗜酸乳杆菌培养物上清液的DPPH、羟自由基和亚油酸清除率均显著高于嗜酸乳杆菌培养物完整细胞和胞内提取物(P<0.05)。因此,选用嗜酸乳杆菌培养物上清液作用于RAW 264.7细胞,探究嗜酸乳杆菌培养物上清液对RAW 264.7细胞抗氧化的调节作用。
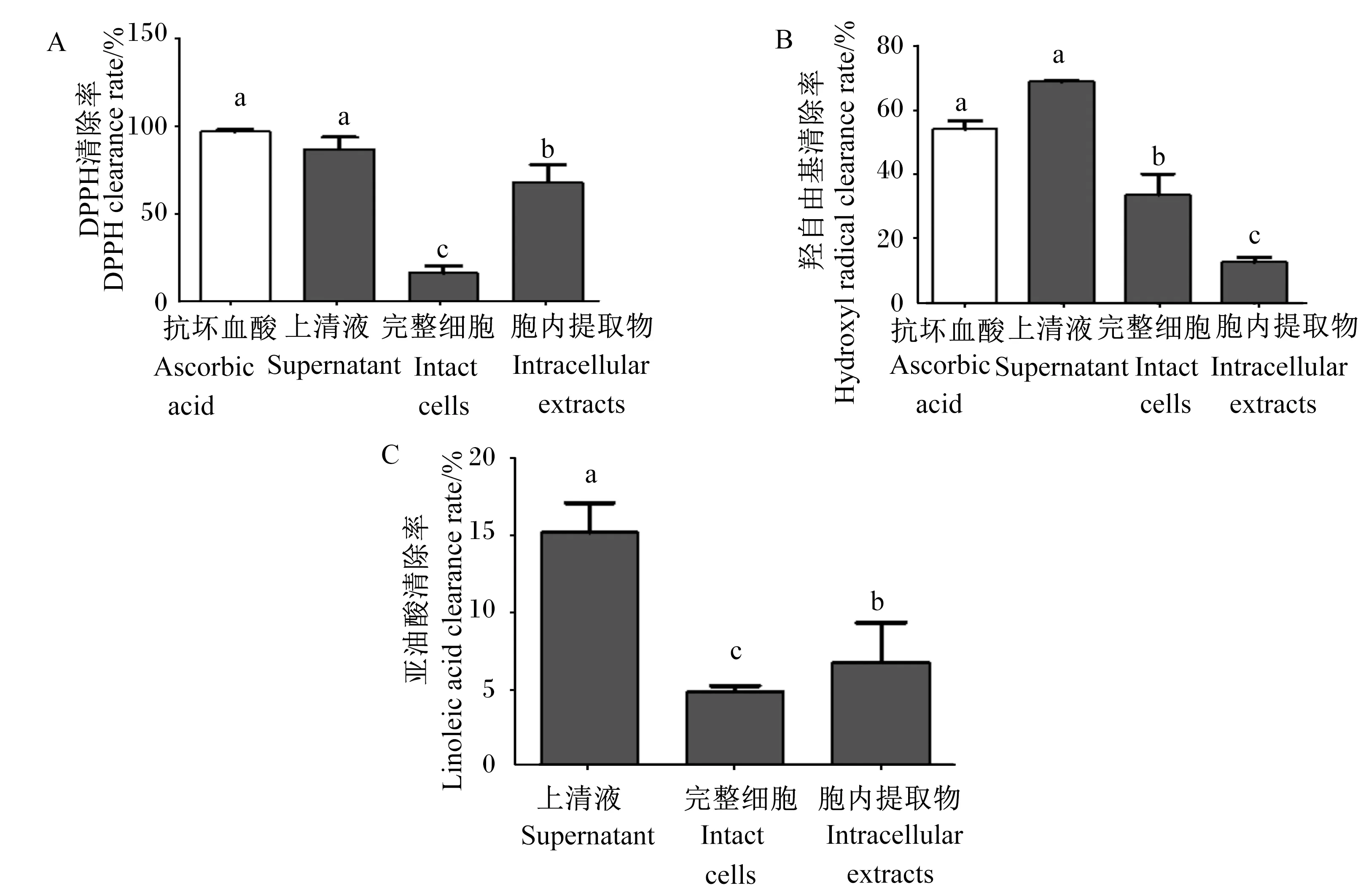
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。
2.2 嗜酸乳杆菌培养物上清液对RAW 264.7细胞增殖的影响
由图2可知,随着嗜酸乳杆菌培养物上清液剂量增大,RAW 264.7细胞的细胞活力呈现先上升后下降的趋势,与对照组相比,25、50和125 μL嗜酸乳杆菌培养物上清液显著提高了RAW 264.7细胞的细胞活力(P<0.05)。
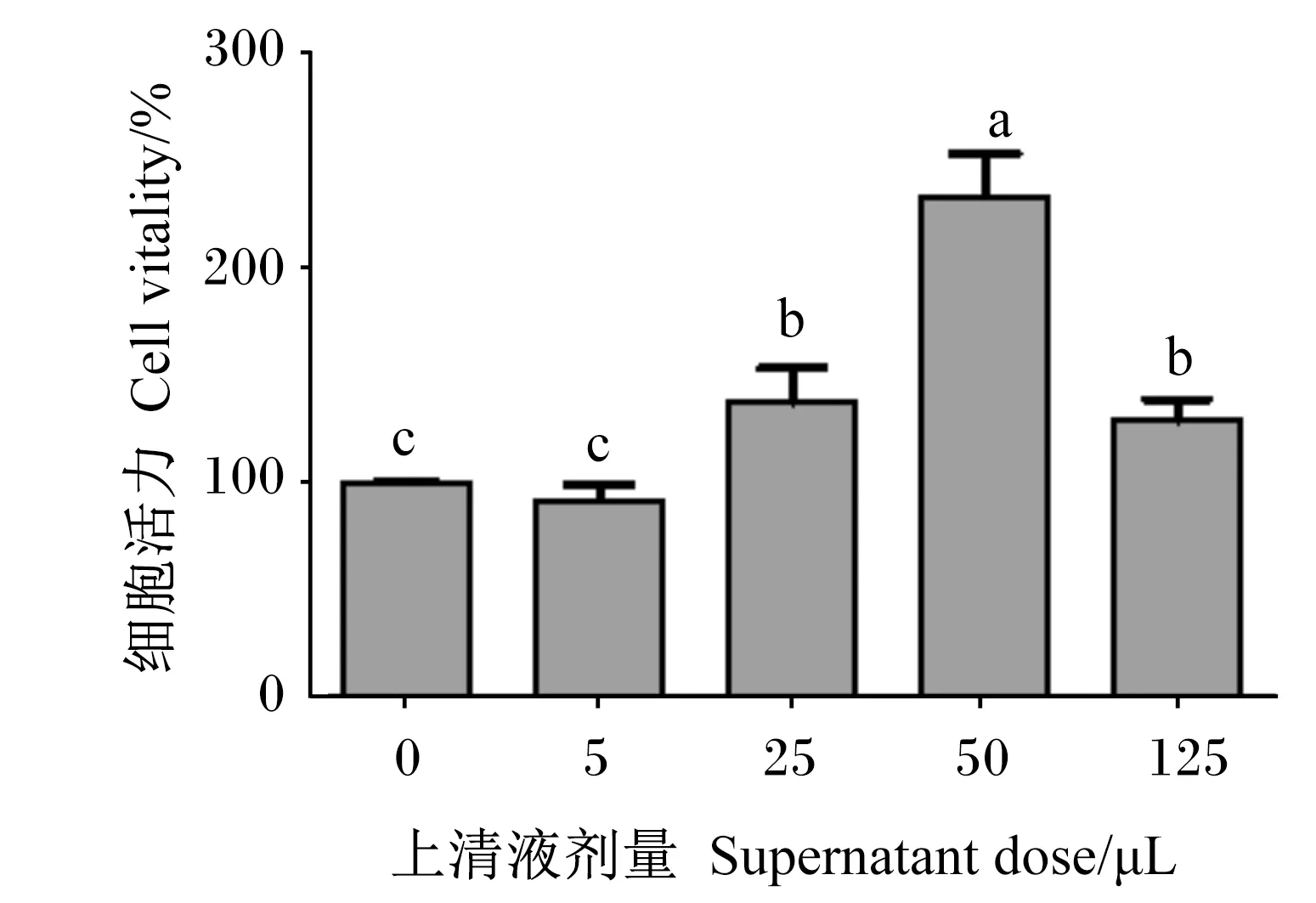
图2 嗜酸乳杆菌培养物上清液对RAW 264.7细胞增殖的影响 Fig.2 Effects of Lactobacillus acidophilus culturesupernatant on proliferation of RAW 264.7 cells
2.3 嗜酸乳杆菌培养物上清液对RAW 264.7细胞中NO含量的影响
由图3可知,随着嗜酸乳杆菌培养物上清液剂量增大,RAW 264.7细胞中NO含量逐渐升高。与对照组相比,5、25和50 μL嗜酸乳杆菌培养物上清液提高了RAW 264.7细胞中NO含量,但无显著差异(P>0.05);125 μL嗜酸乳杆菌培养物上清液显著提高了RAW 264.7细胞中NO含量(P<0.05)。
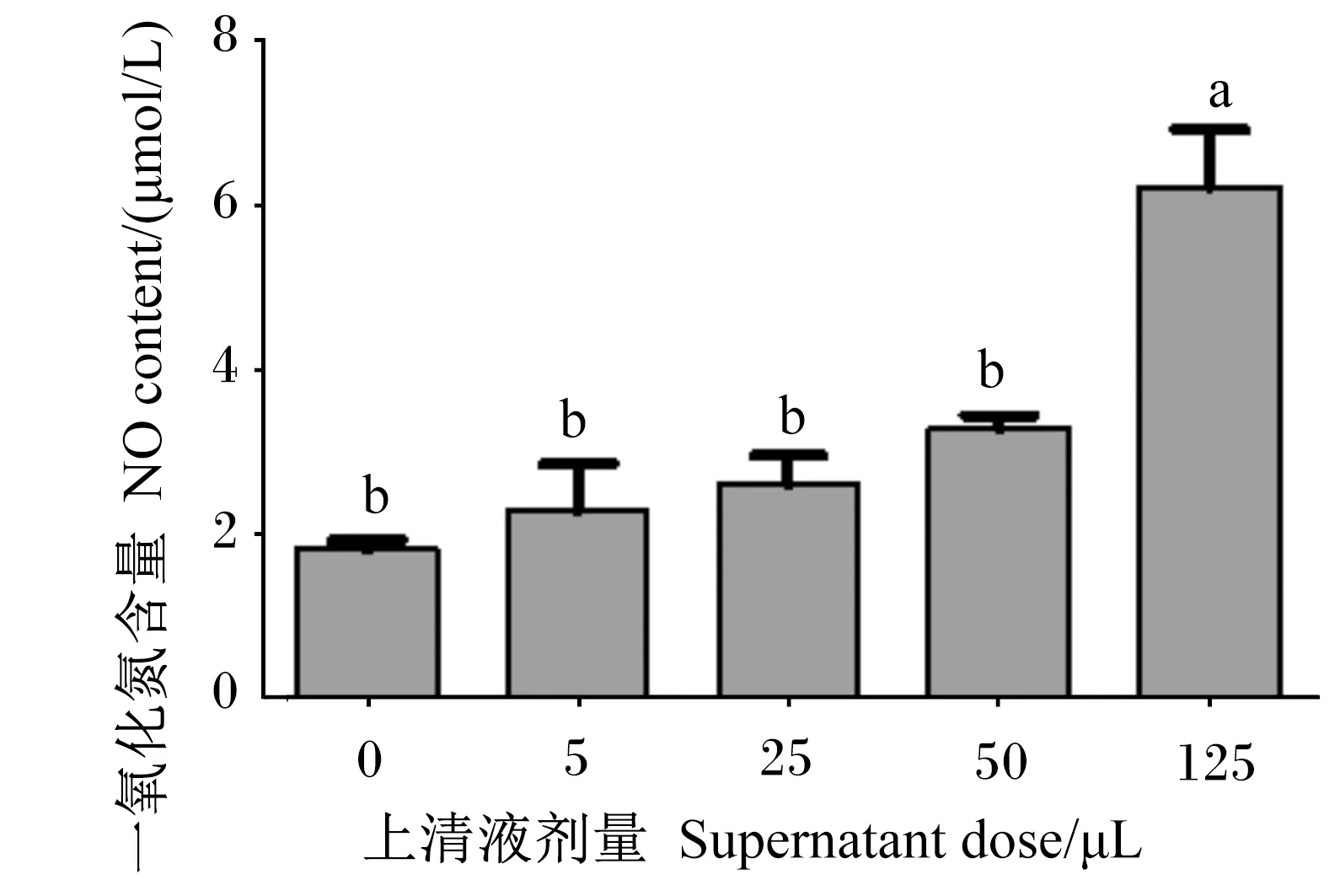
图3 嗜酸乳杆菌培养物上清液对RAW 264.7细胞中NO含量的影响 Fig.3 Effects of Lactobacillus acidophilus culture supernatant on NO content of RAW 264.7 cells
2.4 嗜酸乳杆菌培养物上清液对RAW 264.7细胞中ROS水平的影响
由图4可知,与对照组相比,5、25、50和125 μL嗜酸乳杆菌培养物上清液对RAW 264.7细胞中ROS水平均无显著影响(P<0.05)。与5、25 μL嗜酸乳杆菌培养物上清液相比,125 μL嗜酸乳杆菌培养物上清液显著提高了RAW 264.7细胞中ROS水平(P<0.05)。
2.5 嗜酸乳杆菌培养物上清液对RAW 264.7细胞中SOD和GSH-Px活性的影响
由图5-A可知,与对照组相比,25和50 μL嗜酸乳杆菌培养物上清液显著提高了RAW 264.7细胞中SOD活性(P<0.05),5和125 μL嗜酸乳杆菌培养物上清液对RAW 264.7细胞中SOD活性无显著影响(P>0.05)。
由图5-B可知,与对照组相比,5、25和50 μL嗜酸乳杆菌培养物上清液对RAW 264.7细胞中GSH-Px活性无显著影响(P>0.05),125 μL嗜酸乳杆菌培养物上清液显著降低了RAW 264.7细胞中GSH-Px活性(P<0.05)。
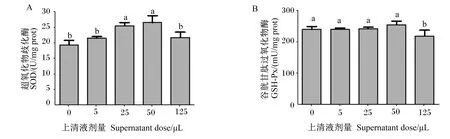
图5 嗜酸乳杆菌培养物上清液对RAW 264.7细胞中SOD、GSH-Px活性影响Fig.5 Effects of Lactobacillus acidophilus culture supernatant on SOD and GSH-Px activities of RAW 264.7 cells
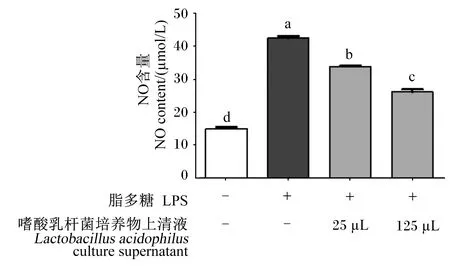
2.6 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞中NO含量的影响
由图6可知,与对照组相比,0.5 μg/mL LPS显著提高了RAW 264.7细胞中NO含量(P<0.05)。与LPS组相比,25、125 μL嗜酸乳杆菌培养物上清液显著降低了LPS诱导的RAW 264.7细胞中NO含量(P<0.05)。其中,125 μL嗜酸乳杆菌培养物上清液组RAW 264.7细胞中NO含量量显著低于25 μL嗜酸乳杆菌培养物上清液组(P<0.05)。
2.7 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞中SOD、GSH-Px活性的影响
由图7-A可知,与对照组相比,0.5 μg/mL LPS降低了RAW 264.7细胞中SOD活性,但差异不显著(P>0.05)。与LPS组相比,25、125 μL嗜酸乳杆菌培养物上清液显著提高了LPS诱导的RAW 264.7细胞中SOD活性(P<0.05)。其中,125 μL嗜酸乳杆菌培养物上清液组RAW 264.7细胞中SOD活性显著低于25 μL嗜酸乳杆菌培养物上清液组(P<0.05),但25、125 μL嗜酸乳杆菌培养物组均显著高于对照组和LPS组(P<0.05)。
由图7-B可知,与对照组相比,0.5 μg/mL LPS显著降低了RAW 264.7细胞中GSH-Px活性(P<0.05)。与LPS组相比,25 μL嗜酸乳杆菌培养物上清液显著提高了LPS诱导的RAW 264.7细胞中GSH-Px活性(P<0.05)。
-:未添加 not added;+:添加 added。下图同 The same as below.
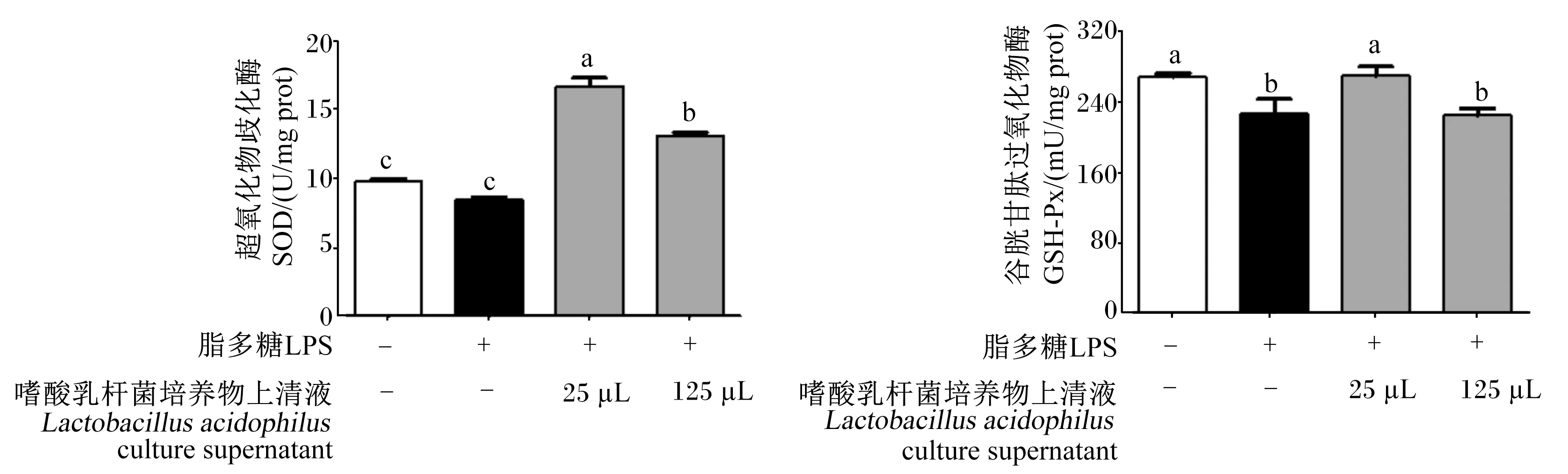
图7 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞中SOD、GSH-Px活性的影响Fig.7 Effects of Lactobacillus acidophilus culture supernatant on SOD and GSH-Px activities of RAW 264.7 cells induced by LPS
3 讨 论
3.1 嗜酸乳杆菌培养物不同组分清除自由基的效果比较
氧化应激是自由基在体内产生的一种负面作用,被认为是导致衰老和疾病的一个重要因素。益生菌的抗氧化功能可通过清除自由基的方式来减缓氧化应激反应,也可通过酶防御系统和非酶防御系统抵御ROS引起的氧化应激,调节机体氧化损伤[13]。据报道,植物乳杆菌[5]、干酪乳杆菌亚种casei SY13和保加利亚乳杆菌LJJ[12]对DPPH和羟自由基具有清除能力,长双歧杆菌ATCC 15708和嗜酸乳杆菌ATCC 4356[11]对DPPH和亚油酸具有清除能力,嗜热链球菌821和长双歧杆菌15708[14]、干酪乳杆菌KCTC 3260[15]的完整细胞和胞内提取物均对羟自由基和亚油酸具有清除能力,鼠李糖乳杆菌[16]上清液也对DPPH具有清除能力。本研究也发现,嗜酸乳杆菌培养物上清液、完整细胞和胞内提取物对DPPH、羟自由基和亚油酸均具有清除能力,但清除能力不同;嗜酸乳杆菌培养物上清液对DPPH、羟自由基和亚油酸清除能力高于嗜酸乳杆菌培养物完整细胞和胞内提取物,嗜酸乳杆菌培养物完整细胞对羟自由基清除能力高于嗜酸乳杆菌培养物胞内提取物,而嗜酸乳杆菌培养物胞内提取物对DPPH和亚油酸的清除能力高于嗜酸乳杆菌培养物完整细胞,这种差异性与菌株的特定性质有关。
3.2 嗜酸乳杆菌培养物上清液对RAW 264.7细胞增殖、释放NO及氧化水平的影响
巨噬细胞是机体天然免疫系统重要的免疫细胞,在外来物质刺激下,巨噬细胞活化、吞噬、溶解异物,维持机体内环境稳定,是天然免疫和后天免疫的重要桥梁。研究表明,LPS通过激活诱导型一氧化氮合酶(iNOS)刺激巨噬细胞诱导氧化应激。维生素C可通过提高四氢生物喋呤的稳定性来维持iNOS活性,从而保护巨噬细胞免受LPS诱导的氧化应激[17]。
本研究分别将5、25、50和125 μL嗜酸乳杆菌培养物上清液作用于RAW 264.7细胞,结果发现,5、25、50和125 μL嗜酸乳杆菌培养物上清液对RAW 264.7细胞无毒性作用。而RAW 264.7细胞中NO含量与嗜酸乳杆菌培养物上清液具有剂量依赖性关系。研究表明,NO是脂溶性的,在生物膜中迅速扩散,可以调节自然杀伤细胞、中性粒细胞和肥大细胞的功能活动,并影响几种细胞因子的产生,增强机体免疫系统功能[18-19]。本研究中,RAW 264.7细胞中NO含量上升可能与免疫系统有关,但还需进一步验证。
ROS是各种自由基的总称,其在体内积聚会导致炎症等各种病理变化。本研究发现,5、25和50 μL嗜酸乳杆菌培养物上清液对RAW 264.7细胞中ROS水平无显著影响,说明5、25和50 μL嗜酸乳杆菌培养物上清液不会引起细胞内ROS紊乱。
SOD和GSH-Px是细胞内的抗氧化酶,可以防止氧化应激[20]。植物乳杆菌C88能提高D-半乳糖处理小鼠机体的SOD和GSH-Px活性[21]。发酵乳杆菌可通过提高抗氧化酶,包括肝脏SOD、GSH-Px和过氧化氢酶(CAT)活性来保持正常猪的健康生长[22]。丹参酮ⅡA明显逆转了颅脑外伤诱导的氧化应激和细胞凋亡,MDA含量减少,SOD和GSH-Px活性增加[23]。本研究也发现,25和50 μL嗜酸乳杆菌培养物上清液可引起RAW 264.7细胞SOD活性升高,但对GSH-Px活性无显著影响;当嗜酸乳杆菌培养物上清液剂量升高至125 μL时,可以显著降低RAW 264.7细胞中SOD和GSH-Px活性。
综上所述,与对照组相比,25和50 μL嗜酸乳杆菌培养物上清液可促进RAW 264.7细胞增殖,升高RAW 264.7细胞中NO含量和SOD活性;与25 μL嗜酸乳杆菌培养物上清液相比,50 μL嗜酸乳杆菌培养物上清液有提高NO含量、ROS水平和SOD、GSH-Px活性趋势,但无显著差异,而125 μL嗜酸乳杆菌培养物上清液抑制了SOD和GSH-Px活性。因此,选用25和125 μL嗜酸乳杆菌培养物上清液作用于后续试验。
3.3 嗜酸乳杆菌培养物上清液对LPS诱导的RAW 264.7细胞氧化应激的影响
乳酸杆菌是一种益生菌,在自然界中分布广泛,具有物种多样性。一些乳酸杆菌及其代谢产物对机体氧化应激具有较好的保护作用,是发挥其益生性的一个重要方面。研究表明,植物乳杆菌KSFY 06在体内外通过提高SOD和GSH-Px活性,降低NO含量保护LPS诱导的小鼠急性肝损伤[24]。原花青素通过抑制氧化应激,下调放射性心脏损伤小鼠的MDA含量,上调SOD、GSH-Px活性,抑制心脏损伤[25]。Wang等[26]使用大肠杆菌(Escherichiacoli)O141∶K99诱导断奶犊牛氧化应激,β-葡聚糖能提高28日龄断奶犊牛的抗氧化功能,降低EscherichiacoliO141∶K99感染后氧化应激的发生率。本研究利用0.5 μg/mL LPS 37 ℃处理RAW 264.7细胞24 h后,可成功引起RAW 264.7细胞中NO含量显著升高。选用25和125 μL嗜酸乳杆菌培养物上清液处理12 h后,再以LPS刺激RAW 264.7细胞24 h的作用方式,评价嗜酸乳杆菌培养物上清液对RAW 264.7细胞氧化应激的预防和保护作用,结果发现,25 μL嗜酸乳杆菌培养物上清液可显著升高RAW 264.7细胞中SOD和GSH-Px活性,降低NO含量。该结果表明嗜酸乳杆菌培养物上清液可同通过干预细胞SOD、GSH-Px活性,发挥对LPS诱导的RAW 264.7细胞氧化应激的保护作用。
4 结 论
① 嗜酸乳杆菌培养物上清液、完整细胞和胞内提取物均具有清除DPPH、羟自由基和亚油酸的能力,其中嗜酸乳杆菌培养物上清液的清除能力较强。
② 嗜酸乳杆菌培养上清液对RAW 264.7细胞具有抗氧化作用,可通过降低NO含量,提高SOD、GSH-Px活性调节LPS诱导的RAW 264.7细胞的氧化应激。

