骨髓间充质干细胞诱导分化为肝细胞的研究进展
李裕珍冯丽娟潘益巧阮博文周晓玲
(1.广西中医药大学,南宁53000;2.广西中医药大学第三附属医院,广西 柳州 545000)
骨髓间充质干细胞(bone marrow stem cells,BMSCs)是属于中胚层的一类多能干细胞,存在于骨髓中的基质干细胞,为最早发现的多向分化潜能干细胞,具有自我增殖、多向分化、免疫调节、促进造血及修复损伤器官的作用[1-2],且在不同诱导条件下可以向肝细胞、心肌细胞、神经细胞、成骨细胞等分化[3-4]。由于BMSCs多向分化功能,且容易获取、体外增殖快、传代基因稳定性良好、移植免疫排斥少等优点使其成为近年诱导分化研究的热点[5]。大量动物研究表明,通过细胞移植技术将BMSCs移植进入受损肝中,对损伤的肝具有一定的修复作用,其主要是通过不同的诱导条件使BMSCs定向分化为有功能的肝细胞[6-7];临床研究也发现,自体移植BMSCs可以改善肝病患者各项生化指标,减少晚期肝病患者不良反应,有效提高其生活质量[8-9]。然而,对于BMSCs的常用分离培养和鉴定方法,以及其向肝细胞分化的诱导方法及分化机制尚缺乏系统整理及总结。因此本文主要对此进行综述,为更好发挥BMSCs在肝损伤性疾病治疗中的应用提供思路。
1 BMSCs的常用分离培养和鉴定方法
1.1 BMSCs的常用分离培养方法
目前常用的BMSCs分离培养方法有全骨髓贴壁分离培养法、骨组织消化分离法、离心法、流式细胞仪分离法、免疫磁珠分选法等[10-12],其中后两者因操作复杂、分离成本高且分离后细胞转化效果差等使其运用受限,目前大多数研究中使用的是操作更为方便且获得细胞数量较多、增殖能力较强的全骨髓贴壁分离法和密度梯度离心法[13],但因其分离纯度欠佳,因此有学者在全骨髓贴壁分离法基础上进行创新优化,其中徐丽娟等[14]创新性地使用小鼠3 d乳鼠骨片法,将乳鼠骨片直接进行培养,当梭形细胞在骨片周围密度大于50%时,按比例进行三次传代,此法获得了纯度较高的BMSCs;向俊西等[15]则在接种一定时间后将接种不满意的细胞进行重新接种,并按12、24 h更换一次培养液,经优化后的诱导方法更简便、快捷地获得了满意的大鼠BMSCs;两者改良后的培养方法最后均可得到纯度较高的BMSCs,有效解决因细胞分离纯度不佳影响实验结果的问题,更有利于实验的研究。
1.2 BMSCs常用鉴定方法
在BMSCs鉴定方面,文献多报道BMSCs在形态上表现为纤维状或长梭形[16-17],未发现其特异性的表面标志物,但因其不表达造血干细胞表面标志物,故常用阴性和阳性选择相结合的方法进行鉴定。现认为成熟且合格的BMSCs多表达阳性或强阳性的CD29、CD90、CD73、CD105、CD49,不表达或弱表达CD11、CD31、CD34、CD44、CD45等[18-20]。
2 BMSCs诱导向肝细胞分化的常用方法
BMSCs具有多向分化性,但其向肝细胞分化需要严格的分化条件及多种细胞因子的参与,因此如何提高及保证BMSCs向肝细胞分化的有效率并将其应用于临床治疗是目前研究的重点和难点。研究发现通过相应的物质诱导,如中药含药血清、细胞因子、模拟肝样微环境或其他物理干预等诱导的方式,可促使BMSCs不同程度地向肝细胞分化。
2.1 中药含药血清诱导
目前中药被广泛应用于肝病的临床治疗中,特别是对于中晚期肝病,中药有明显改善患者临床症状且毒副作用小、不良反应少等特点,为中药方剂联合BMSCs移植治疗终末期肝病提供新思路,但由于中药复方成分多样且复杂,作用靶点广泛,同时也限制了对其机制的研究。因此探索利用中药含药血清促使BMSCs向肝细胞分化也是现今热点。
活血化瘀类中药复方是治疗气滞血瘀型肝硬化的经典方剂。研究表明鳖甲煎丸含药血清对BMSCs向肝细胞转化有促进作用,且有改善肝纤维化及调节免疫等作用,肯定了中药对BMSCs诱导分化的作用,但具体的作用机制尚未明确[21]。韩海啸等[22]研究发现,调肝益气通络汤药物血清不仅可以有效诱导BMSCs定向分化为肝细胞,且对BMSCs具有增殖作用,并随着药物浓度的增加及培养时间的延长,细胞数量就不断增多。另外,基于“肾主骨生髓”理论,Zhou等[23]通过评估不同干预办法移植BMSCs治疗肝硬化大鼠的疗效,选用BMSCs联合中药济生肾气汤(JSSQ组)进行干预,结果证实了中药济生肾气汤联合BMSCs移植对改善肝硬化大鼠的治疗作用,其机制可能JSSQ具有滋补肝肾,促进骨髓再生的功能,其在体内发挥了类似于细胞归巢诱导剂的作用,促进了BMSCs的诱导分化及迁移,从而参与肝细胞的再生修复。瘀血阻络、肝肾阴虚型均是终末期肝病患者的主要证型之一[24],在诱导BMSCs向肝细胞分化过程中,多数学者[21-22]以活血化瘀、调肝通络功效的方药为主,诱导分化结果良好,而部分学者[23,25]以补肾生髓、滋阴养血法也明显改善了大鼠肝纤维化程度,详见表1。因此活血化瘀法中药血清诱导是否适应于所有终末期肝病尚待进一步研究,针对不同证型的肝病所采用中药含药血清的可进行不断地探索。
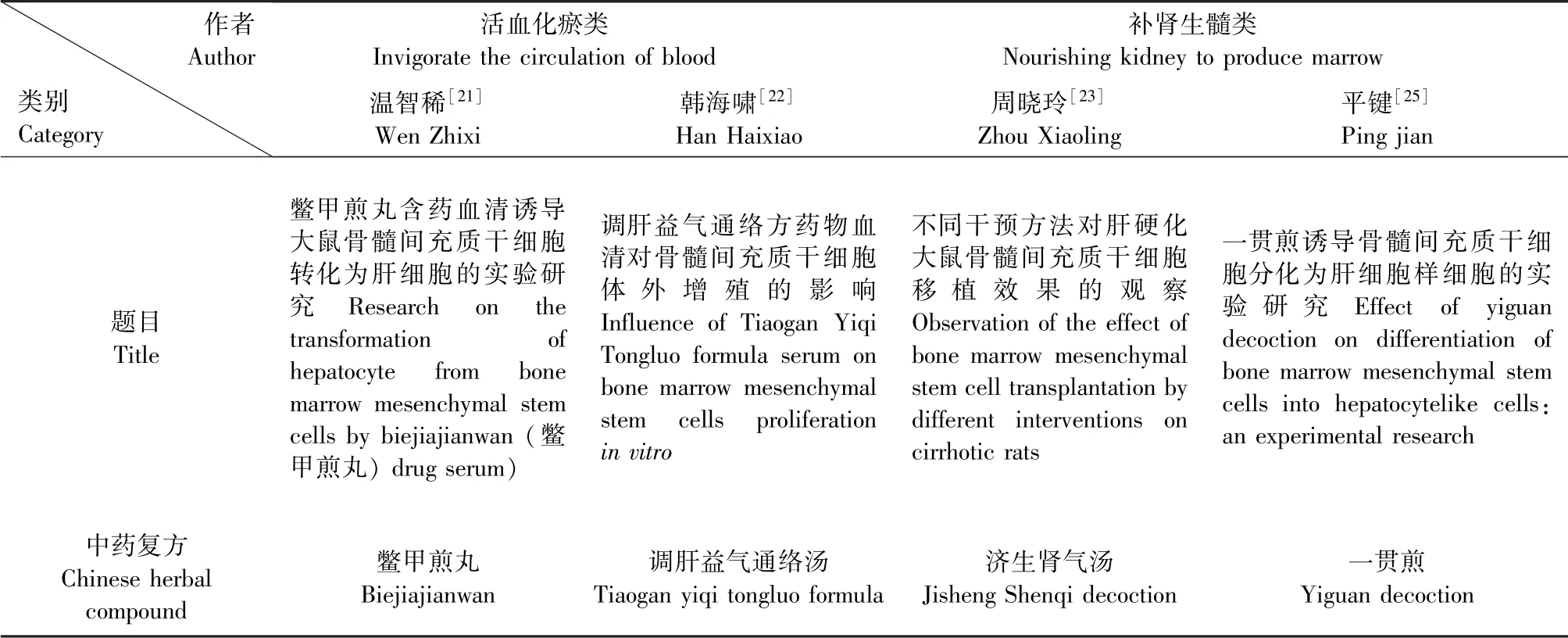
表1 常用中药含药血清分类及代表Table 1 Classification and representation of commonly used Chinese medicine sera containing drugs
2.2 细胞因子诱导
细胞因子是一类由免疫细胞和某些非免疫细胞经刺激而合成、分泌的具有广泛生物活性的小分子蛋白质,现多被应用于诱导BMSCs向肝细胞分化。潘兴南等[26]研究发现肝细胞生长因子(hepatocyte growth factor,HGF)体外诱导BMSCs向肝细胞分化以质量浓度≥20μg/L且诱导时间≥6 h/d为宜,诱导效果与HGF浓度及每日诱导时间呈正相关性。Putra等[27]发现在血管内皮生长因子(vascular endothelial growth factor,VEGF)的刺激下,BMSCs可向损伤肝组织迁移并可进一步转化为原代肝细胞,且发现静脉内给药途径是BMSCs移植的最佳途径。吴增城等[28]探讨半乳糖凝集素-3(Gal-3)联合HGF诱导大鼠BMSCs向肝细胞转化的可行性及最佳诱导剂量,观察记录不同浓度及不同时间下BMSCs的细胞形态学改变,结果发现各组BMSCs形态逐渐向肝细胞分化,与阳性对照组细胞相似,其中浓度0.5μg/mL的组别在第28天时间段与对照组IAR20细胞最为相似,且甲胎蛋白、清蛋白荧光染色阳性率最高,mRNA表达较其它各组明显增高。谭铭辉等[29]发现使用galectin-3诱导BMSCs分化为肝细胞会出现白蛋白(albumin,ALB)mRNA及角蛋白18(cytokeratin 18,CK-18)mRNA及AFP蛋白表达增加,与HGF联合进行诱导时可提高BMSCs向肝细胞诱导分化的效率。
2.3 中药含药血清联合细胞因子诱导
Fu等[30]采用中药一贯煎含药血清联合HGF和基质细胞衍生因子1(stromal cell derived factor-1,SDF-1)在体外诱导BMSCs向肝细胞分化,结果表明含中药血清组(YGJ组)经过一定的时间诱导后,BMSCs的形态逐渐向肝细胞样转化,其所含ALB和CK-18阳性细胞的比例均比其它组升高。由此说明一贯煎含药血清联合与HGF和SDF-1诱导小鼠BMSCs可以促进其定向分化为肝细胞,较单纯的细胞因子诱导转化率高。陈艳等[31]从中药姜黄中提取姜黄素联合成纤维细胞生长因子-4,FGF-4)诱导BMSCs定向分化发现,发现适当剂量的姜黄素可单独有效诱导BMSCs分化为肝细胞,但联合FGF-4的时候可降低姜黄素的浓度,且安全可靠,值得进一步研究其具体作用机制。
2.4 模拟肝微环境
微环境在BMSCs向肝细胞定向分化过程中有至关重要的作用,通过模拟肝脏微环境可诱导干细胞向肝细胞分化,但具体的机制尚待研究。彭琴等[32]发现肝衰竭组及中药含药组中的甲胎蛋白、肝组织蛋白、吲哚胺2,3—双加氧酶表达均高于正常组,且中药含药组的蛋白表达量高于肝衰竭组,证明了中药含药血清能增强BMSCs在肝衰竭微环境下的肝细胞分化趋势及免疫调节活性,提高肝细胞分化率。Razban等[33]选用硫酸乙酰肝素和IV型胶原模拟肝微环境对BMSCs进行诱导分化,结果表明CYP3A4酶活性,AFP,ALB和c-MET蛋白水平升高,证明力BMSCs具有分化为肝样细胞、改善肝功能的功效。李伟等[34]认为胆汁淤积的病理状态下,可以为BMSCs向肝细胞的分化提供良好的细胞微环境,因此探讨瘀胆血清对大鼠BMSCs向肝细胞分化的影响,结果证明瘀胆血清可诱导BMSCs向肝细胞的定向分化,促进肝细胞的生长。
大量研究表明肝细胞和非肝实质细胞在体外共培养可通过异质细胞间的相互作用充分模拟肝细胞在体内的生存环境,促进肝细胞增殖与分化,并保持肝细胞特有的生物学功能。因此,共培养是肝细胞大规模、高活性培养并最终推广运用的理想培养方式。Zhang等[35]研究证明在共培养系统中,BMSCs保持正常增殖和活力的同时,强烈表达ALB、AFP和cytokeratin-18的mRNA蛋白水平,对BMSCs分化为肝细胞起了决定性的作用。另外,与传统的2 D培养基相比,3 D系统可高度模拟天然器官环境,既保持BMSCs的分化能力,也有利于维持肝细胞的高复制能力。Liu等[36]利用poly(lactic acid-glycolic acid)(PLGA)支架模拟3 D系统,将BMSCs和肝细胞进行共培养,结果证明了PLGA支架中BMSCs诱导分化为肝细胞的能力,而且表明1∶5(BMSCs:hepatocyte-like cells)的比例最适合BMSCs支持PLGA支架中的肝细胞代谢和稳定。
2.5 其它诱导方法
此外,张玮等[37]采用物理性的办法研究在针刺对治疗肝纤维化的体外作用机制,发现损伤及治疗均等物理刺激疗法可诱导BMSCs向肝细胞转化,提高大鼠血清中细胞因子水平和改善肝纤维化程度,其机制可能与自身修复代偿机制相关。孙婷[38]基于无创的超声靶向微泡破坏技术探讨诱导BMSCs靶向归巢及分化为肝细胞的可行性,发现该技术可改善受损肝组织功能及抑制细胞凋亡,促进肝细胞的生长。Li等[39]研究发现超声辐照结合HGF可加速人骨髓间充质干细胞的肝分化。选择物理性干预方法进行诱导BMSCs分化为肝细胞具有创伤小,副作用少的特点,对于实验的研究可控及可操作性强。
随着肝疾病进展至终末期肝病,门脉阻塞及门脉高压情况越来越严重,进一步导致的血流动力学改变造成肝组织严重缺血缺氧,因此学者Rehn等[40]探讨缺氧环境下BMSCs与肝细胞再生的关系,发现缺氧预处理可增强BMSCs和肝匀浆中的中VEGF的表达,提高细胞周期蛋白D1的表达并伴随血清白蛋白水平的提高,证明了缺氧情况下BMSCs可促进肝细胞的生长及转化,改善肝纤维化程度。许欣婷等[41]也证明了低氧环境下可促进BMSCs的增殖,利用细胞的转化。
3 BMSCs的体内诱导分化为肝细胞的途径
BMSCs不仅能在体外诱导分化为肝细胞,在体内也具有分化为肝样细胞的途径。Hwang等[42]将BMSCs植入肝硬化大鼠中,发现归巢至肝组织中的BMSCs,可经诱导分化为肝细胞样细胞,改善肝硬化大鼠的纤维化程度。Jang等[43]也证实了证实了BMSCs在体内被诱导分化为肝细胞,并发现TGFβ1信号通路的下游效应子P-Smad3/Smad3,且BMSCs移植抑制了Smad3的磷酸化。
4 BMSCs分化为肝细胞的相关机制
已有的研究表明,运用不同的诱导方法无论是在体内还是体外均可诱导BMSCs成功定向分化为肝细胞,但具体的分子机制尚未明确[44-45]。目前大部分学者认为,BMSCs定向分化为肝细胞是基于部分基因被选择性激活或出现差异性表达,从而使某些特异性蛋白合成及其空间分布。
4.1 Notch信号通路
Notch信号影响细胞正常形态发生的多个过程,包括细胞的分化、凋亡、增殖及细胞边界的形成。柳柯等[46]发现BMSCs向肝细胞定向分化过程中其关键基因mRNA表达也会下降,在第11天的时候以Jagged-2、Delta-1、Delta-3、Notch-1、Notch-2、Notch-3和Presenilin-1的mRNA下降最为明显;利用Jagged与BMSCs共同培养上调Notch信号通路其发现至21 d BMSCs才表达其表面标志物M2-PK和GST-P,明显晚于对照组,且分化至26 d时仍未见白蛋白表达,证明了下调Notch信号通路有助于BMSCs定向分化为肝细胞。徐洪雨等[47]在研究者发现随着细胞生长因子诱导BMSCs分化为肝细胞的分化率的增高,Notch-1蛋白表达及Notch-1 mRNA呈逐渐下降趋势。
4.2 NF-κB信号通路
NF-κB信号通路是控制许多细胞类型中细胞增殖,分化和凋亡的主要因素。Yang等[48]研究表明当阻断了NF-κB信号后HGF诱导BMSCs分化为肝细胞效果下降,表明了HGF通过NF-κB信号传导诱导BMSC向肝样细胞的分化,其中机制可能与NF-κB信号的激活对于肝细胞的增殖和微管形成相关。王怡等[49]探讨NF-κB在HGF和肝组织液(LTF)诱导BMSCs分化为肝细胞的影响中发现,经两种细胞因子诱导下,细胞内NF-κB蛋白及AAT蛋白表达量显著增加,但予NF-κκB抑制剂干预后,两者蛋白表达量随时间延长而明显下降。表明了NFκB信号通路对定向分化诱导的积极作用。
4.3 Wnt/β-catenin信号通路
Wnt/β-catenin信号通路是Wnt途径中的经典信号通路之一,在BMSCs分化为肝细胞中发挥重要的作用。Xiang等[50]在研究中发现使用中药一贯煎可促进BMSCs向肝细胞分化,在机制方面,当下调Wnt信号通路的同时会抑制干细胞的增殖转而分化为有功能的肝细胞。吉杨丹等[51]发现miR-26b可通过调节Wnt/β-catenin信号通路促进BMSCs向肝样细胞分化;曾令锋等[52]发现17β-E2作用于BMSCs时,除影响其生长激素的分泌量,还降低在氧化应激时的凋亡率,最后证明17β-E2对BMSCs分化为肝样细胞的促进作用,其机制可能与17β-E2下调Wntβ-catenin信号蛋白Wnt3a和β-Catenin有关。
4.4 钙离子对诱导分化的影响
钙离子是机体各项生理活动不可缺少的离子,在细胞的发生、生长及凋亡过程有着重要作用。焦淑贤等[53]发现钙离子参与了BMSCs分化为肝细胞的过程,当加入钙拮抗剂后BMSCs分化率明显降低,但是具体的作用机制及过程仍待进一步研究。
5 总结
运用BMSCs移植诱导分化为肝细胞技术治疗终末期肝病在动物实验方面取得了广泛的认可,通过中药含药血清、细胞生长因子和物理刺激等诱导方法均使BMSCs定向诱导分化肝细胞,都不同程度地改善了大鼠肝纤维化情况,为在临床上运用BMSCs移植治疗终末期肝病提供了重要的借鉴意义,也为重症肝病患者带来希望的曙光。但是即使BMSCs移植技术在动物实验方面取得了一定的疗效,而真正将该技术运用于临床仍是困难重重。首先从取材上来讲,20岁以后,人体BMSCs的分化能力明显下降,并且随着年龄的增长BMSCs的增殖能力也会逐渐下降,极有可能限制由BMSCs所分化得到的肝细胞的临床应用;其次对于BMSCs鉴定仍未能确定其特异性的表面标志物,最后BMSCs分化为肝细胞的调控机制尚未明确,对移植后会出现的不良反应及是否会进一步加重肝纤维化或加速疾病的进展尚待研究等。但BMSCs是具有巨大分化潜能及广阔临床应用前景的多功能干细胞之一,积极探索最佳的、能够定向诱导BMSCs向肝细胞分化的诱导方法或诱导剂、移植途径等,促进BMSCs的增值分化,发挥BMSCs对肝疾病的积极作用,提高BMSCs移植的临床运用率仍然是现今肝病领域研究的重点内容。

